STK11/LKB1突变使KRAS突变早期非鳞NSCLC的预后雪上加霜,术后辅助治疗应关注!
2024-03-18 苏州绘真医学 苏州绘真医学 发表于上海
本研究旨在探讨STK11/LKB1变异在局部非鳞状非小细胞肺癌(non-sq NSCLC)中的预后意义。
在KRAS突变的晚期肺腺癌患者中,STK11/LKB1突变与PD-1轴抑制剂原发耐药和不良预后相关。本研究旨在探讨STK11/LKB1变异在局部非鳞状非小细胞肺癌(non-sq NSCLC)中的预后意义。在随机辅助II期试验(NCT00775385 IFCT-1801 TASTE试验)中,对接受完全切除术的IIa、IIb或IIIa期(N2除外)non-sq NSCLC患者的手术样本进行了检查。患者接受标准化疗(培美曲塞+顺铂)或基于EGFR突变(厄洛替尼)和ERCC1表达的个体化治疗。使用靶向NGS分析肿瘤分子谱,并在调整相关临床变量后,分析其与总生存期(OS)和无病生存期(DFS)的相关性。此外,研究者评估了治疗组和分子变异在OS和PD-L1表达以及术后血浆样本中肿瘤循环DNA方面的相关性。
在134例患者中(主要为男性吸烟腺癌患者),KRAS突变与较短的DFS(HR:1.95,95%CI:1.1-3.4,p=0.02)和OS(HR:2.32,95%CI:1.2-4.6,p=0.014)相关。单独的STK11/LKB1突变(n=18)对DFS和OS无显著影响。然而,在KRAS突变样本(n=53)中,同时携带STK11/LKB1突变的患者(n=10)具有显著较短的DFS(HR:3.85,CI:1.5-10.2,p=0.006),并且OS有缩短的趋势(HR:1.80,CI:0.6-5.3,p 0.28)。未发现PD-L1表达、其他基因突变、无进展生存期(PFS)或OS之间存在关联。
这项分析进一步证实了KRAS突变是局部non-sq NSCLC复发和生存较差的预测因素。此外,同时存在STK11/LKB1突变加剧了KRAS突变亚群的预后。这些发现强调了这些分子标志物的临床相关性及其对non-sq NSCLC治疗策略的潜在影响。
-
KRAS突变预测局部non-sq NSCLC患者预后较差;
-
STK11/LKB1突变恶化KRAS相关预后;
-
靶向NGS揭示了分子标志物对生存的影响;
-
PD-L1表达与分子谱缺乏相关性。
研究背景
尽管近年来肺癌的诊断和治疗取得了重要进展,但它仍然是全球癌症死亡的主要原因。靶向治疗和免疫检查点抑制剂的开发显著改善了晚期疾病患者的PFS和OS。转移性NSCLC的治疗方案取决于检测到的体细胞致癌驱动基因或PD-L1表达水平。携带敏感EGFR、BRAF、KRAS p.G12C或MET激活突变(mut)的肿瘤可能从EGFR酪氨酸激酶抑制剂(TKI)、BRAF/MEK抑制剂、KRAS或MET抑制剂等靶向治疗中获益。癌基因融合(如ALK和ROS1)或涉及NRG1、NTRK或RET的罕见融合事件也可预测对特异性抑制剂的应答。目前正在评估使用激酶抑制剂和免疫疗法的辅助靶向策略用于局部疾病患者。这加强了对早期肿瘤进行更好的分子特征和更好的预后分层的需求,以识别将从辅助治疗中获益的患者。高通量二代测序技术的应用使得对可能是重要预后标志物的致癌驱动基因和肿瘤抑制基因进行广泛的分析成为可能。KRAS、EGFR、TP53、STK11或共突变在晚期肺癌中的预后价值进行了大量研究,因为大多数患者在医疗机构中都有可获得的分子数据。结果并不总是一致的,这凸显了小型回顾性系列研究在识别预后标志物方面的缺陷。然而,最近对晚期肺癌中STK11和KEAP1突变的关注表明,在接受免疫检查点抑制剂(ICIs)治疗的患者中,STK11突变与惰性肿瘤免疫环境、KEAP1突变和不良结局相关。对于局部患者,目标是完全切除治愈,然而,许多患者会复发。指南支持对复发风险高的患者采用新辅助或辅助化疗。危险度分层主要依据分期。对于早期患者,检测可帮助识别辅助治疗高危患者的预测性或预后性生物标志物仍然是一个重要问题,因为一些适合辅助治疗的患者仅接受手术可能不会复发。回顾性研究集中于KRAS和TP53变异,其相关的预后价值在不同系列研究中有所不同。在此,研究者提出分析基因突变的预后价值,作为TASTE临床试验的一项辅助研究。这项前瞻性随机II期试验纳入了150例完全切除的非鳞状细胞II期或IIIA(非N2)肿瘤患者,这些患者接受了标准辅助治疗或生物标志物指导的治疗。两组之间没有生存差异的报道,患者被合并在辅助研究中。利用NGS技术对可获得的144例肿瘤样本和35例术后血浆样本进行基因突变分析。研究者在可获得组织样本的TASTE前瞻性试验纳入患者中,通过评估无病生存期和总生存期,分析了突变的预后价值。
研究结果
患者:
IFCT-0801 TASTE(早期NSCLC的个体化术后治疗)临床试验(NCT00775385)是一项多中心、开放标签、随机II期试验,纳入了150例未接受过化疗的II期或IIIA期(非N2)手术切除的非鳞状NSCLC患者。参与该试验的144例患者均具有可用的肿瘤DNA,其中9份DNA样本不符合质量控制标准,1例患者撤回同意。表1总结了134例有分子数据的患者的人口统计学和临床特征,这些特征与整体人群(n=150)无差异。
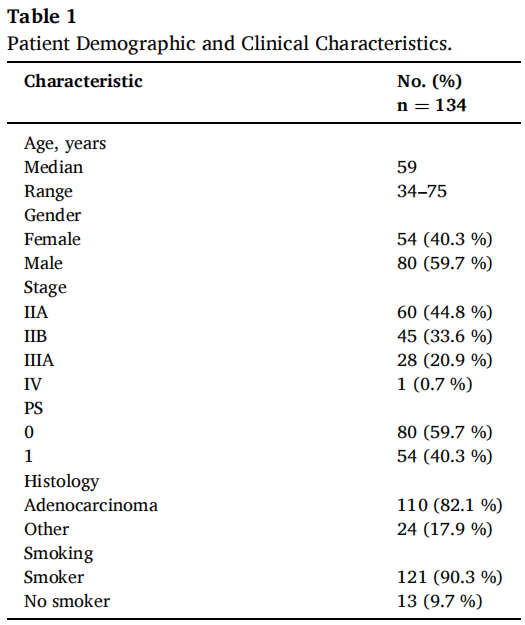
表1
TASTE队列中基于NGS检出的突变:
分析的134份肿瘤样本的突变谱与之前发表的数据一致。主要致癌驱动基因为:RAS(n=53;39.5%)(p.(Gly12Cys) n=25;p.(Gly12Asp) n=11;p.(Gly12Val) n=9;p.(Gly12Ala) n=2;p.(Gly12Phe) n=2;p.(Gly12Ser) n=1;外显子3突变n=3);EGFR(n=13;9.7%)(p.(Leu858Arg) n=7;DEL19 p.(Glu746_Ala750del) n=2);BRAF(n=3;2.2%)(p.(Val600Glu) n=1)和ERBB2(n=2;1.5%)。其他频繁变异见于TP53(n=67;50%)、STK11 (n=18; 13.4%)、CDKN2A (n=6; 4.5 %)、ATM (n=5; 3.7%)、PIK3CA (n=5; 3.7%)、CTNNB1 (n=3; 2.2 %)、APC (n=3; 2.2%)、PTEN (n=2; 1.5%)。突变谱总结于图1。
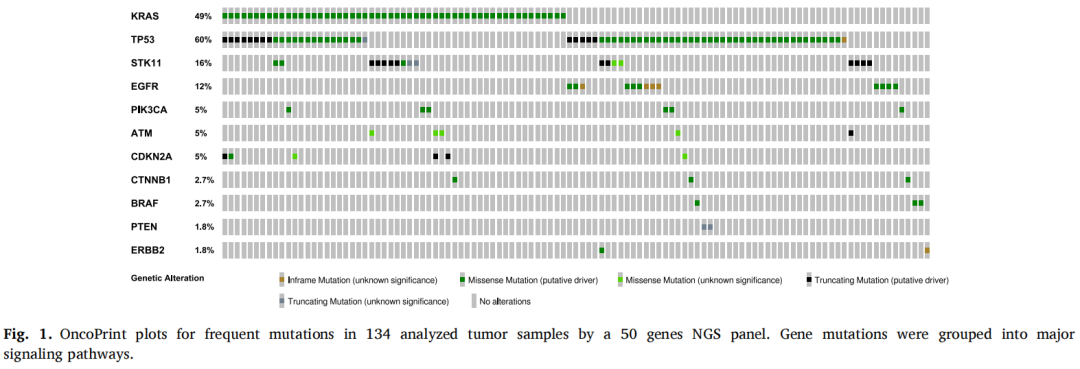
图1
主要驱动因素的突变和临床病理参数:
表2显示了临床病理参数(年龄、性别、分期、PS、腺癌(ADC) vs其他、以及吸烟)和EGFR、KRAS、STK11、TP53突变之间的关系。简而言之,正如预期,EGFR与性别和吸烟相关(在EGFR突变肿瘤中,女性和非吸烟者较多),TP53与组织学相关(在TP53突变肿瘤中,ADC较多),KRAS和TP53与吸烟(在突变肿瘤患者中,吸烟者较多)。细胞周期基因或WNT-CTNNB1通路的突变与任何临床病理参数无关。携带STK11或KRAS突变或这两种基因共突变的患者除一人外均为吸烟者。

表2
基于IHC检测PD-L1:
PD-L1染色为[0-10]、[10-50]和≥50%的肿瘤分别有102、29和16例。PD-L1与临床病理数据无相关性。包括与KRAS共突变在内的所有STK11突变肿瘤均为PD-L1<50%。PD-L1≥50%的肿瘤主要见于女性和KRAS突变/STK11野生型肿瘤。
突变与生存:
KRAS突变与较差的DFS和OS相关(表3A和3B)。KRAS野生型患者的中位DFS(95%CI)未达到(71.2-NR),而KRAS突变肿瘤患者的中位DFS为39.7个月(15.4-NR),KRAS野生型患者的中位OS为NR,而KRAS突变肿瘤患者的中位OS为60.6个月(52.3-NR)(图2A和2B)。在调整了烟草状况后,KRAS的预后价值仍然是正确的,突变肿瘤患者有更高的复发风险(DFS HR 1.95,95%CI [1.1-3.4];p=0.02)和死亡(OS HR 2.30,95%CI [1.2-4.6];P=0.01)。与非STK11突变患者相比,STK11突变患者有DFS较低的趋势,但对OS无影响,生存曲线如图2C和D所示。

表3A

表3B

图2
KRAS和STK11突变患者的DFS(HR 4.39,95%CI [1.9-9.9];p=0.0004)和OS(HR 2.52,95%CI [1.0-6.4];p=0.049)较差,并且与仅KRAS或STK11突变相比,DFS更短(图3A)。与KRAS突变或STK11/KRAS突变肿瘤相比,野生型或STK11突变肿瘤患者也可能表现出延长的OS(图3B)。在评估KRAS突变组中共突变的影响时,研究者发现KRAS-STK11突变肿瘤患者的复发和死亡风险高于KRAS-TP53,DFS(HR:7.54;[1.6–36.1] p=0.01)和OS(HR:9.57,[1.2–73.5] p=0.03)表明STK11突变的主要有害影响。结果见表3A(DFS)和表3B(OS)。从整体来看,EGFR或TP53突变与生存无关。根据TP53突变假定的功能获得或其在DNA结合域的位置进行亚分类并没有改变结果。
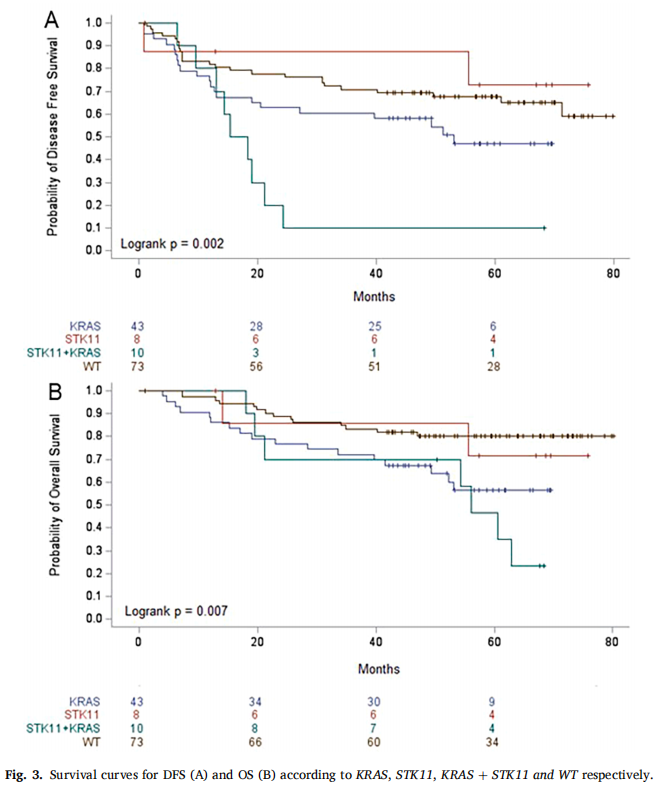
图3
与PD-L1表达<10%的患者相比,PD-L1高表达(≥50%)的患者有更好的DFS(HR:0.47;[0.2-1.1] p=0.07)和OS(HR:0.39;[0.1-1.1] p=0.08)趋势,但总体而言,OS或DFS与PD-L1表达无关(p=0.09,数据未显示)。
ctDNA:
在分析ctDNA的35份术后血浆样本中,5份样本的DNA浓度低于检测阈值(10 ng/mL),19份<60 ng/mL,范围[8-52]和10份>60 ng/mL,范围[60-2520]。白细胞溶解可以解释7份样本中发现的高DNA浓度(>100 ng/mL)。仅发现2个突变:一个是p.Gly12Asp KRAS突变,等位基因比例为1.9%,与肿瘤中发现的突变相同,该患者的DFS为2.5个月,OS为4.1个月,提示手术时存在微小转移灶;另一个是在肿瘤中未发现的p.Gly464Val BRAF突变(肿瘤KRAS p.Gly12Asp、TP53 p.Arg342Glufs*2),该突变可能与肿瘤亚克隆或克隆性造血有关,随访39.7个月,该患者未复发,提示ctDNA p.Gly464Val BRAF突变与肺部疾病无关。
讨 论
手术切除是治疗局部肺癌患者的主要治疗方法。然而,尽管在推荐的辅助治疗下,仍有30%-60%的患者复发。复发是诊断时未发现的隐匿性转移的结果。
在本研究中,研究者探讨了这一问题,以确定在接受手术和辅助治疗的局部肺癌患者中,与较高复发风险和较短生存期相关的分子变异。研究者使用临床常用的NGS技术对参与2期IFCT TASTE试验的患者样本进行了集中审核和基因分型。研究者发现,与野生型患者相比,KRAS突变与较差的预后相关,DFS(HR:1.95,95%CI:1.1-3.4,p=0.02)和OS(HR:2.32,95%CI:1.2-4.6,p=0.014)较短,并且KRAS/STK11而非TP53共突变恶化了预后,并伴有较高的复发风险(DFS HR:4.5,95%CI:2-10.3,p<0.001)和较短的生存期(HR:3.3,95%CI:1.3-8.7,p=0.01)。无论疾病处于哪个阶段,KRAS是NSCLC中最常见的致癌驱动基因。不同的研究评估了其作为预后标志物的应用,但结果仍有争议,一些研究显示其对生存有负面影响,而另一些研究则没有发现。在本研究中,研究者发现TP53或STK11共突变背景明显不同,KRAS的预后价值需要与其他变异一起分析。
在接受化疗或免疫检查点抑制剂(ICI)治疗的KRAS突变腺癌晚期患者中,STK11共突变与不良预后相关。这些研究在STK11作为预测或预后标志物的价值方面仍有争议,并且质疑患者是否应该被排除在基于ICI的治疗之外。临床前和临床数据表明,STK11/LKB1的失活与惰性肿瘤免疫微环境相关。在本研究中,与仅KRAS或STK11突变相反,STK11+/KRAS +突变型肿瘤的PD-L1均较低(<10%),这与STK11+/KRAS +突变型肿瘤对ICIs反应差的假设相符。研究者无法解决这一问题,因为患者未接受免疫治疗。STK11的预后影响也被证明取决于STK11突变的位置。在本研究中,几乎所有STK11外显子1或2突变都是在没有KRAS突变的肿瘤中发现的。5 年时的中位PFS和OS均未达到,范围分别为[6.5-NR]和[55.6-NR],而与KRAS突变相关的非外显子1和2突变则为18.3[9.6–24.3]和56.1[18.1-NR],这符合co-STK11/KRAS突变对预后的重要价值。
关于TP53突变在肺癌中的预后价值有很多数据,通常需要对突变类型进行亚分类以确定显著的临床价值(即DNA结合域位置、功能环位置、破坏性或非破坏性)。本研究没有发现TP53对DFS和OS有任何影响。这些结果与在1209例患者中进行的一项试验一致,在该试验中,TP53突变对早期NSCLC无预后价值,对辅助化疗仅有微小预测作用。正如Sherperd等人报道的那样,在KRAS突变人群中,TP53变异对预后没有影响。相反,一项包括大多数IA期腺癌的瑞典外科NSCLC回顾性队列研究表明,TP53和STK11对预后有影响,而KRAS和EGFR无影响。然而,在对辅助治疗进行调整后,TP53值未得到证实,并且与本研究结果一致,KRAS/STK11突变的肿瘤与较差的预后相关。总之,基因共突变的复杂预后和预测作用可能解释了不同研究之间的差异,并提示结论应与组织学、分期和治疗方面的同质患者相关。
评估预后的一种具有挑战性的方法是识别肿瘤循环DNA。由于预期的肿瘤DNA量非常低,术后血液样本需要特定的方法。加强手术治愈的癌症患者的ctDNA检测是强制性的,这意味着从大量血浆中提取DNA,并且实施的方法不仅关注少数基因,而且关注全面的基因panels或全基因组研究,以增加选择肿瘤DNA分子的机会。在本研究中,只有1 ml可用于cfDNA分析,这显然不足以达到检测隐匿性微转移所需的灵敏度。研究者识别出2例血浆DNA阳性的患者(预计约为10%),其中只有1例与肿瘤突变匹配。虽然ctDNA检测阳性患者的结局较差,但由于研究设计,无法将其作为复发的预后标志物进行适当评估。术后ctDNA检测灵敏度低,尚不能用于临床。局部非小细胞肺癌患者ctDNA含量低,需要使用超深度测序或广泛的全基因组筛查策略和大量血浆。
本研究的主要局限性是:(1)对于组织标志物,使用的是缺乏KEAP1或SMARCA4这两个与晚期肿瘤预后相关的常规检测小panel,以及携带STK11或KRAS/STK11突变的患者数量有限。一小组样本,由于其可能缺乏功效,导致对效应的估计不精确,因此具有局限性。然而,这取决于观察到的组间差异的大小。此外,由于本研究是基于临床试验,监测了患者的治疗情况,前瞻性收集了数据,并对数据收集进行了验证,这限制了回顾性系列研究中存在的一些偏倚。关于SMARCA4/BRG1,在罕见的未分化肺肿瘤亚群中(<5%)会出现SMARCA4/BRG1缺陷,这些未分化肺肿瘤具有常见的TP53、STK11、KEAP1和KRAS共突变和不良预后。对于KEAP1,TCGA数据显示超过一半的KEAP1突变与STK11和/或KRAS共发生。考虑到最近发表的数据,KEAP1/BRG1检测可以改进但不能修改本研究的结果。(2)对于游离DNA,可用血浆量低和实验条件不适合在局部患者中检测ctDNA。这项工作没有为ctDNA作为辅助治疗的预后生物标志物带来新的一致信息,它基本上表明,微小残留病灶的检测应基于特定的工作流程、大血浆量的DNA提取和广泛的分子检测。
KRAS突变和KRAS-STK11共突变与早期NSCLC的不良预后相关。这项前瞻性系列研究表明,在局部肺部疾病中,KRAS-STK11共突变应被视为接受辅助化疗患者预后不良的标志。有必要在评估早期癌症患者治疗策略的试验中实施分子检测。新的辅助治疗策略目前正在研究中,尤其是ICI和靶向治疗。为了改善初始治疗后复发风险高的患者的结局,同时不影响无法从特定辅助治疗中获益的患者的生活质量,有必要根据预后和预测性生物标志物细化患者选择。
参考文献:
Baptiste Oudart, Jean et al. “STK11/LKB1 alterations worsen the poor prognosis of KRAS mutated early-stage non-squamous non-small cell lung carcinoma, results based on the phase 2 IFCT TASTE trial.” Lung cancer (Amsterdam, Netherlands), vol. 190 107508. 19 Feb. 2024, doi:10.1016/j.lungcan.2024.107508

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#STK11/LKB1突变# #非鳞状非小细胞肺癌#
12