广西师范大学梁宏/陈振锋研究小组JMC论文:靶向线粒体的铂基Mcl-1抑制剂的发现
2023-08-18 ComputArt计算有乐趣 ComputArt计算有乐趣 发表于上海
Mcl-1蛋白作为Bcl-2抗凋亡蛋白家族的重要成员,在细胞内源性凋亡中起着重要作用。
Mcl-1蛋白作为Bcl-2抗凋亡蛋白家族的重要成员,在细胞内源性凋亡中起着重要作用。Mcl-1定位于细胞线粒体,与多种癌症相关。通常Mcl-1的过表达与耐药密切相关,高水平Mcl-1的肿瘤细胞对化疗耐药性很高。近年来,研究者们对Mcl-1抑制剂的研究已广泛开展,并有极少数已进入临床研究如AZD5991、AMG-176等。但大多Mcl-1抑制剂缺乏强有力的抗肿瘤活性以及成药性质,其中有些还伴随着明显的副作用,难以到达最佳治疗窗口。
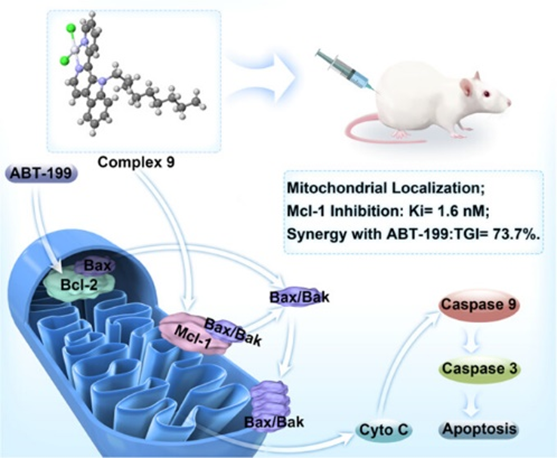
近年来,虽然许多研究者不断优化Mcl-1抑制剂的结构,以提高其对Mcl-1蛋白的亲合力。但大多数Mcl-1抑制剂仍具有较差的线粒体膜透过性,在细胞以及体内实验容易出现脱靶。因此,将Mcl-1抑制剂定位于线粒体是影响脱靶与否的一个关键因素,靶向线粒体是改善Mcl-1抑制剂结合活性的一种新策略。广西师范大学梁宏教授小组与陈振锋教授小组便根据了上述思路,发现了首个靶向线粒体的铂基Mcl-1抑制剂——Complex 9。Complex 9能够集中定位于肿瘤细胞线粒体,呈现出更强的抗肿瘤活性。在多种癌症模型中,Complex 9能够与ABT-199协同杀死ABT-199耐药细胞。
在小鼠模型中,作为单一化合物或与ABT-199联合使用均有效杀伤肿瘤细胞(图1)。上述相关工作已发表在美国化学会出版社的药物化学核心期刊Journal of Medicinal Chemistry上(DOI: 10.1021/acs.jmedchem.3c00355)[1]。
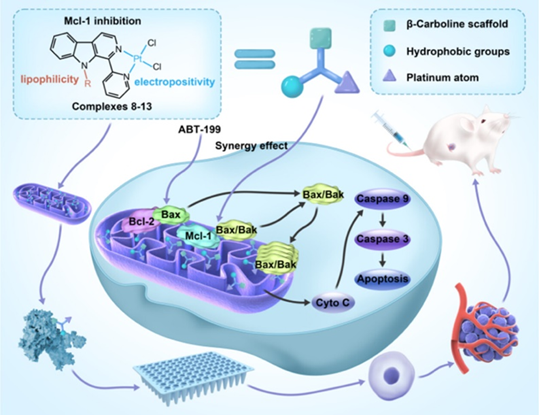
图1: 新型铂基靶向线粒体Mcl-1抑制剂可单独或与ABT-199协同发挥抗肿瘤作用
研究表明,许多吲哚衍生物是潜在的Mcl-1抑制剂,β-Carbolines(β-咔啉)是一类具有多种生物活性的天然或人工合成的吲哚生物碱。β-Carbolines和它们的金属配合物可以靶向酶和蛋白-蛋白相互作用(PPIs)来治疗癌症。在梁宏教授与陈振锋教授小组之前的工作中,他们发现铜(Ⅱ)配合物与疏水集团取代的β-咔啉配体可以作为靶向PPIs的Mcl-1抑制剂。由于金属配合物的亲脂性和在溶液中形成正电荷的能力,使得它们能够在线粒体膜电位的驱动下穿过线粒体膜并在线粒体内积聚,是一类很有前途的靶向线粒体分子。铂(Ⅱ)配合物一直作为靶向DNA抗肿瘤药物开发,但其结构与梁宏/陈振锋教授小组先前报道的铜(Ⅱ)配合物相似,因此研究者们决定尝试设计铂基配合的Mcl-1抑制剂。在设计合成的铂(Ⅱ)配合物中,结构上均为单核结构。
在每个配合物中,铂为中心呈现四协调的方形平面几何形状,并被来自β-咔啉骨架的两个氯原子和两个氮原子所包围(图2)。这些设计的化合物在以DMSO为溶剂时,化合物中的氯离子会与DMSO分子发生交换,这也可能会减少靶向线粒体Mcl-1抑制剂的潜在脱靶效应。
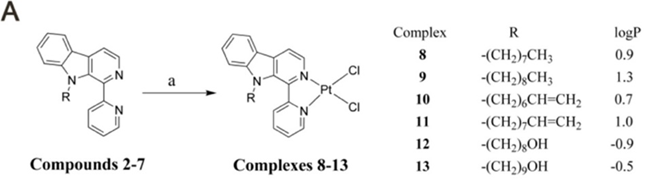
图2: 新型铂基靶向线粒体Mcl-1抑制剂的结构设计
研究者们首先利用电感耦合等离子体质谱(ICP-MS)和共聚焦荧光显微镜研究设计合成化合物的细胞内定位。通过ICP-MS分析在全细胞、细胞质、细胞核以及线粒体中铂的含量,结果发现铂主要积聚在细胞的线粒体中。其中所设计合成化合物中,Complex 9显示出最高的线粒体靶向能力。通过共聚焦荧光显微镜观察也进一步验证了Complex 9的细胞内线粒体定位(图3)。
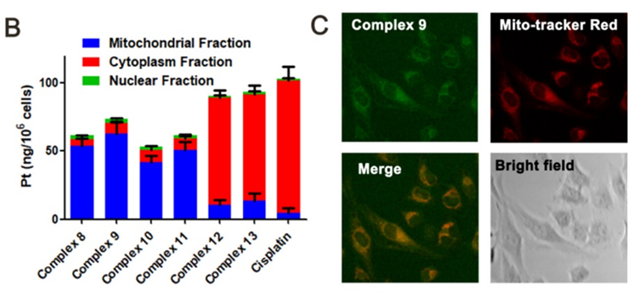
图3:新型铂基靶向线粒体Mcl-1抑制剂的线粒体定位
在确定了所设计的铂基配合物的线粒体定位后,研究者们采用荧光偏振实验测定铂基配合物与Mcl-1的亲合力,发现其亲合力远大于其配体或Pt(DMSO)2Cl2,表现出金属中心的协同作用。其中最有效的Complex 9与Mcl-1蛋白的亲合力比阳性对照A-1210477高3倍。与其他Bcl-2家族抗凋亡蛋白(Bcl-xl、Bcl-2、A1/Bfl-1以及Bcl-w)相比,Complex 9对Mcl-1的选择性至少有600倍。通过表面等离子共振(SPR)的动力学分析表明,Complex 9与Mcl-1紧密结合(Kp=1.9 nM)。通过计算对接分析,研究者们发现Complex 8~13与Mcl-1蛋白结合时有着相似的对接姿态,化合物都采用致密构象结合在Mcl-1的P2口袋中,形成强的疏水作用结合。Complex 9与残基Arg263的侧链形成了阳离子-π相互作用,与残基Phe270的侧链形成了π相互作用,这可能是Complex 9具有最显著活性的原因。
研究者们对设计的铂基配合在Mcl-1依赖性肿瘤细胞系(NCI-H929、MOLP-8、K562、L363)上进行了抗肿瘤活性测试,发现与其配体或Pt(DMSO)2Cl2相比,设计合成的铂基配合物的抗增殖活性显著增强。这表明β-咔啉配体与铂(Ⅱ)形成配合物后协同抑制Mcl-1依赖性肿瘤细胞生长,且比参比药物顺铂和A-1210477更加有效。在此基础上,研究者们后续通过诱导Bax/Bak依赖性肿瘤细胞死亡、线粒体细胞色素c释放以及PARP剪切等实验验证了Complex 9的抗肿瘤活性。此外值得关注的是,Mcl-1蛋白被认为是Bcl-2抑制剂ABT-199(Venetoclax)耐药的一种关键蛋白。因此研究者们在ABT-199耐药细胞中测试了Complex 9与ABT-199的协同作用,实验结果发现上述两者的联合用药能够显著改变剂量-反应曲线(图4),表明了Mcl-1/Bcl-2抑制的协同作用。
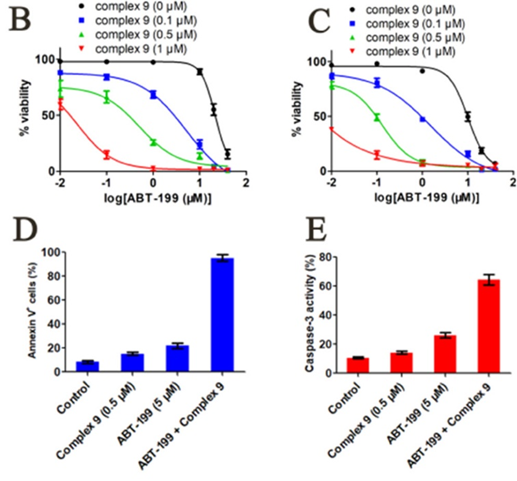
图4:Complex 9与ABT-199协同促进Hela细胞(B、C)和THP-1细胞(D、E)凋亡
该论文的作者通过对铂基靶向线粒体Mcl-1抑制剂的研究,成功发现了能够选择性在肿瘤细胞线粒体中积聚的Mcl-1抑制剂。此项工作展示了开发靶向线粒体的Mcl-1抑制剂是在小鼠模型中实现安全有效抗肿瘤作用的有效策略。这种策略也许可以广泛应用于其他线粒体蛋白,以发现结合效率更高、脱靶作用更小的药物抑制剂。
参考文献:
[1] Lu X, Wu MF, Wu JL, Zhang HQ, Liang H, Chen ZF. Platinum-Based Mcl-1 Inhibitor Targeting Mitochondria Achieves Enhanced Antitumor Activity as a Single Agent or in Combination with ABT-199. J Med Chem. 2023, 66, 13, 8705–8716.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









