【论著】| 胶质瘤中MGMT甲基化状态及其临床意义的回顾性研究
2023-09-15 中国癌症杂志 中国癌症杂志 发表于上海
本研究旨在分析胶质瘤中MGMTmet状态及其与临床病理学特征和其他常见分子异常的相关性,探讨MGMTmet与其他分子异常联合分析对胶质瘤患者预后和TMZ治疗效果判断的价值。
[摘要]
背景与目的:胶质瘤是中枢神经系统常见且预后较差的恶性肿瘤,手术后联合替莫唑胺(temozolomide,TMZ)同步放化疗是胶质瘤的主要治疗方案。O6-甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine DNA methyltranferase,MGMT)基因启动子甲基化(MGMT promoter methylation,MGMTmet)状态可预测胶质瘤患者对TMZ治疗的敏感性,但其与临床病理学特征的关系及如何更好地预测治疗效果及患者预后尚需深入研究。本研究旨在分析胶质瘤中MGMTmet状态及其与临床病理学特征和其他常见分子异常的相关性,探讨MGMTmet与其他分子异常联合分析对胶质瘤患者预后和TMZ治疗效果判断的价值。
方法:回顾性收集复旦大学附属肿瘤医院病理科2019年7月—2022年9月诊断的205例胶质瘤患者的临床病理学资料,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)法检测MGMTmet状态;采用Sanger测序法检测异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)1和IDH2端粒酶反转录酶(telomerase reverse transcriptase,TERT)基因突变情况;采用荧光原位杂交(fluorescence in situ hybridization,FISH)检测1号染色体短臂和19号染色体长臂(the short arm of chromosome 1 and the long arm of chromosome 19,1p19q)缺失情况。
结果:205例患者中,女性患者的MGMTmet发生率高于男性。相比于胶质母细胞瘤(47.3%),星形细胞瘤(74.1%)和少突胶质细胞瘤(100.0%)中MGMT基因启动子更易发生甲基化(P<0.05)。在MGMTmet组中,IDH1突变(mutant,mut)率和1p19q共缺失(co-deletion,co-del)率明显提高,且MGMTmet与IDH1mut和1p19qco-del具有相关性(P<0.05)。MGMTmet、年龄小于55岁、少突胶质细胞瘤及世界卫生组织(World Health Organization,WHO)1~3级的患者均表现出较长的总生存期(overall survival,OS),差异有统计学意义(P<0.05)。相比于单个影响因素,双/三基因联合分析[MGMTmet/IDH1mut、MGMTmet/1p19q co-del或MGMTmet/IDH1mut/1p19q co-del]预测患者预后的效果更好(P<0.05),后两者是独立预后因素。在TMZ治疗患者中,MGMTmet(MGMTmet/TMZ+)患者比其他组预后好,如果患者联合存在IDH1mut,患者预后得到进一步提高(P<0.05)。结论:MGMTmet好发于女性和少突胶质细胞瘤患者中;其与IDH1mut及1p19 qco-del呈正相关。MGMTmet的患者与TMZ治疗效果及预后较好有关,且MGMTmet联合IDH突变和1p19q co-del分析可能具有更好的TMZ治疗效果和预后提示价值。
[关键词]胶质瘤;O6-甲基鸟嘌呤DNA甲基转移酶;双/三基因联合分析;预后;替莫唑胺
胶质瘤是中枢神经系统常见的恶性肿瘤,约占中枢神经系统肿瘤25%,具有发病率和恶性程度高、易复发、预后差等特点[1-4]。目前主要治疗方案是手术加术后联合替莫唑胺(temozolomide,TMZ)同步放化疗,但仍然存 在部分胶质瘤患者治疗效果不佳及预后较差的问题[5-6],如何更好地预测胶质瘤的治疗效果及患者预后是临床诊治中需要特别关注的内容。
O6-甲基鸟嘌呤DNA 甲基转移酶(O6-methylguanine DNA methyltranferase,MGMT)基因启动子甲基化(MGMT promoter methylation,MGMTmet)状态与治疗效果及预 后密切相关[7],MGMT是一种DNA修复酶,能影响TMZ对胶质瘤患者的疗效。当MGMTmet 发生时,不能有效地修复DNA损伤,有助于烷化剂类药物发挥作用,MGMTmet状态可预测胶 质瘤患者对替莫唑胺治疗的敏感性,据此采取个体化治疗可有效延长恶性胶质瘤患者的总生存期(overall survival,OS)[8] 。有研究[9]报道,XIAP相关因子1(XIAP-associated factor 1,XAF1)基因沉默可以使MGMTmet胶质母细胞瘤(glioblastoma,GBM)耐药细胞对TMZ敏感。此外,随着基因检测技术的发展,2016年世界卫生组织(World Health Organization,WHO)首次在胶质瘤组织学分型的基础上增加了分子分型[10],2021年第5版WHO中枢神经系统肿瘤 分类中加入了更多与诊断及预后等相关的分子标志物,旨在增加诊断的客观性和精确性,为患者预后分析提供更多依据[11]。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因的突变状态可以进一步明确成人弥漫性胶质瘤诊断方向[11],IDH突变(mutant,mut)胶质瘤 患者的OS比野生型(wild type,wt)患者显著延长[12];端粒酶反转录酶(telomerase reverse transcriptase,TERT)基因有突变则可以将先前 被归为IDHwt星形细胞瘤患者诊断为IDHwt胶质母细胞瘤,提示可能预后不良;1p19q共缺失(co-deletion,co-del)则为少突胶质细胞瘤的诊断提供依据,1p19q co-del与患者化疗后无复发生存期显著相关[13]。
因此,本研究检测MGMTmet状态,分析其与临床病理学特征及其他预后相关分子IDH1/2、TERT、1p19q co-del的关系,并探讨MGMT联合其他分子分析对胶质瘤患者生存预后的影响和TMZ治疗效果判断的临床应用价值。
1 资料和方法
1.1 一般资料
收集复旦大学附属肿瘤医院病理科2019年7 月—2022年9月诊断为胶质瘤且进行过MGMTmet检测的263例患者的临床病理学资料,排除没有完整随访信息、儿童胶质瘤患者等样本,最后共纳入205例,其中49例为会诊病例,156例为本院常规手术病例。采用患者来院复查及电话随访结合进行病例随访,随访截至2022年11月,随访内容包括性别、年龄、是否TMZ治疗和既往史(第一原发肿瘤名称和时间、第1次转移部位和时间、既往病史名称等)。
1.2 DNA提取
切3~4 μm石蜡包埋组织切片5 ~ 10张,然后脱蜡和水化,其中一张H-E染色用于观察肿瘤富集区域,将剩余白片对应区域刮入Eppendorf试管中,并加入裂解液、蛋白酶K和RNA酶,使用凯杰企业管理(上海)有限公司的QIAsymphony DNA迷你试剂盒通过全自动提取仪提取DNA,具体操作步骤按试剂盒说明书进行。并使用NanoDrop 2000超微量分光光度计对提取的DNA进行质检(10 ng/μL≤浓度≤100 ng/μL,1.6≤D260 nm/D280 nm≤2.1)。
1.3 MGMTmet检测
按照基因科技(上海)股份有限公司的人MGMTmet检测试剂盒说明书,将提取的DNA样本进行重亚硫酸盐转化及产物纯化。按照用量配制实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction ,RTFQ-PCR)反应液,混合液-1(MGMT扩增反应液和Taq DNA聚合酶)和混合液-2(外控扩增反应液和Taq DNA聚合酶)各一管,分装:在PCR反应管中分装配制好的混合液,每个样本分装混合液-1和混合液-2各一管,每个反应管中分装27 μL。加样:在相应的反应管中分别添加3 μL重亚硫酸盐转化产物(包括待测样本、阴性对照、阳性对照和空白对照),PCR反应总体积为30 μL。扩增:将PCR反应管放入RTFQ-PCR仪中,运行如下扩增程序:第一阶段:95 ℃温浴3 min;第二阶段:95 ℃温浴15 s,60 ℃温浴60 s,45个循环;信号收集:第二阶段60 ℃时收集荧光信号。MGMT扩增反应管中收集FAM和JOE/VIC荧光信号。外控扩增反应管中收集FAM荧光信号。判读标准:ΔCt=Ct甲基化-Ct外控,当ΔCt值≤7时,样本中MGMTmet含量 ≥1%,报告MGMTmet阳性。当样本MGMT反应管中无FAM信号抬升,且内控和外控扩增Ct≤32时,报告为MGMTmet阴性。当ΔCt值>7 时,样本中MGMTmet含量<1%,报告低于试剂盒检测下限。
1.4 Sanger测序
提取的DNA采用PCR方法,扩增IDH1第4外显子、IDH2第4外显子和TERT核心启动子区片段(包含C288T、C250T和T349C位点),PCR反应体系为25 μL,反应条件如下:94 ℃预变性 10 min,94 ℃变性45 s,59 ℃退火45 s。72 ℃延伸45 s,共40个循环,72 ℃延伸7 min,以4 ℃结束,其中已知阳性病例作为阳性对照,双蒸水作为阴性对照。取5 μL产物进行琼脂糖凝胶电泳,PCR产物纯化,使用美国ABI公司的3500XL Dx基因分析仪进行测序。
1.5 荧光原位杂交(fluorescence in situ hybridization,FISH)
3~4 μ m石蜡标本经脱蜡和水化后,于88~92 ℃纯水中预处理30 min,然后胃蛋白酶消化15~20 min,然后使用1p36和19q13探针试剂盒(美国Abbott Vysis公司)进行双色探针杂交,首先78 ℃变性5 min,42 ℃温育12~18 h,经杂交后洗涤、干燥,加10 μL 4’,6-二脒基-2-苯基吲哚,于室温放置15 min,荧光显微镜下观察结果。结果判读:计数最少50个合格细胞,即细胞边界清晰、细胞核完整且无堆叠以及DAPI染色均一,然后观察细胞内红绿信号情况,分别计算红绿信号比值,当总的红色信号数除以绿色信号数结果小于0.7,则判断为阳性。
1.6 统计学处理
MGMTmet与临床病理学特征的关系采用χ2检验;通过Kaplan-Meier生存曲线分析患者的OS,并采用log-rank检验分析临床病理学特征、MGMTmet及联合其他分子指标与OS的关系;多因素预后分析采用COX回归模型。OS指患者从进入研究到最后死亡的时间,OS越长说明该组患者获益越多。采用SPSS 26.0软件和Graph Pad Prism 5进行数据处理及统计学分析。P<0.05为差异有统计学意义。
2 结 果
2.1 患者基本信息
205例患者中,男性125例,女性80例,年龄17~77岁,中位年龄50.2岁。肿瘤多发于额叶(69例)和颞枕叶(47),少部分位于小脑脑干(6例),其他部位83例。根据2021年第5版WHO中枢神经系统肿瘤分类标准,1级和2级有49例,3级36例,4级120例。其中160例患者使用过TMZ治疗,45例未使用TMZ治疗。
2.2 MGMTmet与患者临床病理学特征的关系
使用RTFQ-PCR法检测205例患者的MGMTmet情况,其中男性患者阳性率为56.0%,女性患者阳性率为70.0%,女性患者的MGMTmet发生率显著高于男性(P<0.05);且相比于胶质母细胞瘤(47.3%)。
在星形细胞瘤(74.1%)和少突胶质细胞瘤(100.0%)中,MGMT基因的启动子更易发生甲基化(P<0.05);另外WHO 1~2级和3级的患者也表现出明显的MGMTmet发生率;而MGMTmet与患者年龄及肿瘤部位差异无统计学意义(P>0.05,表1)。

2.3 MGMTmet与其他分子指标的相关性
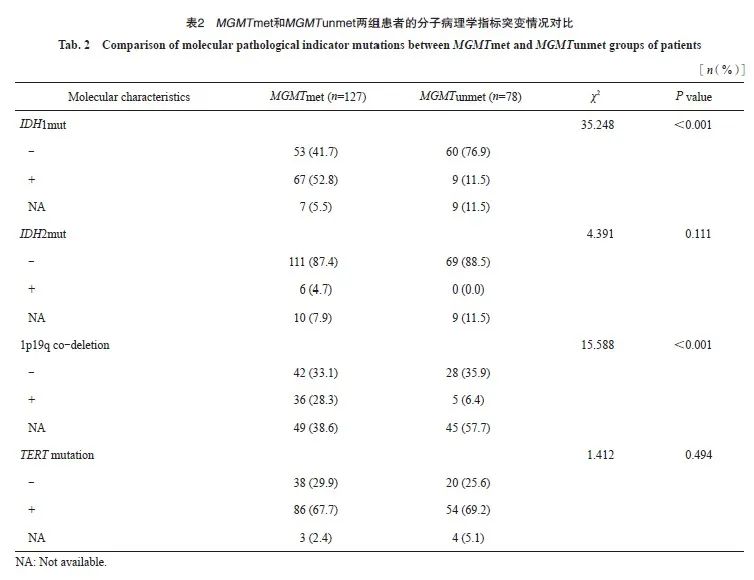
将205例患者分为甲基化组(MGMTmet组)127例和非甲基化组(MGMTunmet组)78例。在MGMTmet组中,IDH1mut发生率为52.8%(67例),1p19q co-del发生率为28.3%(36例)。MGMTunmet组的IDH1mut发生率和1p19q co-del发生率分别为11.5%和6.4%。两组患者的IDH1mut发生率和1p19q co-del发生率差异有统计学意义(P <0.05),而IDH2和TERT突变率差异无统计学意义(P >0.05,表2)。
此外,MGMTmet与IDH1mut和1p19q co-del具有相关性(P<0.05),列联系数分别为0.4和0.3。
2.4 MGMTmet及联合其他分子指标与预后的关系
对205例患者进行随访,中位随访时间为12.0个月,Kaplan-Meier生存分析显示,相比于MGMTunmet患者的OS[(13.71±13.67)个月],MGMTmet患者的OS[(16.37±18.66)个月]更长,且log-rank时序检验显示差异有统计学意义(P=0.002,表3,图1)。此外年龄<55岁患者的OS(18.10±20.07)长于年龄≥55岁的患者(11.48±10.04,P<0.05,表3,图1)。不同肿瘤组织类型中,胶质母细胞瘤患者预后最差(OS为11.74±10.90),相比而言少突胶质细胞瘤和星形细胞瘤患者的OS得到延长(P<0.05,表3,图1);WHO 1~2和3级患者也显示出较长的生存期(P<0.05,表3,图1)。另外,IDH1mut或1p19q co-del患者OS也得到明显延长(18.64±18.72 vs 13.54±15.80,20.54±23.91 vs 15.83±17.05,P<0.05,表3,图1)。而患者的性别、肿瘤部位、IDH2和TERT突变与患者OS无明显相关性(P>0.05,表3)。
由以上结果可知MGMTmet与IDH1mut和1p19q co-del具有相关性,且IDH1mut和1p19q co-del与患者预后相关。相比于MGMTmet/IDH1wt、MGMTunmet/IDH1mut和MGMTunmet/IDH1wt组,MGMTmet/IDH1mut组患者的预后最好(P <0.05,表3,图1G);且MGMTmet/1p19q co-del患者的预后比MGMTunmet/1p19q non co-del组好(P<0.05,表3,图1H)。然而,MGMTmet/IDH1mut/1p19q co-del组与1 or 2 positive组的OS差异无统计学意义(P>0.05),但与MGMTunmet/IDH1wt/1p19q non co-del组OS差异有统计学意义(P<0.05,图1I)。
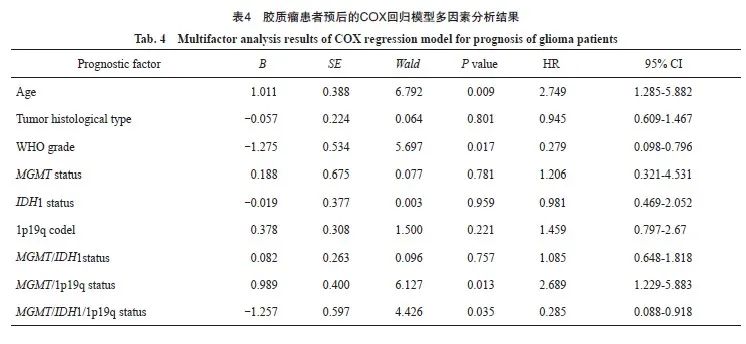
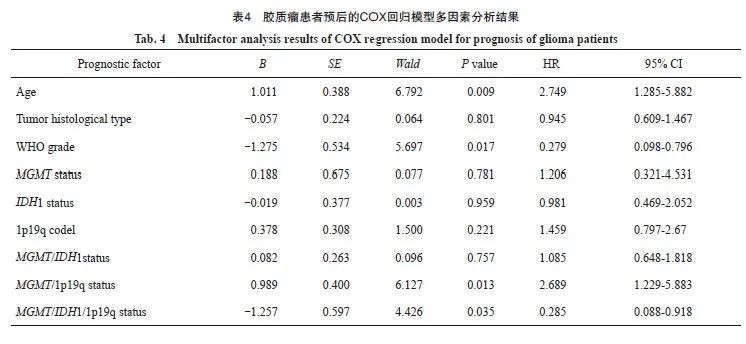
多因素COX回归模型分析显示,年龄(P=0.009)、WHO分级(P=0.017)、MGMT/1p19q(P=0.013)及MGMT/IDH1/1p19q(P=0.035)状态是胶质瘤患者预后的独立影响因素(表 4)。


图 1 不同临床病理学特征及基因状态下Kaplan-Meier生存曲线分析
Fig. 1 Kaplan Meier survival curve analysis under different clinical pathological characteristics and gene states
A: The OS of MGMTmet positive patients was longer than that of negative patients; B, C, D: Glioma patients younger than 55 years old, oligodendroglioma, WHO 1+2 and WHO 3 patients all showed longer OS; E, F: The OS of patients with IDH1mut and 1p19q co-del was also significantly prolonged; G, H: Compared with single factor, patients with MGMTmet/IDH1mut and MGMTmet/1p19q co-del have better prognosis; I: Three gene combinations (MGMT/IDH1/1p19q) analysis of overall survival in patients. NA: Not available.
2.5 MGMTmet及联合其他分子指标对TMZ疗效的影响
为进一步分析MGMTmet状态与TMZ疗效的关系,随访了205例胶质瘤患者的TMZ用药情况,其中有160例患者使用TMZ治疗,45例未使用该药物。Kaplan-Meier生存分析显示,在TMZ治疗的胶质瘤患者中,MGMTmet患者比MGMTunmet患者有更长的OS(P<0.05,图2);进一步,TMZ治疗且MGMTmet患者的OS比未使用TMZ治疗MGMTmet阳性患者明显延长(P<0.05,图2)。但MGMTmet阴性患者,无论是否使用TMZ治疗,OS差异无统计学意义(图2)。TMZ治疗且伴随MGMTmet、IDH1mut阳性(MGMTmet/IDH1mut/TMZ+)患者比MGMTmet 、IDH1wt(MGMTmet/IDH1wt/TMZ+)患者治疗效果更佳,预后更好(P<0.05,图2)。但是TMZ治疗且伴随MGMTmet 1p19q co-del(MGMTmet/1p19q co-del/TMZ+)患者与无1p19q co-del患者相比预后差异无统计学意义(P>0.05,图2)。
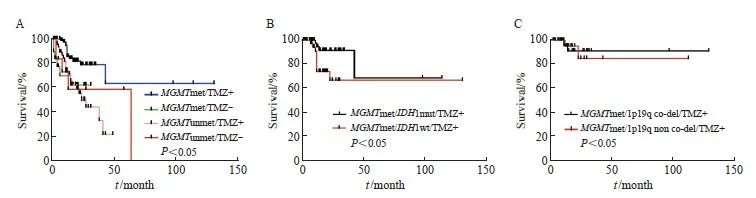
图2 不同基因异常及TMZ治疗状态下Kaplan-Meier生存曲线分析
Fig. 2 Kaplan Meier survival curve analysis under different genetic abnormalities and TMZ treatment status
A: Among glioma patients treated with TMZ, patients with MGMTmet had longer OS than those with negative MGMTunmet/TMZ+; B: The OS of patients with TMZ treatment and MGMTmet/IDH1mut positive (MGMTmet/IDH1mut/TMZ+) was longer than that of negative (MGMTmet/IDH1wt/TMZ+) patients; C: Among the patients treated with TMZ and accompanied with MGMTmet, there was no statistical difference between the OS of 1p19q co-deletion positive (MGMTmet/1p19q co-del/TMZ+) patients and negative patients.
3 讨 论
脑胶质瘤是中枢神经系统常见的恶性肿瘤,即使经过手术和放化疗后患者的中位生存期也仅为15个月[14-15],WHO中枢神经系统肿瘤分类中加入了许多与患者诊断及预后密切相关的分子标志物[11,16],MGMT作为其中一个重要的基因,与胶质瘤患者预后相关,因此分析MGMT与病理学特征的关系具有一定临床意义,虽有不少文献报道MGMT预测生存率的作用[17],但在不同人群中,MGMTmet与临床病理学特征的关系以及对患者预后的影响不尽相同[18]。本研究回顾性分析了205例胶质瘤患者的临床病理学特征,结果显示,女性患者MGMTmet发生率高于男性(70.0% vs 56.0%),相比于胶质母细胞瘤(47.3%),星形细胞瘤(74.1%)和少突胶质细胞瘤(100.0%)中MGMT基因启动子更易发生甲基化。单因素生存分析显示,MGMTmet阳性、年龄小于55岁、少突胶质细胞瘤及WHO 1~3级的患者均表现出较长的OS(P<0.05),而性别反而与预后差异无统计学意义。本研究结果进一步验证了MGMTmet与临床病理学特征的关系[19],其他文献报道,在Ⅱ和Ⅲ级少突胶质细胞瘤中,MGMTmet的频率较高(分别为47.0%~92.9%和70.0%~94.4%)[19-20] ,但由于病例数略少,本研究中少突胶质细胞瘤患者的MGMTmet阳性率偏高。
随着基因检测技术的发展,其他分子特征在胶质瘤的诊断、治疗和预后预测中也发挥着越来越重要的作用[21]。IDHmut状态可以进一步明确成人弥漫性胶质瘤诊断方向,IDH1mut在Ⅰ/Ⅱ级胶质瘤中比Ⅲ/Ⅳ级胶质瘤更常见[12, 22]1p19q co-del是一种诊断生物标志物,也是少突胶质细胞瘤病理学诊断的必要条件,它代表了IDHmut胶质瘤(少突胶质细胞瘤与星形细胞瘤)的一个关键分支点。有研究[23-24]显示,在间变性少突胶质瘤中IDH1mut与1p19q co-del和MGMTmet存在相关性,但具体情况未见报道。本研究发现在MGMTmet组中IDH1mut发生率为52.8%(67例),1p19q co-del发生率为28.3%(36例),明显高于MGMTunmet组,而IDH2和TERT突变率差异无统计学意义。MGMTmet与IDH1mut和1p19q co-del的列联系数分别为0.4和0.3,表明MGMTmet与IDH1mut及1p19q co-del呈正相关。Kaplan-Meier生存分析显示,相比于MGMTunmet患者的OS[(13.71±13.67)个月],MGMTmet患者的OS[(16.37±18.66)个月]更长,IDH1mut或1p19q co-del的患者OS也得到明显延长(P<0.05)。有报道低级别胶质瘤中,当患者存在IDH1wt、MGMT低甲基化和非1p19q co-del时,预后更差[25]。且IDH1mut与MGMTmet结合对胶质瘤患者预后的预测优于单独MGMTmet或IDH1mut[26]。在具有IDHmut和1p19q co-del的低级别胶质瘤中观察到更好的预后[27]。提示两种分子病理学指标进行联合检测,较单独检测更有助于临床工作中的诊断分级和预后预测。MGMT联合1p19q co-del对预后影响,以及三基因联合(MGMT/IDH1/1p19q)对胶质瘤预后的预测报道较少。本研究发现,相比于MGMTmet/IDH1wt、MGMTunmet/IDH1mut和MGMTunmet/IDH1wt组,MGMTmet/IDH1mut患者的预后最好,且MGMTmet/1p19q co-del患者的预后比MGMTunmet/1p19q non co-del组好,结果显示,双基因联合分析显示出更好的预后预测效果。此外,MGMTmet/IDH1mut/1p19q co-del组与MGMT unmet/IDH1wt/1p19q non co-del组OS差异有统计学意义。多因素COX回归模型分析显示,MGMT/1p19q和MGMT/IDH1/1p19q状态是胶质瘤预后的独立影响因素,但三基因联合分析没有显示出更好的预后预测效果,尚需扩大病例、延长患者随访做予以验证。
替莫唑胺作为胶质瘤患者常用的化疗药物[28],但是MGMTmet状态本身并不是TMZ治疗反应的唯一预测因素。Hegi等[29]观察到,即使在接受放疗和TMZ治疗的非甲基化患者中,无进展生存期(progression-free survival,PFS)也显著改善,而OS的增加也接近显著水平。其他分子变化也可能与MGMTmet有关,并影响TMZ疗效[17]。例如,与IDH1wt GBM患者相比,IDH1mut患者对TMZ化疗更敏感,IDH1mut GBM患者的中位OS和中位PFS分别延长了20和7个月[30]。虽然EORTC 26951试验中IDHmut和1p19q缺失的患者中位OS比1p19q未缺失患者延长6年,1p19q缺失的患者能从辅助PCV治疗中获益[31],但是MGMTmet联合IDH1和1p19q异常能否从TMZ治疗中获益并不清楚。本研究分析发现TMZ治疗且伴随MGMTmet、IDH1mut阳性(MGMTmet/IDH1mut/TMZ+)患者比MGMTmet、IDH1wt型(MGMTmet/IDH1wt/TMZ-)患者治疗效果更佳,预后更好(P<0.05)。而TMZ治疗且伴随MGMTmet、1p19q co-del状态与否患者的预后差异无统计学意义,但从Kaplan-Meier生存曲线图上观察两者生存情况有一定差异,值得增加样本量进一步分析。
综上所述,MGMTmet好发于女性和少突胶质细胞瘤患者中;其与IDH1mut和1p19q co-del呈正相关;MGMTmet的患者与TMZ治疗效果及预后较好有关,且联合IDHmut、1p19q co-del具有更好的TMZ治疗效果和预后提示价值,本研究结果可为个体化治疗方案的决策提供新的思路。本研究仍然存在一些不足,样本量略少,研究结果的普遍性需要扩大样本量进一步验证,另外患者的随访需要进一步追踪延长,以进一步明确其临床应用价值,关于MGMTmet/IDH1mut/1p19q co-del在胶质瘤中的相互作用机制也有待进一步研究。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] PRATHER K Y, O'NEAL C M, WESTRUP A M, et al. A systematic review of amino acid PET in assessing treatment response to temozolomide in glioma[J]. Neurooncol Adv, 2022, 4(1): vdac008.
[2] MILLER K D, OSTROM Q T, KRUCHKO C, et al. Brain and other central nervous system tumor statistics, 2021[J]. CA Cancer J Clin, 2021, 71(5): 381-406.
[3] O S T R O M Q T , G I T T L E M A N H , S T E T S O N L , e t a l . Epidemiology of gliomas[J]. Cancer Treat Res, 2015, 163: 1-14.
[4] YANG P, WANG Y Z, PENG X X, et al. Management and survival rates in patients with glioma in China (2004-2010): a retrospective study from a single-institution[J]. J Neurooncol, 2013, 113(2): 259-266.
[5] STUPP R, HEGI M E, MASON W P, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTCNCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-466.
[6] TOUAT M, IDBAIH A, SANSON M, et al. Glioblastoma targeted therapy: updated approaches from recent biological insights[J]. Ann Oncol, 2017, 28(7): 1457-1472.
[7] BINABAJ M M, BAHRAMI A, SHAHIDSALES S, et al. The prognostic value of MGMT promoter methylation in glioblastoma: a meta-analysis of clinical trials[J]. J Cell Physiol, 2018, 233(1): 378-386.
[8] SAREEN H, MA Y F, BECKER T M, et al. Molecular biomarkers in glioblastoma: a systematic review and metaanalysis[J]. Int J Mol Sci, 2022, 23(16): 8835.
[9] WU Q, BERGLUND A E, WANG D P, et al. Paradoxical epigenetic regulation of XAF1 mediates plasticity towards adaptive resistance evolution in MGMT-methylated glioblastoma[J]. Sci Rep, 2019, 9(1): 14072.
[10] LOUIS D N, PERRY A, REIFENBERGER G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820.
[11] LOUIS D N, PERRY A, WESSELING P, et al. The 2021 WHO classification of tumors of the central nervous system: a summary[J]. Neuro Oncol, 2021, 23(8): 1231-1251.
[12] KRISTENSEN B W, PRIESTERBACH-ACKLEY L P, PETERSEN J K, et al. Molecular pathology of tumors of the central nervous system[J]. Ann Oncol, 2019, 30(8): 1265-1278.
[13] ŚLEDZIŃSKA P, BEBYN M, SZCZERBA E, et al. Glioma 2021 WHO classification: the superiority of NGS over IHC in routine diagnostics[J]. Mol Diagn Ther, 2022, 26(6): 699-713.
[14] REIFENBERGER G, WIRSCHING H G, KNOBBE-THOMSEN C B, et al. Advances in the molecular genetics of gliomasimplications for classification and therapy[J]. Nat Rev Clin Oncol, 2017, 14(7): 434-452.
[15] WEI Y T, LU C F, ZHOU P, et al. EIF4A3-induced circular RNA ASAP1 promotes tumorigenesis and temozolomide resistance of glioblastoma via NRAS/MEK1/ERK1-2 signaling[J]. Neuro Oncol, 2021, 23(4): 611-624.
[16] WIESTLER B, CAPPER D, SILL M, et al. Integrated DNA methylation and copy-number profiling identify three clinically and biologically relevant groups of anaplastic glioma[J]. Acta Neuropathol, 2014, 128(4): 561-571.
[17] WICK W, WELLER M, VAN DEN BENT M, et al.MGMT testing: the challenges for biomarker-based glioma treatment[J]. Nat Rev Neurol, 2014, 10(7): 372-385.
[18] PATEL N P, LYON K A, HUANG J H. The effect of race on the prognosis of the glioblastoma patient: a brief review[J]. Neurol Res, 2019, 41(11): 967-971.
[19] MELLAI M, MONZEGLIO O, PIAZZI A, et al. MGMT promoter hypermethylation and its associations with genetic alterations in a series of 350 brain tumors[J]. J Neurooncol, 2012, 107(3): 617-631.
[20] KANG S H, PARK K J, KIM C Y, et al. O6-methylguanine DNA methyltransferase status determined by promoter methylation and immunohistochemistry in gliosarcoma and their clinical implications[J]. J Neurooncol, 2011, 101(3): 477-486.
[21] TAN A C, ASHLEY D M, LÓPEZ G Y, et al. Management of glioblastoma: state of the art and future directions[J]. CA Cancer J Clin, 2020, 70(4): 299-312.
[22] LOPCI E, RIVA M, OLIVARI L, et al. Prognostic value of molecular and imaging biomarkers in patients with supratentorial glioma[J]. Eur J Nucl Med Mol Imaging, 2017, 44(7): 1155-1164.
[23] VAN DEN BENT M J, DUBBINK H J, MARIE Y, et al. IDH1 and IDH2 mutations are prognostic but not predictive for outcome in anaplastic oligodendroglial tumors: a report of the European organization for research and treatment of cancer brain tumor group[J]. Clin Cancer Res, 2010, 16(5): 1597-1604.
[24] LABUSSIERE M, IDBAIH A, WANG X W, et al. All the 1p19q codeleted gliomas are mutated on IDH1 or IDH2[J]. Neurology, 2010, 74(23): 1886-1890.
[25] XU S B, WANG Z F, YE J, et al. Identification of iron metabolism-related genes as prognostic indicators for lowergrade glioma[J]. Front Oncol, 2021, 11: 729103.
[26] TANAKA K, SASAYAMA T, MIZUKAWA K, et al. Combined IDH1 mutation and MGMT methylation status on long-term survival of patients with cerebral low-grade glioma[J]. Clin Neurol Neurosurg, 2015, 138: 37-44.
[27] Cancer Genome Atlas Research Network, BRAT D J, VERHAAK R G, et al. Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas[J]. N Engl J Med, 2015, 372(26): 2481-2498.
[28]KUTER D J. Treatment of chemotherapy-induced thrombocytopenia in patients with non-hematologic malignancies[J]. Haematologica, 2022, 107(6): 1243-1263.
[29] HEGI M E, DISERENS A C, GORLIA T, et al.MGMT gene silencing and benefit from temozolomide in glioblastoma[J]. N Engl J Med, 2005, 352(10): 997-1003.
[30] CHEN J, WANG T T, LIU W M, et al. Extended adjuvant temozolomide in newly diagnosed glioblastoma: a single-center retrospective study[J]. Front Oncol, 2022, 12: 1000501.
[31] MOHILE N A, MESSERSMITH H, GATSON N T, et al. Therapy for diffuse astrocytic and oligodendroglial tumors in adults: ASCO-SNO guideline[J]. J Clin Oncol, 2022, 40(4): 403-426.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言