专家解读 | PI3Kβ调控PTEN缺陷型乳腺肿瘤的免疫逃避
2023-11-15 iCombo iCombo 发表于上海
本文报告了PI3Kβ作为PTEN缺失型乳腺癌中免疫逃避的主要介质,同时证明了PI3Kβ抑制使肿瘤细胞对免疫疗法敏感。
导读
PTEN抑癌基因的缺失是所有癌症类型中最常见的致癌驱动因素之一。PTEN是PI3K信号传导的主要负调节因子。PI3Kβ亚型已被证明在PTEN缺陷型肿瘤中起重要作用,但PI3Kβ活化在其中的重要机制仍未阐明。本文使用Pten和Trp 53(编码p53)缺失所驱动的侵袭性乳腺癌的基因修饰小鼠模型,证明了PI3Kβ的遗传失活可诱导稳定的抗肿瘤免疫应答,即抑制免疫活性小鼠的肿瘤生长,但不影响免疫缺陷小鼠的肿瘤生长。在机制上,PTEN缺失背景下的PI3Kβ失活导致STAT3信号传导减少并增加免疫刺激分子的表达,从而促进抗肿瘤免疫应答。PI3Kβ的药理学抑制也可引发抗肿瘤免疫,并与免疫疗法协同抑制肿瘤生长。对PI2Kβ+Anti-PD-1组合治疗具有完全应答的小鼠在二次移植肿瘤时显示免疫记忆和肿瘤排斥效应。本文研究结果证实了PTEN缺失和STAT3活化的关联性分子机制,并表明PI3Kβ调控PTEN缺失肿瘤中的免疫逃逸,为PI3Kβ抑制剂与免疫疗法组合用于治疗PTEN缺陷型乳腺癌提供了理论基础。(Nature. 2023 May;617(7959):139-146. doi: 10.1038/ s41586-023-05940-w)
PTEN缺失在介导免疫逃避中具有重要作用。现有研究报道PTEN的缺失促进各类癌症中的免疫抑制和对免疫疗法的治疗抗性。使用遗传方法和药理学抑制的既往研究已经证明,PTEN缺失型肿瘤的形成通常依赖于PI3K(PI3Kβ)的p110β催化亚型。然而,PI3K的两种主要催化异构体,即p110α(PI 3 Kα)和PI3Kβ,在PTEN缺失诱导的免疫逃避中的作用机制仍然未知。在次,本文报告了PI3Kβ作为PTEN缺失型乳腺癌中免疫逃避的主要介质,同时证明了PI3Kβ抑制使肿瘤细胞对免疫疗法敏感。
PI3Kβ为PTEN和p53缺陷型浸润性乳腺癌免疫逃逸所必需
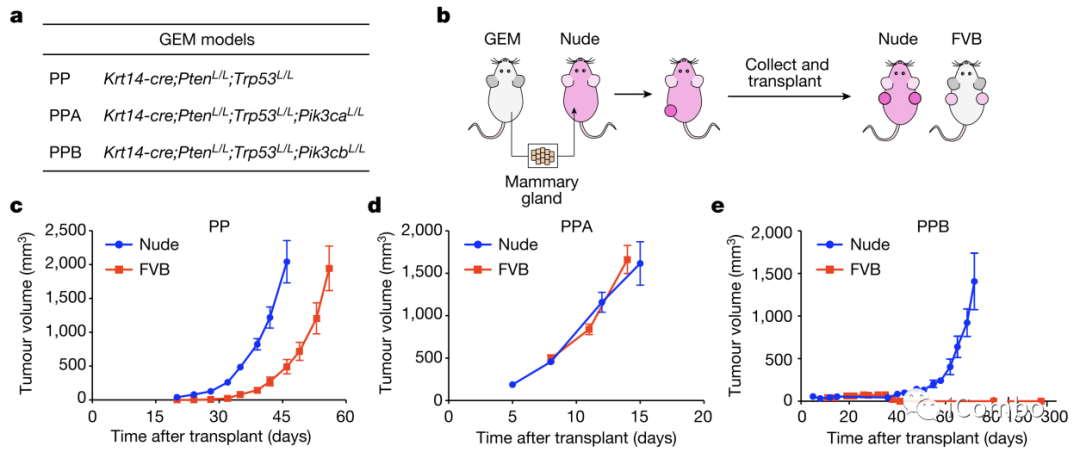
Fig. 1a-e
作者首先是构建了3种基因型的乳腺癌基因工程小鼠模型(GEM),分别是PTEN和p53缺失的PP模型,还有伴有PI3Kα缺失的PPA模型以及PI3Kβ缺失的PPB模型(Fig. 1a)。然后将这三种基因型小鼠的肿瘤,移植到胸腺摘除的小鼠(缺乏T细胞应答),以及免疫活性小鼠,随后成瘤(Fig. 1b)。三组小鼠的成瘤情况各不相同,单纯的PTEN和P53缺失小鼠肿瘤(PP),可以在T细胞缺陷小鼠和免疫活性小鼠种正常生长,但免疫活性小鼠的抑瘤时间相对更长,而缺乏PI3Kα的肿瘤(PPA)几乎不受T细胞的影响,在免疫缺陷和免疫活性小鼠中生长趋势一致。第三组PI3Kβ缺失的肿瘤(PPB),在T细胞缺陷小鼠中成瘤,但在免疫活性小鼠中无法成瘤(Fig. 1c-e)。因此,作者认为,PI3Kβ介导了PTEN和P53缺失型乳腺癌的免疫逃逸。
PI3Kβ介导PTEN和p53缺陷乳腺癌中免疫抑制微环境的形成
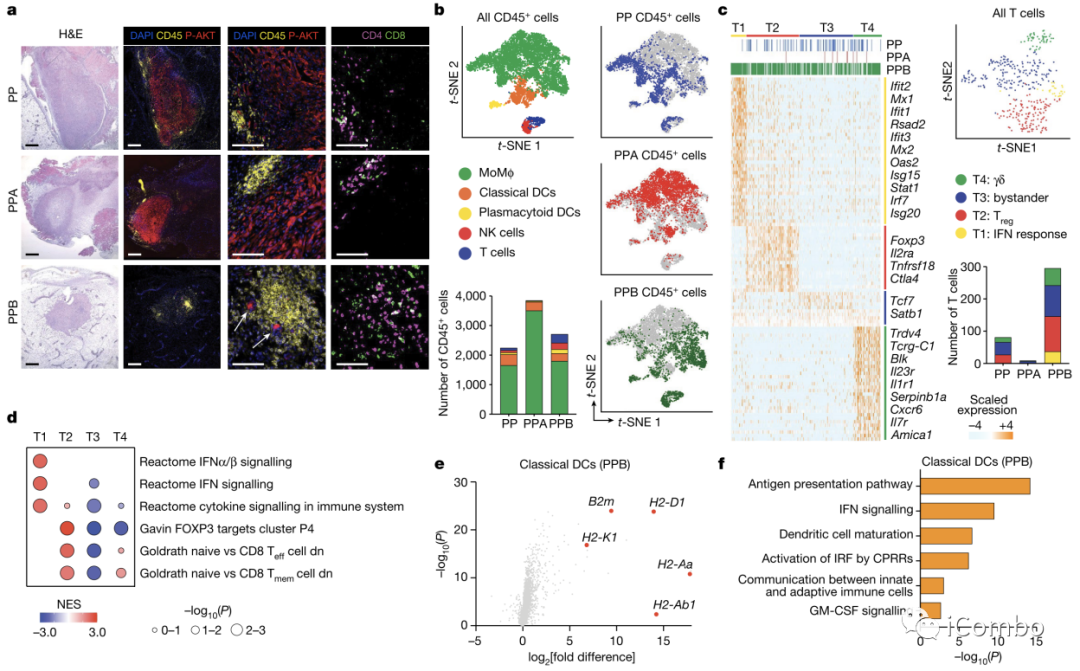
Fig. 2a-f
小鼠肿瘤生长差异只是最表面的提示,第二层研究是针对免疫微环境的分析。
通过循环免疫荧光显示,PP和PPA细胞形成具有强磷酸化AKT(p-AKT)信号的肿瘤,其中CD4+和CD8+T细胞在很大程度上被排除到肿瘤周边,而PPB组仅显示少量残留肿瘤细胞,取而代之的是大量的CD 4+和CD 8 + T细胞浸润(Fig. 2a)。然后,作者通过单细胞RNA测序分析浸润的免疫细胞组成。发现只有在PI3Kβ缺失的肿瘤中含有T细胞的聚类(T1),其在其他两种模型中几乎检测不出T细胞(Fig. 2b)。通过基因表达聚类来将T细胞分成四类,发现IFN应答这一类T细胞只有在PPB组中存在(Fig. 2c)。进一步的基因富集分析也证实了这四种T细胞分类(Fig. 2d)。
随后,作者还检测了与抗原提呈相关的树突状细胞,看到PI3Kβ缺失肿瘤中DC的抗原提呈相关基因显著上调(Fig. 2e)。同样,在通路富集分析中DC上调的最高的经典途径是抗原呈递,其次是与树突细胞成熟和IFN信号传导相关的途径(Fig. 2f)。
说明PI3Kβ原本可以介导免疫抑制性的微环境,它的缺失使得肿瘤免疫应答增强。
PI3Kβ以STAT3依赖性方式介导PTEN缺陷乳腺癌中的促肿瘤免疫信号传导
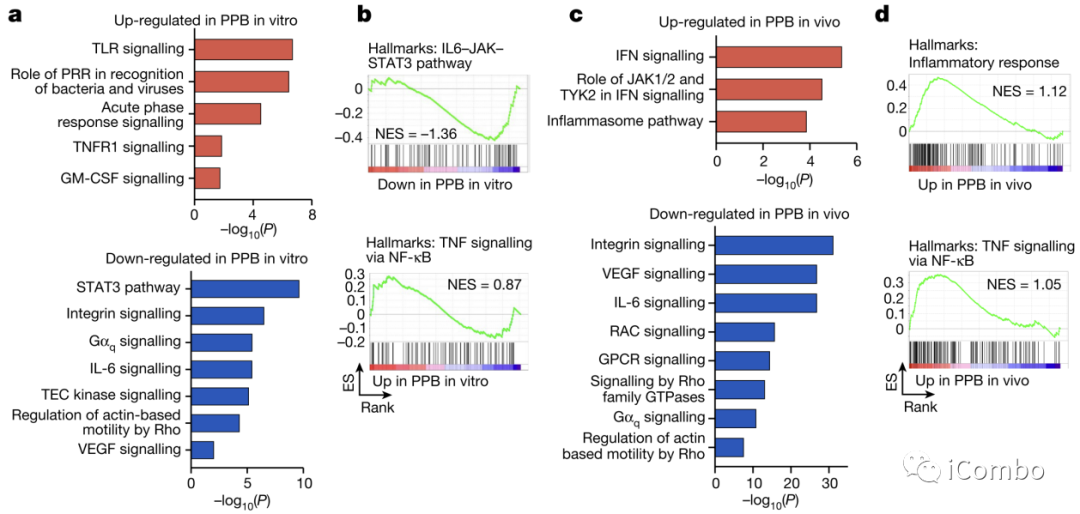
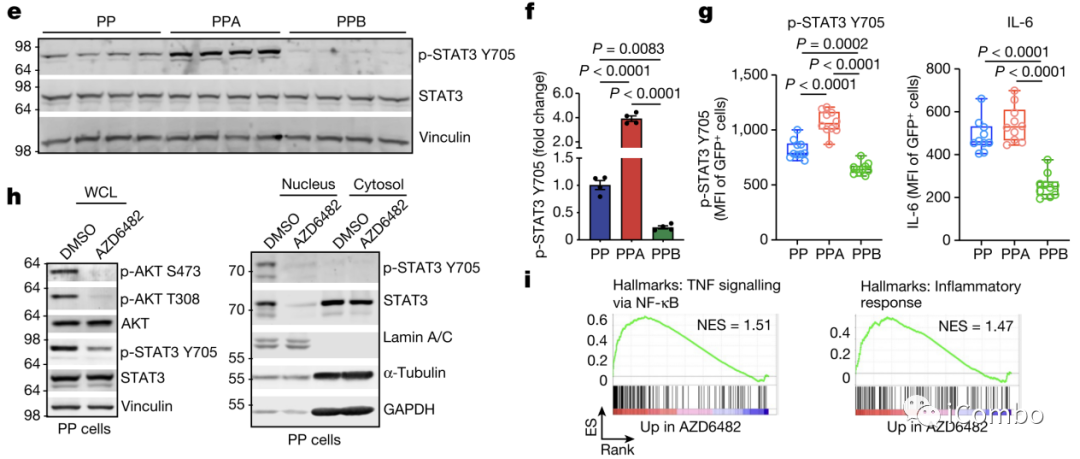
Fig. 3a-i
PI3Kβ具体是通过什么信号途径来介导免疫抑制,这是第三层分析。
作者还是通过富集分析得到的启发,首先是PPB组中的免疫活性通路和DC的成熟路径上调,免疫抑制相关途径下调。特别是看到PI3Kβ缺失的肿瘤中下调最明显的通路是STAT3信号,进一步地对STAT3中地IL-6-JAK-STAT3路径进行富集分析也得到了一样地下调结果。NF-KB到TNF地信号则是上调。以上都是体外培养的PPB细胞结果(Fig. 3a-b)。另外作者还在小鼠PPB肿瘤中进行体内研究分析也得到了类似的结果(Fig. 3c-d)。
作者通过检测STAT3的活性标志物Y705,可以看到PPB组中活化形式的STAT3蛋白表达显著下调,流式检测同样得到类似结果,进一步证实了IL-6-JAK-STAT3通路与PI3Kβ之间的关系(Fig. 3e-g)。
使用PI3Kβ抑制剂模拟PPB缺陷条件,AZD6482处理减少PP细胞中的p-AKT和p-STAT3 Y705以及STAT3核易位,也就是肿瘤细胞标志减少,STAT3的活化减少。另外还看到用了抑制剂后STAT3的核转位减少(正常情况下STAT3存在于胞质中,只有受到一定刺激时才会转入细胞核,从而影响基因表达)(Fig. 3h)。而使用抑制剂后NF-KB-TNF信号增强,炎症反应也增强,和PPB的结果一致(Fig. 3i)。
PTEN缺陷型PDX模型中PI3Kβ抑制诱导免疫抗性Biomarkers的鉴定
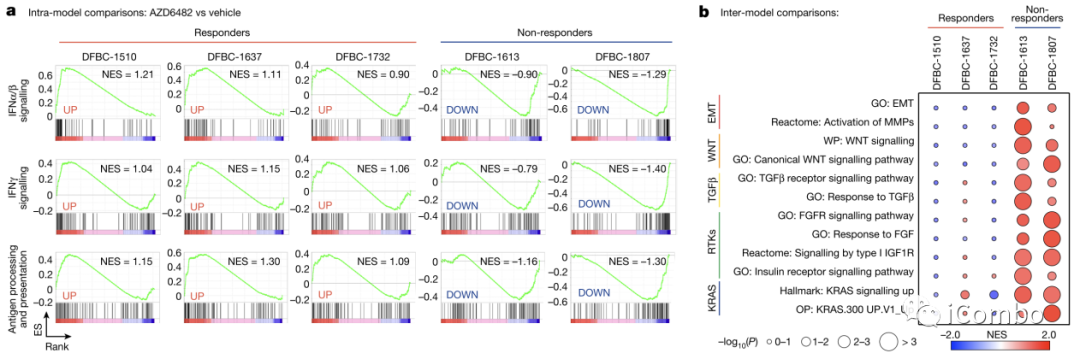
Fig. 4a-b
作者使用乳腺癌患者的术后标本构建了五个PDX小鼠模型,然后给小鼠使用PI3Kβ抑制剂,理论上PI3Kβ的抑制应该会起到抗肿瘤应答效应,但在这五只小鼠中有2只没有产生应答。对比应答组和抗性组的抗肿瘤信号途径,不应答组的小鼠产生了抑制性的免疫反应,即IFN-α/β/γ以及抗原提呈相关路径被抑制。针对免疫抑制性的常见标志如EMT、WNT、TGFβ等,依然在不应答组中出现显著上调。而KRAS活化是目前证实的可以将PI3Kβ转化为PI3Kα的信号,也在不应答组中显著富集。DFBC-1613呈现IGF1R基因的基因组扩增(拷贝数变异(CNV)=4)。DFBC-1807在PI 3Kα基因上具有PIK3CAH1047R致癌突变。作者认为这可能进一步导致PI3Kβ抑制剂的耐药性。
PI3Kβ抑制联合Anti-PD-1协同抑制PTEN和p53缺陷乳腺肿瘤的生长
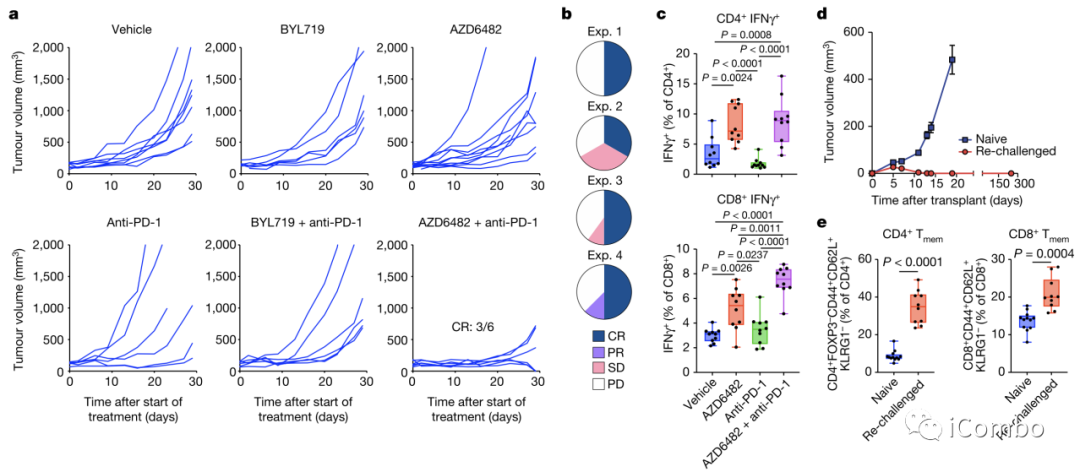
Fig. 5a-d
最后,作者使用PI3Kβ抑制剂联合PD-1抗体,看能否起到免疫增敏效应。
可以看到PI3Kβ抑制剂联合PD-1抗体起到显著的抑瘤效应,6只PP小鼠中有3只达到了CR(Fig. 5a)。进一步扩大多个组别样本量大部分都达到了50%的CR率(Fig. 5b)。流式检测显示CD4+和CD8+T细胞产生的IFN-γ显著升高,呈现更强的免疫活性(Fig. 5c)。
为了检测这种CR小鼠是否具备长期免疫力,作者再次对这些小鼠进行肿瘤种植,发现在CR小鼠身上的二次肿瘤完全无法生长。并且在二次种瘤后2周取肿瘤组织检测,CR小鼠的效应T细胞仍然明显高于对照组(Fig. 5d)。作者认为是局部T细胞的活化赋予了CR小鼠的一个持续抑瘤作用。
小结
1)目前,PI3Kα抑制剂alpelisib(BYL719)已获批与氟维司群联合治疗伴有PIK3CA突变的HR+ HER2−晚期乳腺癌,但由于PI3Kα在胰岛素信号传导中的关键作用而频发高血糖不良反应,严重限制了PI3Kα的使用。
2)PI3Kβ抑制剂正在对具有PTEN缺陷或PIK3CB突变的患者进行临床研究,并且在早期临床试验中显示出可接受的安全性和耐受性特征以及初步疗效。
3)本研究揭示了PTEN缺失肿瘤中PI3Kβ依赖性免疫逃避的机制,并为PI3Kβ抑制及其联合免疫疗法在PTEN缺陷癌症中的临床开发提供了临床前证据。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言