Cell Genomics:开放的儿童脑肿瘤图谱OpenPBTA,加速基因组发现与转化
2023-07-09 测序中国 测序中国 发表于上海
该图谱的分析框架具有分析代码审查和持续集成等特性,拥有40多个可扩展的分析模块,从而确保在项目整个生命周期中的可重复性。
儿童脑肿瘤和脊髓肿瘤是仅次于白血病的第二大常见儿童恶性肿瘤,是儿科疾病相关的主要死因。部分儿童肿瘤的低存活率有多方面的原因,例如对脑肿瘤分子亚型缺乏全面了解,难以对这些肿瘤进行药物治疗,以及专门针对小儿恶性肿瘤的药物短缺等。再加上儿童肿瘤的罕见发病率,用于开发患者衍生的细胞系和小鼠模型的组织样本有限,进一步阻碍了研究。
为了解决这些障碍,多个国家和国际联盟合作,通过观察性和介入性临床试验,统一收集临床注释的外科生物样本和相关种系材料。2018年,儿童脑肿瘤网络(CBTN, https://cbtn.org)和太平洋儿科神经肿瘤联盟(PNOC, https://pnoc.us)联合启动儿童脑肿瘤图谱(PBTA)计划,建立在30多家机构12年的招募、样本收集和临床随访的基础上,并发布了儿童脑瘤图谱(PTBA)。
研究团队预计开放合作的模式将提高PBTA的价值,能够为儿童脑肿瘤数据集的持续分析提供一个框架。近期,该团队及合作者在Cell Genomics发表了题为“OpenPBTA: The Open Pediatric Brain Tumor Atlas”的文章,报道了开放的儿童脑肿瘤图谱版本——OpenPBTA。该图谱的分析框架具有分析代码审查和持续集成等特性,拥有40多个可扩展的分析模块,从而确保在项目整个生命周期中的可重复性。通过OpenPBTA,研究团队对1074种肿瘤和22种细胞系进行了全面、协作、开放的基因组分析,包括来自943名患者的58种不同的脑肿瘤组织。

文章发表在Cell Genomics
研究团队之前对匹配的肿瘤/正常组织进行了全基因组测序(WGS)、全外显子组测序(WXS)和RNA测序,从PBTA的943名患者中选择了细胞系,其中911名患者来自CBTN,32名患者来自PNOC(图1A),跨越各种组织学阶段的治疗(图1B)。
OpenPBTA的一个关键创新是用于分析代码和manuscript撰写的开放框架,即用户可以在GitHub分析存储库中提交issue来提出分析,接下来项目组织者或其他具有专业知识的贡献者会提供拟议分析的反馈(图1C)。贡献者通过提交GitHub pull request(PR)将其分析代码和结果包含在OpenPBTA分析存储库中。所有PR都经过同行评审,确保了代码和文档的科学准确性、可维护性和可读性(图1C和1D)。

图1. OpenPBTA概览
研究人员对943名患者的1074个PBTA肿瘤(n=1019 RNA-seq,n=918 WGS,n=32 WXS/panel)和22个细胞系(n=16 RNA-seq、n=22 WGS)的体细胞SNV、CNV、SV和融合进行了全面的基因组分析。
正如预期的那样,大多数(62%)低级别胶质瘤(LGG)都存在BRAF体细胞突变,其中典型的BRAF::KIAA1549融合是主要的致癌驱动因素(图2A)。在高级别神经胶质瘤(HGG)中,TP53和H3F3A都是突变最多的基因,其次是ATRX的频繁突变。研究还发现EGFR、MET、PDGFRA和KIT的反复扩增和融合,强调这些肿瘤利用多种致癌机制来激活酪氨酸激酶,正如之前报道的那样。
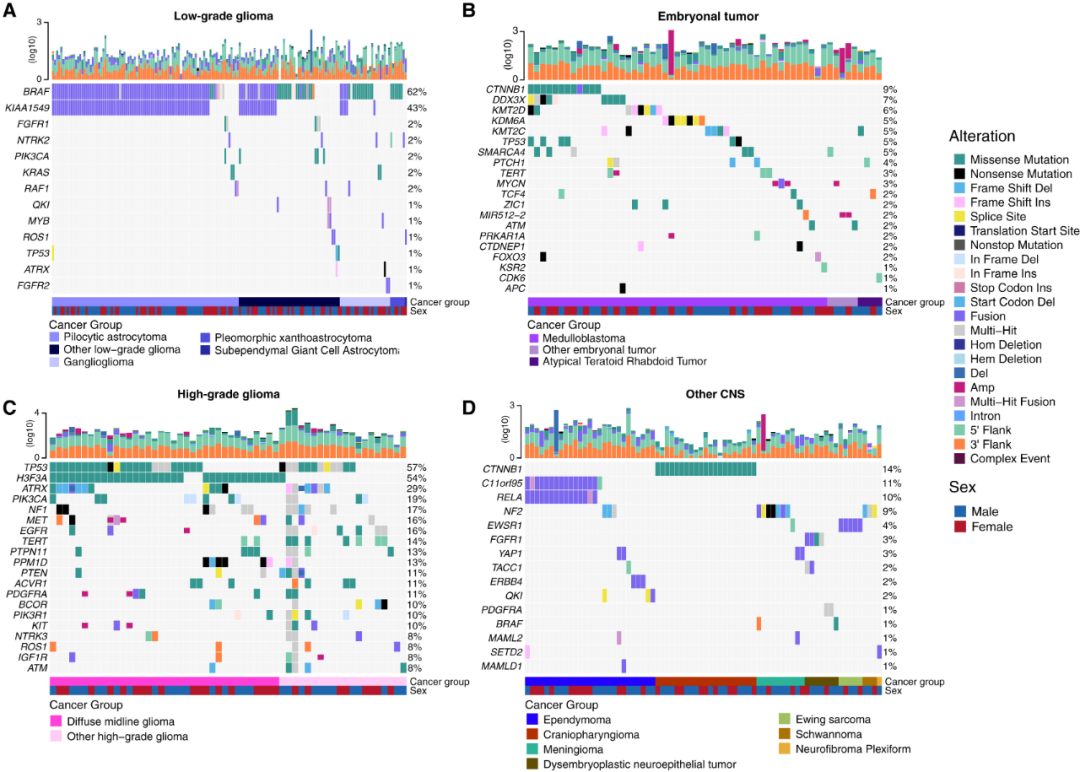
图2. PBTA肿瘤的突变图谱
研究人员分析了668位患者的单个肿瘤,通过WGS分析了突变共现的情况。图3按肿瘤类型显示了原发性肿瘤中排名前50的突变基因,显示了共现分数(图3B)。TP53是OpenPBTA中最常见的突变基因,与H3F3A、ATRX、NF1和EGFR显著同时发生。
CNV和SV分析显示,HGG、弥漫性中线胶质瘤(DMG)和髓母细胞瘤肿瘤的基因组最不稳定,颅咽管瘤和神经鞘瘤通常体细胞CNV较少。SV和CNV断点密度显著相关(图3C),并且正如预期,染色体碎裂区域的数量随着断点密度的增加而增加。在31%(n=12/39)的DMG和44%(n=21/48)的其他HGG中发现了染色体碎裂事件(图3D),并在超过15%的肉瘤、多形性黄色星形细胞瘤(PXA)、转移性继发性肿瘤、脊索瘤、胶质神经元肿瘤、生殖细胞瘤、脑膜瘤、室管膜瘤、髓母细胞瘤、ATRT和其他胚胎肿瘤中发现了染色体碎裂的证据。
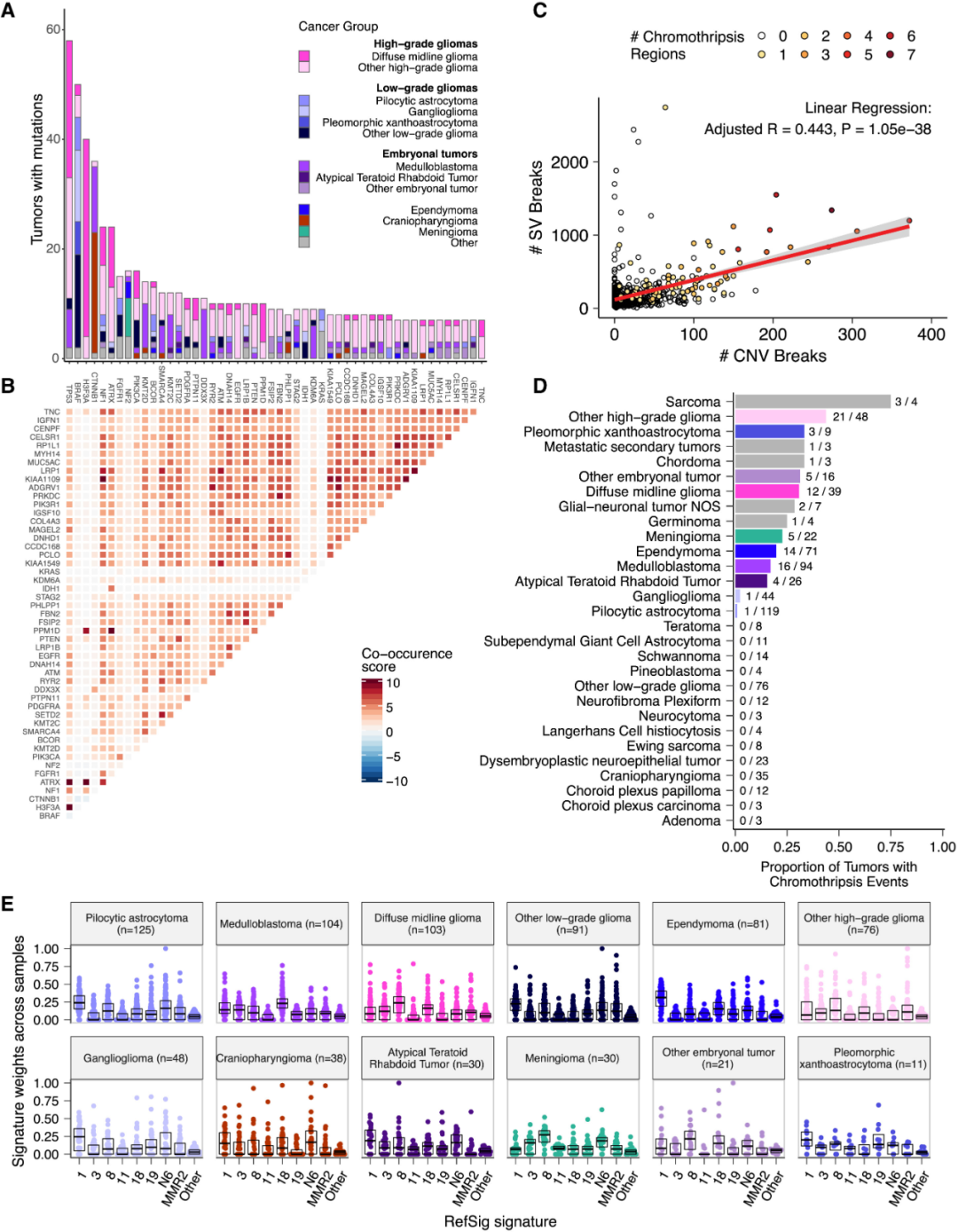
图3. 突变共现和特征突出了关键的致癌驱动因素
转录组学分类显示,在错配修复缺陷的HGG中,TP53普遍失调,TP53缺失是室管膜瘤和H3 K28突变弥漫性中线胶质瘤总生存率低的重要标志。具体而言,研究人员应用TCGA训练的分类器来计算TP53评分,即TP53基因或通路失调的指标,随后推断肿瘤TP53失活状态。
结果显示,“激活的”和“丢失的”肿瘤具有相似的TP53分数(图4B),其中“激活的”表示携带p.R273C或p.R248W功能获得突变之一,“丢失的”表示
(1)该患者被诊断为李-弗劳梅尼综合征(LFS)易感性,
(2)肿瘤携带已知的热点突变,
(3)肿瘤包含SNV和CNV。
与TP53“丢失”突变的肿瘤相比,“激活”的肿瘤显示出更高的TP53表达(图4C)。DMG、成神经管细胞瘤、HGG、DNET、室管膜瘤和颅咽管瘤都已知具有TP53突变,具有最高的TP53分数中值(图4D)。相比之下,神经节胶质瘤、LGG、脑膜瘤和神经鞘瘤的中位数评分最低。此外,高端粒酶评分与脑肿瘤组织学不良预后相关。
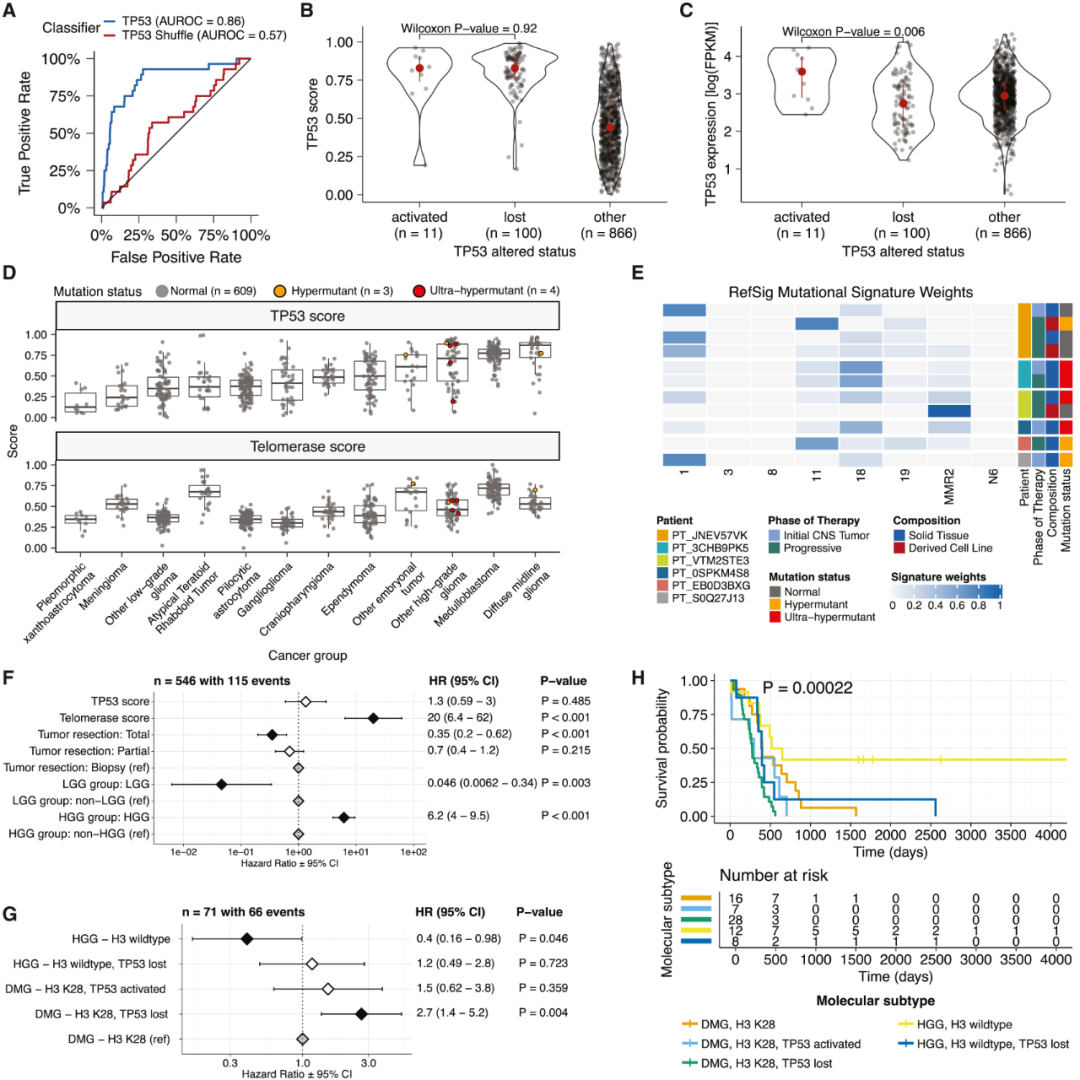
图4. TP53与端粒酶活性。
肿瘤基因表达变异的UMAP可视化(图5A)显示了预期的脑肿瘤组织学聚类。值得注意的是,两个标注为SHH的髓母细胞瘤没有与其他髓母细胞瘤聚集在一起,表明这两个肿瘤潜在的亚型错误分类或存在不同的潜在生物学。
免疫分析显示,与BRAF驱动的LGG和颅咽管瘤相比,侵袭性髓母细胞瘤和室管膜瘤具有较低的免疫浸润。虽然该研究没有检测到免疫细胞浸润对HGG或弥漫性中线神经胶质瘤患者总生存期的显著预后影响,但发现高水平的巨噬细胞M1和单核细胞与髓母细胞瘤患者较差的总生存期相关;高表达的CD274与髓母细胞瘤的总体预后改善显著相关。
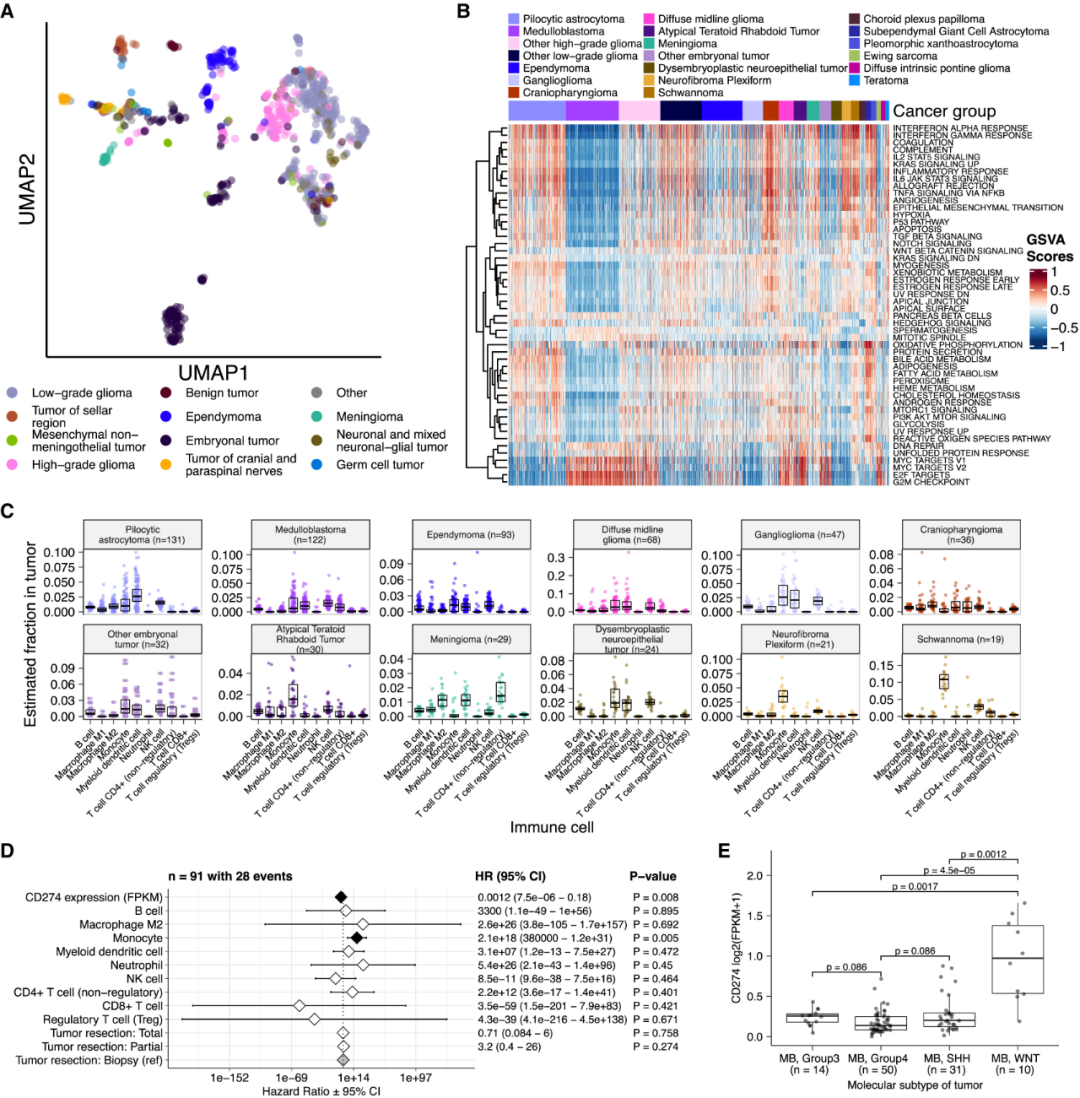
图5. 儿童脑肿瘤的转录组学和免疫图谱
综上所述,OpenPBTA代表了首次大规模、协作、开放的基因组数据分析以及开放的manuscript撰写。研究团队使用可用的WGS、WXS和RNA-seq数据,生成了高度可信的一致SNV和CNV调用,对预测的致癌融合进行了优先排序,并建立了40多个可扩展和严格审查的模块来执行常见的下游癌症基因组学分析。研究团队在多个儿科脑肿瘤组织学中检测到了预期的基因组病变模式、突变特征和异常调节的信号通路。研究确定了标志性癌症途径的富集,并描述了儿童脑肿瘤的免疫细胞状态,证明了某些组织学肿瘤,如神经鞘瘤、颅咽管瘤和LGG,可能具有炎性肿瘤微环境。
文章共同通讯作者、费城儿童医院生物信息学科学家Jo Lynne Rokita博士表示:“虽然有许多人支持科学研究的开源模式,但对于儿儿童癌症来说,却没有这样的模式。因此,我们设计了OpenPBTA,这样任何人都可以访问数据,为其分析做出贡献,和/或在他们自己的研究中使用它。”
OpenPBTA使用开放、可重复和可扩展的分析为协作数据驱动发现的新模式铺平了道路,这种分析将随着时间的推移而不断发展。期待这项基础性工作将对儿科肿瘤研究人员产生持续、长期的影响,最终加速转化并改善癌症儿童的预后。
参考资料:
Shapiro, J. A., Gaonkar, K. S., Spielman, S. J., Savonen, C. L., Bethell, C. J., Jin, R., ... & Taroni, J. N. (2022). OpenPBTA: The Open Pediatric Brain Tumor Atlas. Cell Genomics.
https://www.cell.com/cell-genomics/fulltext/S2666-979X(23)00115-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







