论著:| 环状RNA hsa_circ_0001573对乳腺癌细胞生物学行为的影响及机制研究
2023-05-29 中国癌症杂志 网络 发表于上海
| 环状RNA hsa_circ_0001573对乳腺癌细胞生物学行为的影响及机制研究。
陈 红,陈俊霞. 环状RNA hsa_circ_0001573对乳腺癌细胞生物学行为的影响及机制研究[J]. 中国癌症杂志, 2023, 33 (4): 342-353.
第一作者:陈 红(ORCID:0009-0002-7716-9587),硕士研究生在读。
通信作者:陈俊霞(ORCID:0000-0002-8531-7562),博士,教授,博士研究生导师。
环状RNA hsa_circ_0001573对乳腺癌细胞生物学行为的影响及机制研究
陈 红,陈俊霞
重庆医科大学分子医学与肿瘤研究中心,重庆 400016
[摘要] 背景与目的:环状RNA(circular RNA,circRNA)是一类呈闭合环状结构的非编码RNA,在基因表达调控方面具有重要的潜能。CircRNA与肿瘤的发生、发展密切相关。本研究旨在探讨hsa_circ_0001573对乳腺癌细胞生物学行为的影响及机制。方法:收集重庆医科大学附属第一医院2020年1月—2021年1月经手术切除的4例乳腺癌组织和癌旁组织,通过RNA微阵列芯片分析(microarray analysis)技术进行分析,并采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)验证40例乳腺癌组织和癌旁组织以及正常人乳腺上皮细胞MCF-10A和乳腺癌细胞(MCF-7和SK-BR-3)中hsa_circ_0001573的相对表达量。采用荧光原位杂交(fluorescence in situ hybridization,FISH)实验进一步检测其在细胞中的定位与表达。转染干扰质粒后,采用细胞计数试剂盒(cell counting kit-8,CCK-8)、EdU实验检测细胞增殖;通过transwell小室实验、伤口愈合实验和克隆形成实验分别检测细胞侵袭和迁移;采用Hoechst33342、TUNEL与流式细胞术检测细胞凋亡和细胞周期。采用蛋白质印迹法(Western blot)检测CCND1、CCND2和CDK4的表达。探讨hsa_circ_0001573对裸鼠移植瘤生长的影响。采用RNA pull down实验检测与hsa_circ_0001573相互作用的蛋白,荧光原位杂交联合免疫荧光(fluorescence in situ hybridization and immunofluorescence,FISH-IF)进一步检测hsa_circ_0001573与GNB4的亚细胞共定位,探究潜在的分子机制。结果:hsa_circ_0001573在乳腺癌组织(P<0.05)和乳腺癌细胞(P <0.001)中显著上调,敲低hsa_circ_0001573能抑制乳腺癌细胞的增殖、迁移和侵袭,诱导细胞凋亡,降低CCND1、CCND2和CDK4的相对表达量。体内实验结果表明,敲低hsa_circ_0001573可抑制移植瘤生长。RNA pull down实验显示,hsa_circ_0001573与GNB4蛋白结合,FISH-IF表明hsa_circ_0001573与GNB4共定位于乳腺癌细胞中,且与GNB4相互作用能促进c-myc的表达。结论:环状RNA hsa_circ_0001573在乳腺癌中高表达,敲低hsa_circ_0001573对细胞增殖、侵袭能力及细胞凋亡和细胞周期有调控作用,并在体内抑制移植瘤生长,可通过与GNB4蛋白的相互作用,本研究结果可望为乳腺癌治疗提供新靶点。
[关键词] 环状RNA;乳腺癌;Hsa_circ_0001573;细胞增殖;细胞凋亡;移植瘤;GNB4
[Abstract]Background and purpose: Circular RNA (CircRNA) is a type of non-coding RNA with a closed circular structure, which has important potential in gene expression regulation. CircRNA is closely related to the occurrence and development of tumor. This study aimed to explore the influence of hsa_circ_0001573 on the biological behavior of breast cancer cells and its mechanism. Methods: Breast cancer tissues and paracancerous tissues of 4 patients surgically removed at the First Affiliated Hospital of Chongqing Medical University from January 2020 to January 2021 were collected, sequenced and analyzed by RNA microarray analysis. Real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) was used to detect the relative expression of hsa_circ_0001573 in breast cancer tissues and paracancerous tissues of 40 cases, as well as normal human breast cancer epithelial cell MCF-10A and breast cancer cells (MCF-7 and SK-BR-3), and the location and expression were further examined by fluorescence in situ hybridization (FISH) assay. The interference vector was transfected into breast cancer cells. Cell counting kit-8 (CCK-8), EdU, wound healing, clonal formation, Hoechst 33342, TUNEL, flow cytometry and transwell assays were adopted to determine cell migration, invasion, proliferation and apoptosis. Western blot was employed to measure the expressions of CCND1, CCND2 and CDK4. The effect of hsa_circ_0001573 on the growth of xenograft tumors was observed in nude mice. RNA pulldown assay was performed to identify hsa_circ_0001573-associated proteins. Subcellular localization of hsa_circ_0001573 and GNB4 was clarified by FISH and immunofluorescence (FISH-IF), to explore potential molecular mechanisms. Results: The expression level of hsa_ circ_0001573 was high in breast cancer (P<0.001) and breast cancer cells (P<0.001). Downregulation of hsa_circ_0001573 could inhibit the proliferation, migration and invasion of breast cancer cells, induce cell apoptosis leading to cell cycle arrest in G1 phase, and obviously decrease the expressions of CCND1, CCND2 and CDK4. The results of in vivo experiments showed that knockdown of hsa_circ_0001573 inhibited the growth of xenograft tumors. RNA pulldown experiment showed that hsa_circ_0001573 combined with GNB4 protein. FISH-IF indicated that hsa_circ_0001573 was co-localized with GNB4 in the nucleus and interacted with GNB4 to promote the expression of c-myc. Conclusion: CircRNA hsa_circ_0001573 is highly expressed in breast cancer. Knockdown of hsa_circ_0001573 could regulate cell proliferation, invasion, apoptosis and cell cycle arrest, and inhibit the growth of xenograft tumors in vivo, thus providing a new target for breast cancer treatment.
[Key words] CircRNA; Breast cancer; Hsa_circ_0001573; Cell proliferation; Apoptosis; Xenograft tumors; GNB4
乳腺癌是女性中发病率第一的恶性肿瘤, 2022年癌症统计数据显示,在美国乳腺癌已经占女性所有肿瘤的31%,并且呈年轻化趋势[1]。尽管出现了新的治疗途径,肿瘤复发仍然是乳腺癌治疗中的挑战。与乳腺癌发生、发展密切相关的新的分子生物标志物,将为乳腺癌诊治提供新的手段[2]。
与线性RNA结构不同,环状RNA(circular RNA,circRNA)呈单链共价闭合环状结构,无5'帽端和3'尾端[3]。在过去的30年里,这些circRNA被认为是错误剪接或前体mRNA加工过程中的副产物,在不同的生物体中,也只有少量circRNA被发现[4]。然而,随着高通量测序技术的发展和广泛应用,大量circRNA已被成功识别,研究[5]表明circRNA广泛参与细胞的生长、分化、发育和凋亡等病理生理学过程,并与多种恶性肿瘤的发生、进展相关。Wang等[6]研究表明,circRNA-000911在乳腺癌中通过对miR-449的海绵样作用,从而激活Notch1和核因子κB (nuclear factor κB,NF-κB)信号转导通路,发挥其抑制肿瘤的作用。研究[7]报道circ-0068631可通过与EIF4A3结合维持c-myc的稳定性,抑制circ-0068631/EIF4A3/c-myc轴是乳腺癌的一种潜在策略。机制研究[8]表明,USF2介导的circACTN4可能直接与FUBP1结合,二者之间的相互作用可以阻碍FUBP1与FIR的结合,从而激活c-myc的转录,circACTN4可能是一种新的预后生物标志物和有前景的乳腺癌治疗靶点。
鸟嘌呤核苷酸结合蛋白亚单位β4(guanine nucleotide binding protein subunit beta 4,GNB4)
的异常表达影响多种实体肿瘤的发生、发展,如在乳腺癌中参与调控增殖、周期和凋亡[9]。c-myc在控制癌细胞增殖,凋亡及耐药性方面发挥着重要作用[10]。
本研究旨在探讨hsa_circ_0001573在乳腺癌中的表达及其促进乳腺癌增殖、侵袭及凋亡的作用,并初步探索hsa_circ_0001573与GNB4的相互作用机制,为寻找乳腺癌治疗新靶点提供线索。
1
材料和方法
1.1 材料
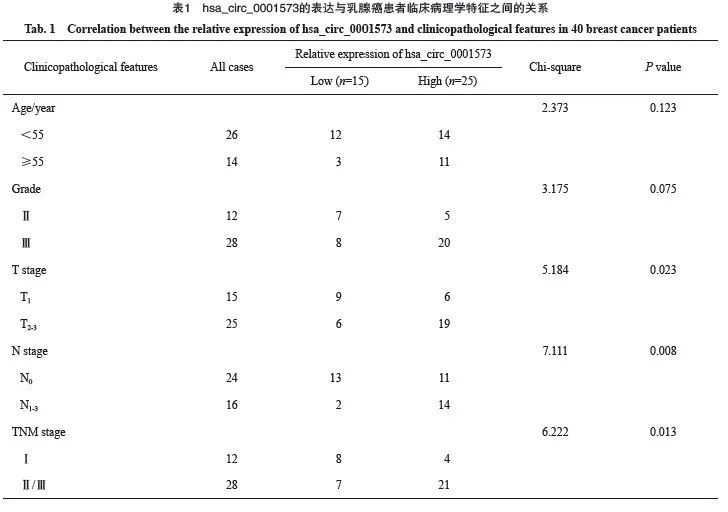
1.1.1 临床样本和细胞系
选取重庆医科大学附属第一医院2020年1月—2021年1月经手术切除的女性乳腺癌患者40例标本,术前均签署知情同意书。标本切除后立刻保存于液氮中。本研究已获得重庆医科大学伦理委员会的批准。人正常乳腺上皮细胞MCF-10A、乳腺癌细胞系MCF-7和SK-BR-3保存于本实验研究中心。
1.1.2 主要试剂及实验动物
hsa_circ_0001573对照质粒和干扰质粒及其探针(Cy3标记)由广州吉赛生物科技股份有限公司设计合成。DMEM培养基和RPMI-1640培养基购自美国Saimike公司,胎牛血清(fetal bovine serum,FBS)购自重庆睿宸生物科技有限公司,转染试剂LipofectamineTM2000购自美国Invitrogen公司,反转录试剂盒和SYBR Green购自日本TaKaRa公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自美国Genview公司,TUNEL、EdU和Hoechst33342试剂盒购自上海碧云天生物技术有限公司,transwell小室购自美国Millipore公司,CCND2、CCND1、CDK4、Bcl-2、bax、caspase-3(cleaved)和GAPDH抗体购自英国Abcam公司,4周龄BALB/c雌性裸鼠购自重庆腾鑫生物科技有限公司。
1.2 方法
1.2.1 RNA微阵列芯片分析
提取4例未接受放化疗的女性乳腺癌患者术后乳腺癌组织和癌旁组织总RNA,检测浓度、纯度和完整度,检验合格后进行后续实验。上海康成生物科技有限公司对所提供的临床样本进行芯片测序,得到差异倍数>2、P <0.05差异表达的circRNA差异表达谱,其中hsa_circ_0001573差异表达显著。
1.2.2 细胞培养与转染
正常人乳腺上皮细胞系(MCF-10A)以及乳腺癌细胞系(MCF-7和SK-BR-3)均使用含10%FBS的DMEM培养基,3种细胞系均在37℃、CO2体积分数为5%的条件下培养,每隔12~24 h更新培养基。待显微镜下观察细胞密度达70%~80%时使用LipofectamineTM2000按说明书分别将质粒si-NC和si-circ转染至MCF-7细胞或SK-BR-3细胞中,24~48 h后收集细胞。
1.2.3 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
转染24 h后,TRIzol法提取正常人乳腺上皮细胞MCF-10A、乳腺癌细胞(MCF-7和SK-BR-3)、乳腺癌组织和癌旁组织总RNA,琼脂糖凝胶电泳鉴定RNA完整度,酶标仪检测其纯度和浓度,在37℃ 15 min、85℃ 5 s的条件下将反应体系反转录为cDNA。hsa_circ_0001573在乳腺癌细胞和组织中的相对表达量由Bio-Rad公司的RTFQ-PCR仪检测。以cDNA为模板,GAPDH为内参,在95℃预变性3 min、95℃变性5 s、60℃退火3 s、72℃延伸3 s,共42个循环。每个样品设3个重复组,用2-ΔΔCt法计算hsa_circ_0001573的相对表达量。引物GAPDH上游引物序列为5'-CGGAGTCAACGGATTTGGTCGTAT-3',下游引物序列为5'-AGCCTTCTCCATGGTGG TGAAGAC-3';hsa_circ_0001573上游引物序列为5'-CACATGCTGGTGCACTCTGG-3',下游序列为5'-ACACAGTCGGAGCAACCTGTG-3';C-myc上游序列为5'-CGACGAGACCTTCATCAAA AA-3',下游引物序列为5'-CTTCTCTGAGACGA GCTTGG-3'。
1.2.4 FISH检测hsa_circ_0001573的表达
用PBS洗5 min(3次),用组织固定液(含DEPC水)固定15 min,TritonX-100(0.3%)冰上通透15 min;加入适量预杂交液使细胞完全覆盖,于37℃条件下温育1 h;混合hsa_ circ_0001573探针和杂交液(1∶99),于85℃变性5 min,37℃平衡2 min,滴加变性探针混合液使细胞完全覆盖,于37℃条件下杂交过夜;去除多余液体,2×SSC清洗5 min(6次),避光条件下滴加DAPI染色液复染15 min,PBS清洗5 min(3次);封片后荧光显微镜下观察及拍照。1.2.5 伤口愈合实验检测细胞迁移
细胞转染24 h后,待细胞生长密度达90%时用200 μL枪头进行划痕,采集0 h显微镜下划痕距离照片,使用无血清培养基培养24 h后采集24 h显微镜下划痕距离照片,通过计算出的迁移率表示细胞迁移能力。
1.2.6 Transwell实验检测细胞迁移与侵袭
将50 μL基质胶稀释液(基质胶与无血清培养基之比为1∶9)铺于transwell小室上室,4℃过夜备用于侵袭实验。用无血清培养基将转染 24 h后的乳腺癌细胞(MCF-7和SK-BR-3)分别制成细胞悬液(2×104/mL),每孔200 μL接种至上室,下室加入500 μL含10%FBS DMEM的培养基,培养24 h后,弃去培养基后用棉签轻轻拭去下室表面的基质胶,甲醇固定30 min,PBS清洗5 min(3次),0.2%结晶紫染色15 min,晾干小室后显微镜下观察并拍照。迁移实验除不用铺基质胶外其余步骤都相同。
1.2.7 CCK-8和EdU实验检测细胞增殖
将转染48 h后的乳腺癌细胞(MCF-7和SK-BR-3)分别制成细胞悬液(1×104/mL)接种至96孔板中,贴壁4 h后每孔加入200 μL已按比例稀释的CCK-8溶液,放入温度37℃、CO2体积分数为5%的温箱中温育1 h,使用酶标仪测定450 nm处的吸光度(D)值,连续记录0、24、48、72和96 h的数据并绘制生长曲线。待乳腺癌细胞(MCF-7和SK-BR-3)在24孔板中贴壁后按照EdU操作说明书进行清洗、通透、Apollo染色及DAPI染色,然后荧光显微镜下观察并拍照。
1.2.8 克隆形成实验
将转染24 h后的乳腺癌细胞(MCF-7和SK-BR-3)分别制成细胞悬液(1×104个/mL),每孔100 μL接种于6孔板中,于37℃、CO2体积分数为5%的条件下培养。5 d后半量换液,10 d后弃去培养基,PBS清洗5 min(3次),用4%多聚甲醛固定20 min,0.2%结晶紫染色15 min,PBS清洗5 min(3次),晾干后拍照并进行计数。
1.2.9 Hoechst33342实验检测细胞凋亡
将转染24 h后的乳腺癌细胞(MCF-7和SK-BR-3)分别制成细胞悬液接种于铺有玻片的24孔板中,贴壁4 h后PBS清洗5 min,4%多聚甲醛固定15 min,DAPI染色20 min,PBS清洗5 min(3次),Triton X-100(0.5%)通透15 min,PBS清洗5 min(3次);滴加Hoechst33342染色液至细胞完全覆盖,于37℃温箱中避光温育1 h;封片后荧光显微镜下观察及拍照。
1.2.10 TUNEL法检测细胞凋亡
将转染24 h后的乳腺癌细胞(MCF-7和SK-BR-3)分别制成细胞悬液接种于铺有玻片的24孔板中,温育过夜,PBS清洗5 min(3次),4%多聚甲醛固定30 min,TritonX-100(0.5%)冰上通透10 min,PBS清洗5 min;每孔加入100 μL TUNEL检测液,于42℃温箱中避光温育1 h,抗荧光淬灭剂封片,荧光显微镜下观察及拍照。
1.2.11 流式细胞术检测细胞凋亡和细胞周期
将乳腺癌细胞(MCF-7和SK-BR-3)分别接种至6孔板中,细胞转染72 h后用0.25%胰酶消化并收集于15 mL离心管中,PBS缓冲液10 000 r/ min离心5 min,弃上清液,重复2次。将1×106个细胞重悬于500 μL PBS中,AnnexinⅤ/PI染色法检测细胞凋亡;将1×106个细胞重悬于100 μL PBS中,缓慢加入900 μL预冷75%乙醇(4℃条件下可保存2~3周),用流式细胞术检测细胞周期分布。
1.2.12 蛋白质印迹法(Western blot)检测蛋白水平
收集转染48 h后的各组细胞,提取总蛋白并测定浓度后按1∶4的比例将蛋白上样缓冲液(5×)加入到蛋白样品中,100℃金属浴10 min使蛋白变性备用,冷却后置于-80℃保存。每孔按10 μg进行上样,经10%十二烷基硫酸钠(sodium dodecylsulphate,SDS)-聚偏二氟乙烯(polyvinylidene fluoride,PVDF)恒压80 V电泳分离30 min、120 V分离40 min;冰水浴恒流240 mA转膜;脱色摇床上用10%脱脂奶粉封闭2 h;4℃摇床温育一抗(鼠抗caspase-3抗体1∶2 000,鼠抗Bcl-2抗体1∶1 000,鼠抗bax抗体1∶2 000,兔抗GAPDH抗体1∶5 000,兔抗CCND2抗体1∶2 500,兔抗CCND1抗体1∶2 000,兔抗CDK4抗体1∶2 000,兔抗GNB4抗体1∶1 500)过夜;37℃温育(二抗羊抗兔抗体1∶5 000,羊抗鼠抗体1∶5 000)1.5 h。采用ECL化学发光显色,在Bio-Rad凝胶成像仪中拍照,并用Image Lab对图像进行分析。
1.2.13 pull down实验
依次用0.1 mmol/L氢氧化钠、50 mmol/L氯化钠和20 mmol/L Tris对磁珠进行预处理。收集到的细胞经PBS清洗后加入裂解液进行裂解。加入生物素标记的hsa_circ_0001573探针重悬磁珠,在4℃摇床温育30 min后收集磁珠。加入450 μL 1×RNA Capture缓冲液后将Eppendorf试管置于磁力架重悬磁珠;再加入450 μL细胞裂解液,4℃摇床温育3 h,收集磁珠。用1×RNA Wash缓冲液涡旋清洗磁珠3次(5 s/次)。取100 μL 1×RNA Capture缓冲液和10 μL 5×Loading缓冲液重悬样品。100℃金属浴10 min,于-20℃保存。所得产物采用Western blot和质谱法检测。
1.2.14 细胞免疫荧光实验
将培养至对数生长期的各组细胞取出,PBS清洗5 min,用4%多聚甲醛固定30 min,PBS清洗3 min(3次),Triton X-100(0.5%)冰上通透20 min,PBS清洗3 min(3次);滴加3%牛血清白蛋白溶液(albumin, bovine standard solution, BSA),37℃温箱中封闭30 min,弃封闭液;加入3%BSA稀释后的一抗(GNB4,1∶100), 4℃过夜;PBS清洗5 min(3次),在避光环境下加入荧光二抗(1∶100),37℃条件下温育30 min,PBS清洗5 min(3次);加入DAPI染色液避光染色15 min,封片后荧光显微镜下观察并拍照。
1.2.15 免疫组织化学检测
石蜡切片放置于65℃烤箱中烘烤2 h,二甲苯中浸泡15 min(2次),依次浸泡于乙醇中(100%、100%、95%、85%和75%)5 min,双蒸水中浸泡5 min(2次),PBS清洗5 min(3次);切片置于90℃左右的枸橼酸钠缓冲液中加热20 min,冷却后PBS清洗5 min(3次);弃去多余液体,加入阻断剂后避光温育10 min,PBS清洗5 min(3次);滴加封闭液于室温封闭20 min;弃去多余液体,温育一抗(兔抗CCND2抗体1∶50,兔抗CCND1抗体1∶100,兔抗CDK4抗体1∶100)过夜;PBS清洗5 min (3次),滴加二抗(生物素标记),于37℃条件下温育20 min;滴加链霉卵白素工作液,于 37℃条件下温育20 min,PBS清洗3 min(3次);滴加DAB显色液于切片上室温温育5 min,三蒸水洗;滴加苏木精染色液至切片上室温温育2 min,三蒸水洗;用1%盐酸乙醇分化切片,三蒸水洗;依次浸泡于乙醇中(70%、80%、95%、95%和100%)5 min,二甲苯中浸泡5 min(2次);中性树胶封片,显微镜下观察及拍照。
1.2.16 裸鼠移植瘤实验
MCF-7细胞转染hsa_circ_0001573干扰质粒(si-circ)和对照质粒(si-NC),每间隔3 d更换新鲜培养基(含嘌呤霉素浓度为700 ng/ mL),培养两周后获得稳定转染细胞株;分别将两组稳转株制成细胞悬液(2×106个/mL),每只 100 μL接种于21~28 d龄的BALB/c裸鼠皮下(4只/组);持续关注移植瘤生长情况,5周后处死小鼠取下移植瘤,制成石蜡切片用于免疫组织化学检测。
1.3 统计学处理
采用SPSS 21.0和GraphPad Prism 8.0统计分析,采用配对t检验比较两组数据,单因素方差分析比较多组比较,采用卡方检验进行定性变量相关性分析,P<0.05为差异有统计学意义。
2
结 果
2.1 hsa_circ_0001573在乳腺癌细胞和组织中显著高表达
收集4例乳腺癌组织和癌旁组织进行RNA微阵列芯片分析,以差异倍数>2,P<0.05为标准筛选出表达显著上调的hsa_circ_0001573(图1)。采用RTFQ-PCR检测40例乳腺癌组织和癌旁组织、正常人乳腺上皮细胞和乳腺癌细胞中hsa_circ_0001573的表达情况。结果显示,hsa_circ_0001573在乳腺癌组织和细胞中均明显高表达(图2A、B)。hsa_circ_0001573在40例乳腺癌组织和癌旁组织中的表达与乳腺癌的T(P=0.023)、N(P=0.008)和TNM(P=0.013)分期存在正相关,与年龄、分级等临床病理学参数无关(表1)。FISH实验检测结果显示hsa_circ_0001573主要分布于细胞核中(图2C)。
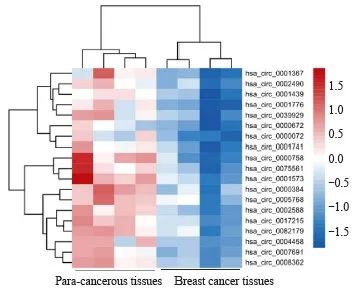
图1 乳腺癌组织及癌旁组织中差异表达的circRNA热图
Fig. 1 Heat map of differentially expressed circRNA in breast cancer tissues and para-cancerous tissues
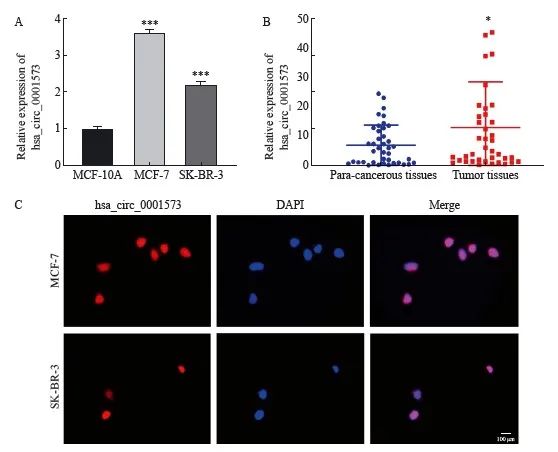
图2 hsa_circ_0001573的表达及定位
Fig. 2 Expression and localization of hsa_circ_0001573
A: Relative expression of hsa_circ_0001573 in cell lines; ***: P<0.001, compared with MCF-10A; B: Relative expression of hsa_circ_0001573 in 40 cases of breast cancer tissues; *: P<0.05, compared with paracancerous tissues; C: FISH detection (×400).
2.2 hsa_circ_0001573干扰质粒的效率验证
将干扰质粒(si-circ)和对照质粒(si-NC)分别转染乳腺癌细胞(MCF-7和SK-BR-3),采用RTFQ-PCR检测hsa_circ_0001573的相对表达量。结果显示,相较于对照质粒(si-NC)组,干扰质粒(si-circ)组中hsa_circ_0001573的相对表达水平明显降低(P<0.001,图3)。

图3 RTFQ-PCR检测干扰质粒效率
Fig. 3 The transfection efficiency of breast cancer cells
***: P<0.001, compared with si-NC
2.3 敲低hsa_circ_0001573抑制细胞迁移和侵袭
运用伤口愈合实验和transwell实验检测细胞迁移和侵袭能力。划痕实验中,MCF-7细胞si-NC组的相对迁移率为0.974±0.015,si-circ组的相对迁移率为0.262±0.027,与si-NC组相比,si-circ组的相对迁移率降低显著(P <0.001,图4A);SK-BR-3细胞si-NC组的相对迁移率为0.918±0.019,si-circ组的相对迁移率为0.520±0.0.021,与si-NC组相比,si-circ组的相对迁移率降低显著(P<0.001,图4B)。transwell实验结果显示,与si-NC组相比,si-circ组的迁移和侵袭细胞个数显著减少(P<0.001,图4C~F)。

图4 下调hsa_circ_0001573对乳腺癌细胞迁移和侵袭能力的影响
Fig. 4 Effects of downregulation of hsa_circ_0001573 on the migration and invasion of breast cancer cells
A: Wound healing (×50); B, C: Cell invasion (×200); D, E: Cell migration (×200); ***: P<0.001, compared with si-NC.
2.4 敲低hsa_circ_0001573抑制细胞增殖
运用CCK-8实验、EdU和克隆形成实验检测细胞增殖能力。CCK-8实验结果表明,MCF-7细胞和SK-BR-3细胞连续培养96 h后,si-circ组的细胞活性明显低于si-NC组(P<0.001,图5A、B)。EdU实验显示,相较于si-NC组,si-circ组MCF-7细胞和SK-BR-3细胞增殖能力明显降低(P<0.001,图5C~E)。克隆形成实验中,相较于si-NC组,si-circ组MCF-7细胞和SK-BR-3细胞的克隆形成能力显著降低(P<0.001,图5F、G)。

图5 下调hsa_circ_0001573对乳腺癌细胞增殖能力的影响
Fig. 5 Effects of downregulation of hsa_circ_0001573 on the proliferation of breast cancer cells A, B: CCK-8; C-E: EdU (×100); F, G: Colony formation; ***: P<0.001, compared with si-NC.
2.5 敲低hsa_circ_0001573诱导细胞凋亡
采用Hoechst33342、TUNEL和Western blot实验检测细胞凋亡能力。在Hoechst 33342实验中,相较于si-NC组,si-circ组MCF-7细胞和SK-BR-3细胞出现明显的凋亡特征:细胞出现核团碎裂,可在荧光显微镜观察到发亮荧光(P<0.001,图6A)。TUNEL实验显示,si-circ组检测到更多呈绿色荧光的凋亡细胞(P<0.001,图6B)。流式细胞术检测到si-circ组细胞凋亡率明显高于si-NC组(P<0.01,图6C、D)。提取转染48 h后的乳腺癌细胞(MCF-7和SK-BR-3)总蛋白,Western blot检测相关凋亡蛋白Bcl-2、bax和caspase-3表达水平,与si-NC组比较,si-circ组Bcl-2蛋白表达水平下降,而bax和caspase-3(cleaved)表达升高(P <0.001,图6E~G)。

图6 下调hsa_circ_0001573诱导乳腺癌细胞凋亡
Fig. 6 Effects of downregulation of hsa_circ_0001573 on the apoptosis of breast cancer cells
A: Hoechst33342(×200); B: TUNEL (×100); C, D: Flow cytometry; E-G: Western blot; ***: P<0.001, compared with si-NC; **:P<0.01, compared with si-NC; *:P<0.05, compared with si-NC.
2.6 敲低hsa_circ_0001573检测细胞周期
运用流式细胞术和Western blot实验检测细胞周期。与si-NC组相比,si-circ组MCF-7细胞和SK-BR-3细胞发生G1期阻滞(P<0.001,图7A、B)。Western blot检测相关周期蛋白CCND2、CCND1和CDK4表达水平,与si-NC组比较,CCND2、CCND1和CDK4蛋白表达水平显著降低(P<0.01,图7C~E)。
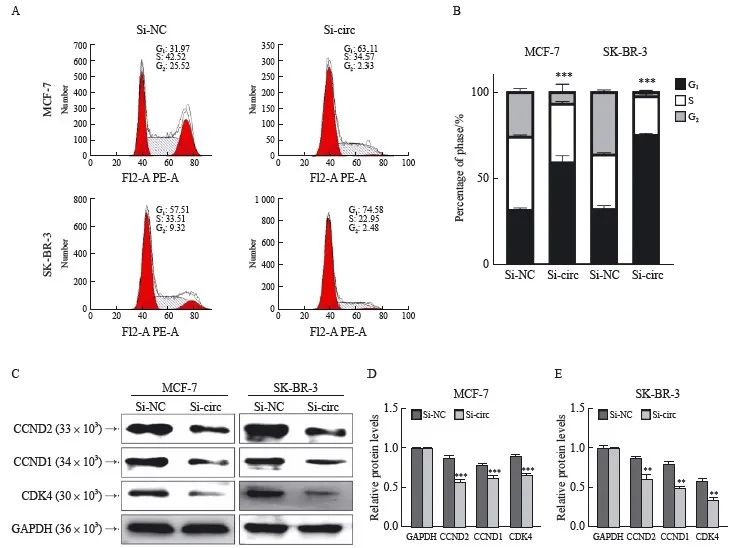
图7 下调hsa_circ_0001573对乳腺癌细胞周期的影响
Fig. 7 Effects of downregulation of hsa_circ_0001573 on the cell cycle of breast cancer cells
A, B: Flow cytometry; C, D: Western blot; ***:P<0.001, compared with si-NC; **:P<0.01, compared with si-NC.
2.7 敲低hsa_circ_0001573抑制移植瘤生长
为探究敲低hsa_circ_0001573后对体内肿瘤生长的影响,分别将两组稳定转染细胞株接种于裸鼠皮下,成功构建裸鼠移植瘤模型,发现si-circ组移植瘤体积明显小于si-NC组(P <0.001,图8A、B)。通过肿瘤生长曲线可以发现,si-circ组移植瘤生长速度明显比si-NC组的慢(P<0.01,图8C)。免疫组织化学检测结果显示,CCND2、CCND1和CDK4蛋白的表达在敲低hsa_ circ_0001573后明显降低(图8D)。

图8 敲低hsa_circ_0001573抑制移植瘤生长
Fig. 8 The growth of xenograft tumors was inhibited by silencing hsa_circ_0001573
A: Xenograft tumors; B: Tumor weight; C: Growth curves of the xenograft tumors; D: Immunohistochemistry (×400); ***: P<0.001, compared with si-NC; **:P<0.01, compared with si-NC.
2.8 hsa_circ_0001573与GNB4相互作用增强c-myc的表达
使用生物素标记的探针对MCF-7细胞中hsa_ circ_0001573的后剪接位点进行RNA下拉分析,然后进行银染和质谱分析,发现GNB4蛋白显著富集(图9A);FISH和IF共染色分析表明,hsa_circ_0001573和GNB4在乳腺癌细胞MCF-7中共存,为它们的相互作用提供了证据(图9B);成功构建GNB4的过表达质粒,对照质粒和干扰质粒后,在细胞中验证效率(P<0.01,图9C);通用RTFQ-PCR检测过表达和敲低GNB4后c-myc在RNA水平的相对表达量,结果显示,GNB4过表达时c-myc表达水平升高,而敲低GNB4时c-myc表达下降(P<0.01,图8D);通过Western blot检测相关蛋白的表达变化,结果显示,当敲低hsa_circ_0001573时,c-myc的蛋白水平显著下降,而过表达GNB4后能逆转c-myc的表达从而上调其表达水平(P<0.01,图9E、F)。

图9 hsa_circ_0001573与GNB4相互作用增强c-myc的表达
Fig. 9 Expression of c-myc was enhanced by the interaction of hsa_circ_0001573 with GNB4
A: RNA pull down; B: FISH-IF (×400); C: The efficiency after transfection with overexpressed GNB4 plasmid or sh-GNB4; D: Relative expression of c-myc after transfection with overexpressed GNB4 plasmid or sh-GNB4; E, F: Western blot; ***:P<0.001, compared with mock or sh-NC; **: P<0.01, compared with mock or sh-NC.
3
讨 论
乳腺癌是全世界女性人口发病率和死亡率最高的恶性肿瘤[2]。随着全球预期寿命的增加,乳腺癌的发病率和病死率可能会继续上升[11]。
CircRNA是一类共价闭环结构的非编码RNA,是由前体信使mRNA环化形成,多数存在于细胞质[12]。具有分布广泛、风度高和组织特异性强等特征,研究[13]表明,circRNA参与肺癌、肝癌及乳腺癌等多种肿瘤的发生与发展。CircRNA可与不同RNA结合的蛋白相互作用形成特定的RNA-蛋白质复合体,从而影响相关蛋白质的作用方式并促使肿瘤发生[14-15]。因此,研究异常表达的circRNA对乳腺癌进展影响的作用机制,为临床诊断、治疗新靶点及预后等提供理论依据依据具有重要意义。
本研究通过RNA微阵列芯片分析对4例乳腺癌组织和癌旁组织进行circRNA差异分析,发现hsa_circ_0001573在乳腺癌组织和细胞中差异表达最为明显,并采用RTFQ-PCR检测hsa_circ_0001573在35例乳腺癌组织和癌旁组织、正常人乳腺上皮细胞系MCF-10A、乳腺癌细胞系(MCF-7和SK-BR-3)中的相对表达量,结果显示,hsa_circ_0001573在乳腺癌组织和乳腺癌细胞中显著上调。此外,我们构建hsa_circ_0001573干扰质粒后转染至乳腺癌细胞中,通过一些列体外实验发现,敲低hsa_ circ_0001573后能显著抑制乳腺癌细胞增殖、迁移和侵袭,并诱导细胞凋亡。细胞周期蛋白D2(CCND2、CCND1)是两种重要的细胞周期调节因子,也是细胞周期蛋白D-CDK4复合物的关键成员,因此在多种癌症的发病机制中具有极其重要的意义[16]。Western blot和免疫组织化学检测结果显示,敲低hsa_circ_0001573后CCND2、CCND1和CDK4蛋白表达水平均显著下降,表明hsa_circ_0001573可通过影响细胞周期相关蛋白的表达,影响乳腺癌的发生、发展进程。研究[9]表明,GNB4的过度表达显著上调胃癌细胞中c-myc的表达水平,促进胃癌细胞的增殖和转移。本研究发现,GNB4可与hsa_circ_0001573相互作用增强c-myc的表达。
综上所述,本研究发现hsa_circ_0001573在乳腺癌组织和细胞中显著上调,敲低hsa_ circ_0001573后能抑制细胞增殖、侵袭和迁移,诱导细胞凋亡,hsa_circ_0001573能与GNB4相互作用增强c-myc的表达,说明其与乳腺癌的发生、发展有着密不可分的关系,有望成为乳腺癌治疗新靶标。但hsa_circ_0001573调控乳腺癌发生、发展的分子机制仍需深入研究。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33.
[2] BUTTI R, DAS S, GUNASEKARAN V P, et al. Receptor tyrosine kinases (RTKs) in breast cancer: signaling, therapeutic implications and challenges[J]. Mol Cancer, 2018, 17(1): 34.
[3] RAGAN C, GOODALL G J, SHIROKIKH N E, et al. Insights into the biogenesis and potential functions of exonic circular RNA[J]. Sci Rep, 2019, 9(1): 2048.
[4] MO D D, LI X P, RAABE C A, et al. A universal approach to investigate circRNA protein coding function[J]. Sci Rep, 2019, 9(1): 11684.
[5] GUO X Q, JIN W, CHANG C F, et al. Large-scale quantitative genomics analyzes the circRNA expression profile and identifies the key circRNA in regulating cell proliferation during the proliferation phase of rat LR[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 2957-2966.
[6] W A N G H L , X I A O Y , WU L , et al. Comprehensive circular RNA profiling reveals the regulatory role of the circRNA-000911/miR-449a pathway in breast carcinogenesis[J]. Int J Oncol, 2018, 52(3): 743-754.
[7] WANG X H, CHEN M H, FANG L. Hsa_circ_0068631 promotes breast cancer progression through c-Myc by binding to EIF4A3[J]. Mol Ther Nucleic Acids, 2021, 26: 122-134.
[8] WANG X S, XING L, YANG R, et al. The circACTN4 interacts with FUBP1 to promote tumorigenesis and progression of breast cancer by regulating the expression of proto-oncogene MYC[J]. Mol Cancer, 2021, 20(1): 91.
[9] WANG B, LI D P, RODRIGUEZ-JUAREZ R, et al. A suppressive role of guanine nucleotide-binding protein subunit beta-4 inhibited by DNA methylation in the growth of antiestrogen resistant breast cancer cells[J]. BMC Cancer, 2018, 18(1): 817.
[10] JI W F, ZHANG W W, WANG X, et al. C-myc regulates the sensitivity of breast cancer cells to palbociclib via c-myc/miR-29b-3p/CDK6 axis[J]. Cell Death Dis, 2020, 11(9): 760.
[11] POWER E J, CHIN M L, HAQ M M. Breast cancer incidence and risk reduction in the hispanic population[J]. Cureus, 2018, 10(2): e2235.
[12] WEI C R, WANG Y, LI X Q. The role of Hippo signal pathway in breast cancer metastasis[J]. Onco Targets Ther, 2018, 11: 2185-2193.
[13] LI X, YANG L, CHEN L L. The biogenesis, functions, and challenges of circular RNAs[J]. Mol Cell, 2018, 71(3): 428-442.
[14] CHENG D, WANG J, DONG Z G, et al. Cancer-related circular RNA: diverse biological functions[J]. Cancer Cell Int, 2021, 21(1): 11.
[15] LI J, GAO X Y, ZHANG Z Q, et al. CircCD44 plays oncogenic roles in triple-negative breast cancer by modulating the miR-502-5p/KRAS and IGF2BP2/Myc axes[J]. Mol Cancer, 2021, 20(1): 138.
[16] MONTALTO F I, DE AMICIS F. Cyclin D1 in cancer: a molecular connection for cell cycle control, adhesion and invasion in tumor and stroma[J]. Cells, 2020, 9(12): 2648.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言