PD-1用多久,能不能停药?PD-L1与PD-1有何不同?一文读懂!
2023-05-18 e药安全 网络 发表于上海
PD-1用多久,能不能停药?PD-L1与PD-1有何不同?一文读懂!
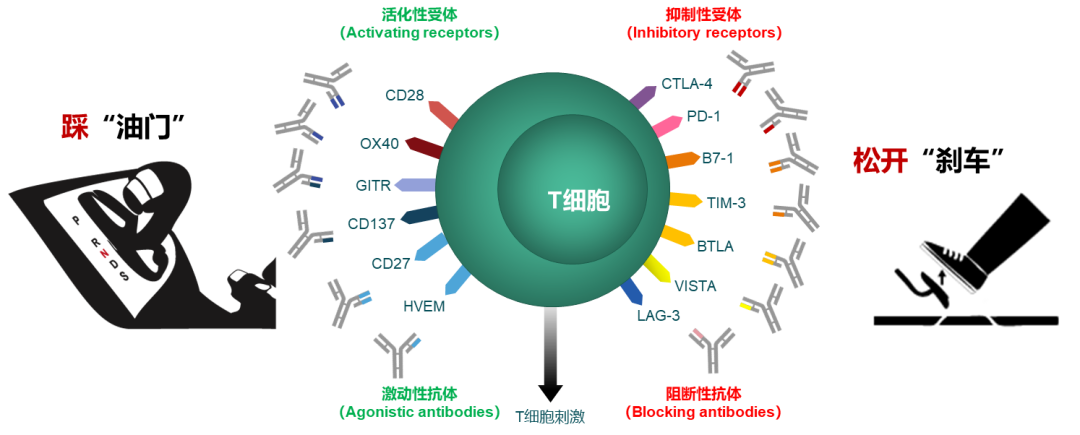

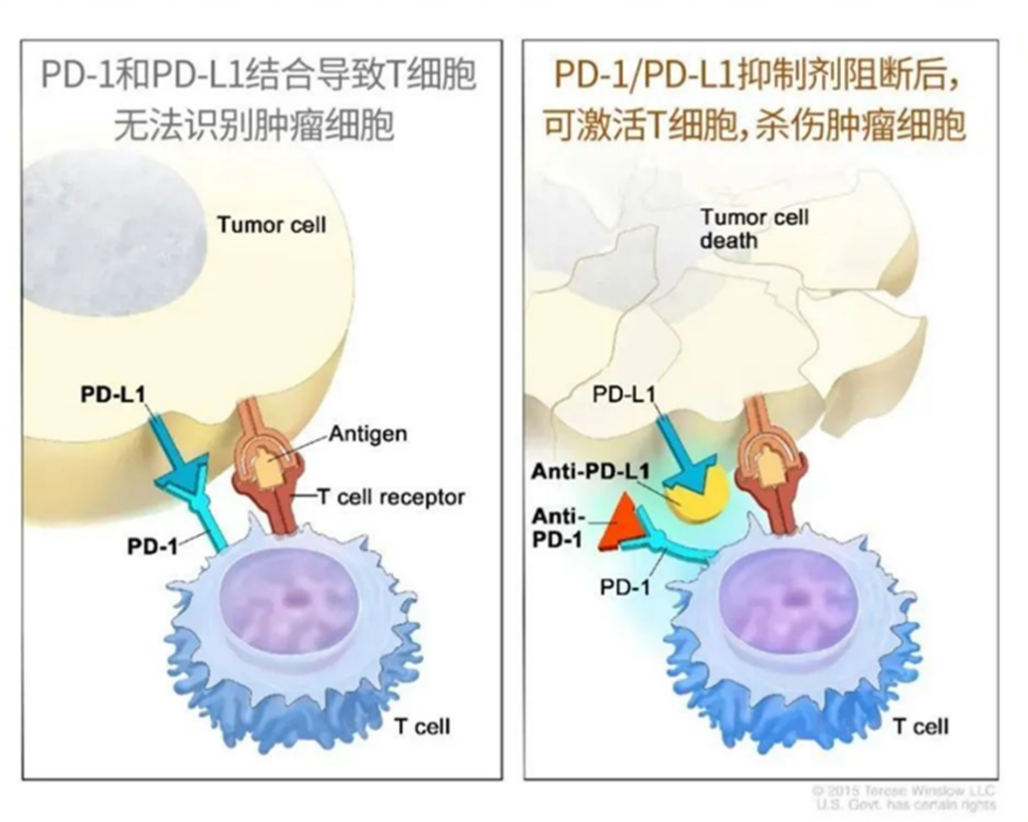
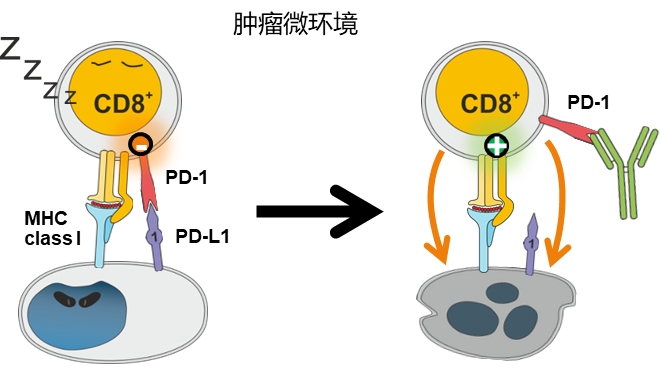
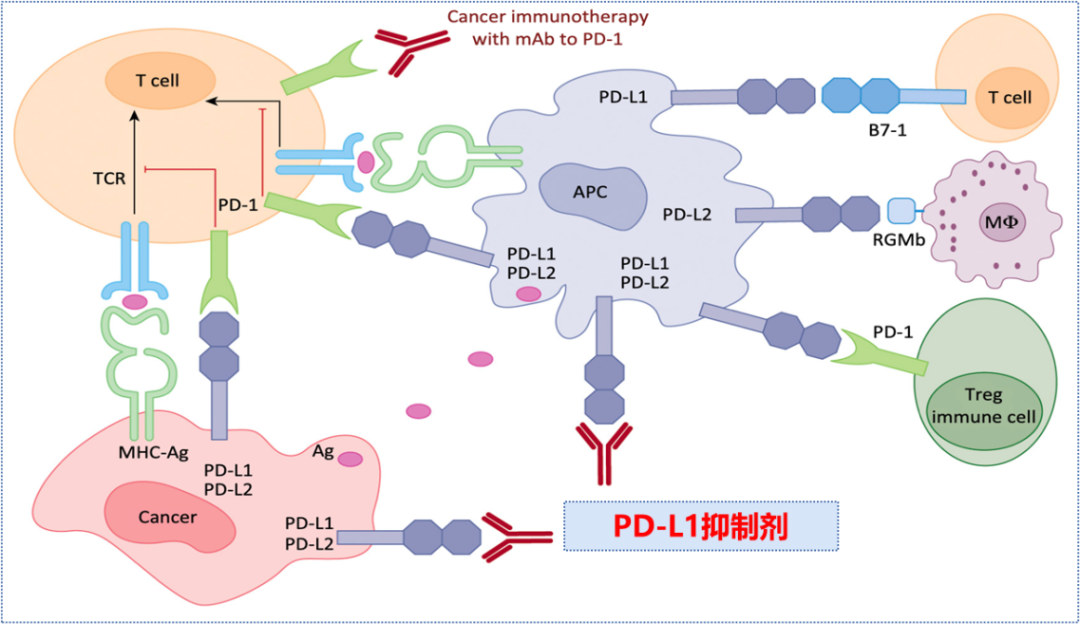
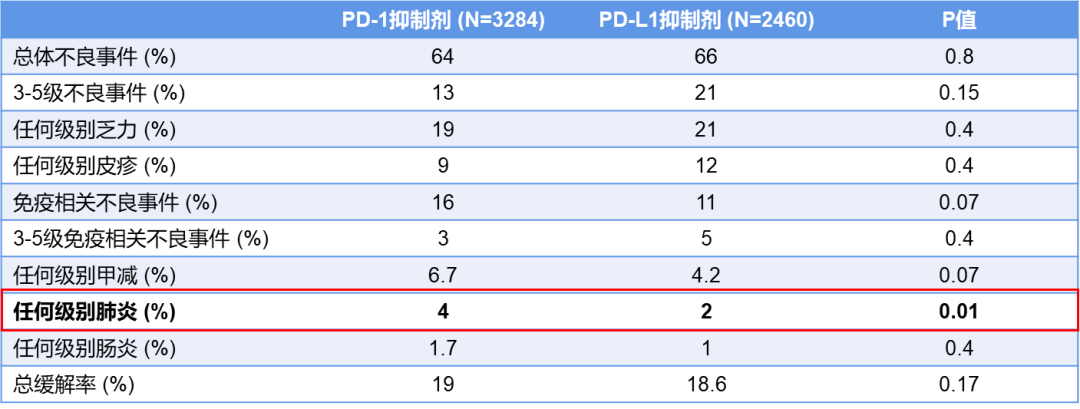
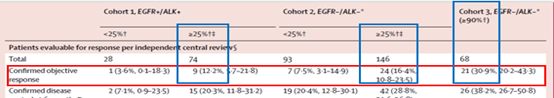
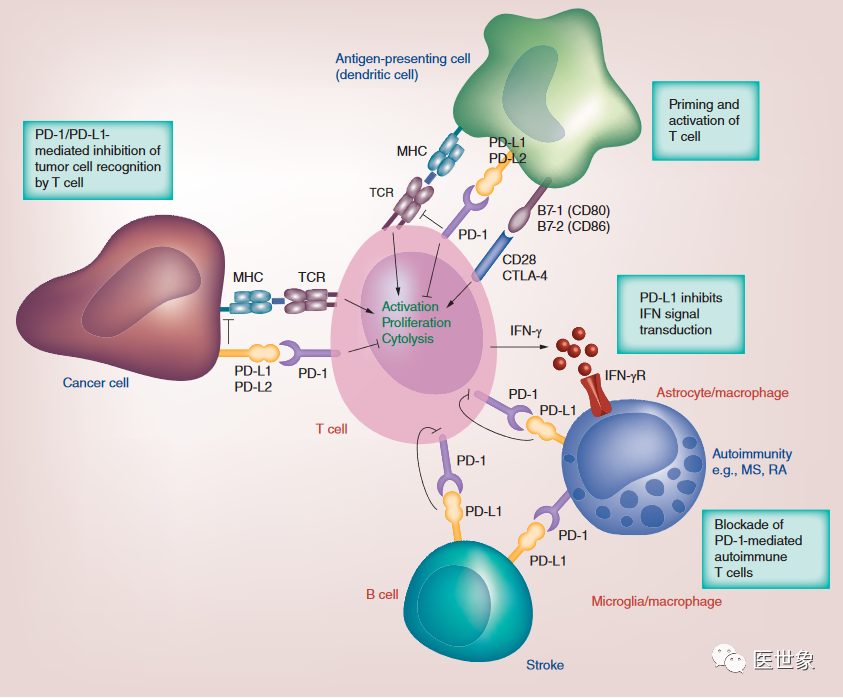
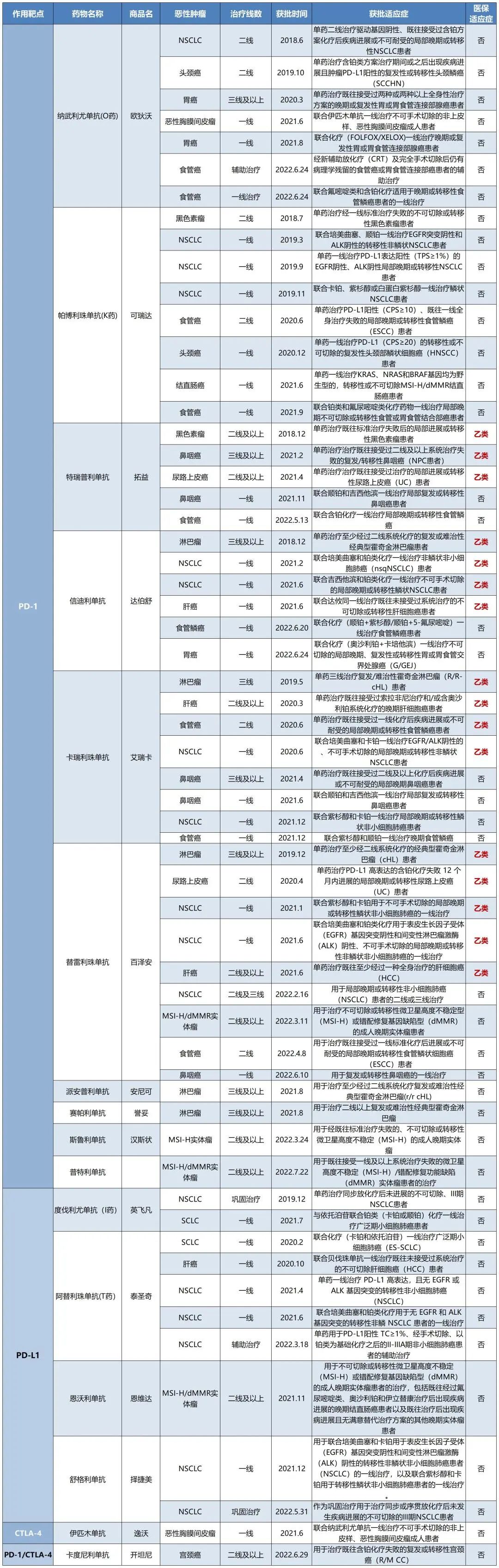
目前,国内共有16种PD-1/PD-L1等肿瘤免疫检查点抑制剂获批上市,适应症涵盖多种恶性肿瘤,大幅提升了患者的生存期。
具体适应症详见如下(建议收藏):
参考文献:
[1].Drew M. Pardoll. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer. 2012 Mar 22;12(4):252-64.
[2].Annika De Sousa Linhares, Claire Battin, Sabrina Jutz, et al. Therapeutic PD-L1 antibodies are more effective than PD-1 antibodies in blocking PD-1/PD-L1 signaling[J]. Sci Rep. 2019 Aug 7;9(1):11472.
[3].Jifeng Yu, Yongping Song, Wenzhi Tian. How to select IgG subclasses in developing anti-tumor therapeutic antibodies[J]. J Hematol Oncol. 2020 May 5;13(1):45.
[4].Kim C Ohaegbulam, Amer Assal, Eszter Lazar-Molnar, et al. Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J]. Trends Mol Med. 2015 Jan;21(1):24-33.
[5].Maud Mayoux, Andreas Roller, Vesna Pulko, et al. Dendritic cells dictate responses to PD-L1 blockade cancer immunotherapy[J]. Sci Transl Med. 2020 Mar 11;12(534):eaav7431.
推荐阅读
肺癌系列文章汇总
肺癌相关指南及专家共识大汇总

微信扫一扫
关注该公众号
使用小程序
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言