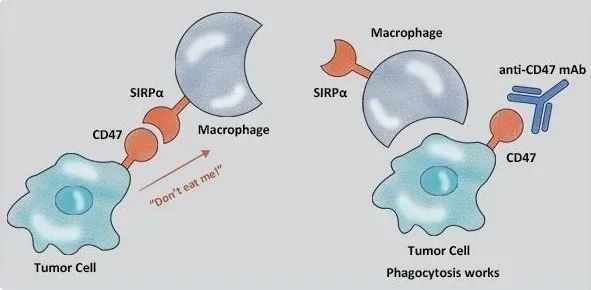
JMC:丁克团队报道靶向 AXL 的高效 PROTAC
2023-02-14 精准药物 精准药物 发表于上海
Anexelekto (AXL) 是一种受体酪氨酸激酶 (RTK),属于 TAM(TYRO3、AXL 和 c-Mer 原癌基因酪氨酸激酶 (MER))亚家族。
Anexelekto (AXL) 是一种受体酪氨酸激酶 (RTK),属于 TAM(TYRO3、AXL 和 c-Mer 原癌基因酪氨酸激酶 (MER))亚家族。TAM 家族成员有1个共同配体--生长抑制特异性蛋白6( Gas6) ,该配体能够与所有 TAM 受体酪氨酸激酶结合,其中 AXL 与 Gas6 的结合力是最强的,要比最弱的 Mer 强 3~10 倍。
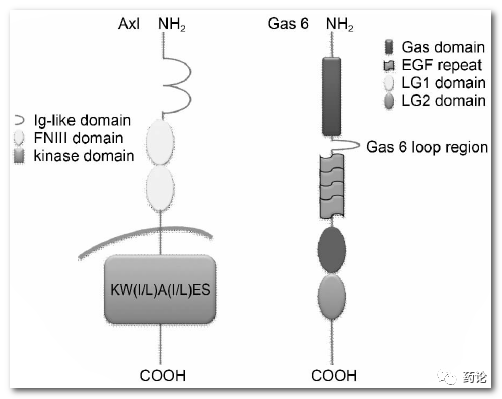
Axl 受体及其配体Gas6的结构(来源:参考1)
AXL 广泛表达于上皮、间质、造血细胞系中,在非小细胞肺癌、乳腺癌、卵巢癌等多种癌症中高表达,与肿瘤的发生、发展以及耐药密切相关,研究发现,AXL 的下调显示有效抑制 TNBC(三阴性乳腺癌) 细胞的迁移和侵袭。因此,AXL 是包括 TNBC 在内的人类癌症的有吸引力的治疗靶点。TNBC 对内分泌治疗及抗 HER-2 靶向治疗反应较差,与其他亚型的乳腺癌相比可选择治疗方案有限,同时由于其高转移性能,因此 TNBC 对临床治疗构成巨大的挑战。
多种选择性小分子 AXL 抑制剂已被报道,其中至少三种已进入临床试验阶段。尽管 AXL 小分子激酶抑制剂的开发进展较快,但最近的研究表明,AXL 的 N 末端远端区域比其 C 末端激酶结构域在细胞侵袭中起着更重要的作用,表明该激酶的非催化功能参与了癌症进展,该结论与 siRNA 敲除 AXL 导致比 AXL 抑制剂更显著抑制细胞侵袭现象互相印证。同时有报道发现 AXL 激酶抑制剂对 AXL 活性的抑制会通过相关机制街道最终导致疾病的抗性和复发。因此,可以推测,通过消除 AXL 的催化和非催化功能并避开由AXL 激酶抑制剂引起的 feedback loops 的新型药物能够实现更高的抗癌效力。
蛋白降解靶向嵌合体( proteolytic targeting chimera,PROTAC) 是药物研发领域的一个新兴方向,很多无法用小分子调控或抗体无法到达的靶点可以采用 PROTAC 技术进行调控。PROTAC结构中含有两种不同配体,一个是E3 泛素连接酶的配体,另一个是与细胞中目标靶蛋白结合的配体,两个配体之间通过 Linker 相连,从而形成“三体”聚合物--靶蛋白配体-Linker-E3 配体。
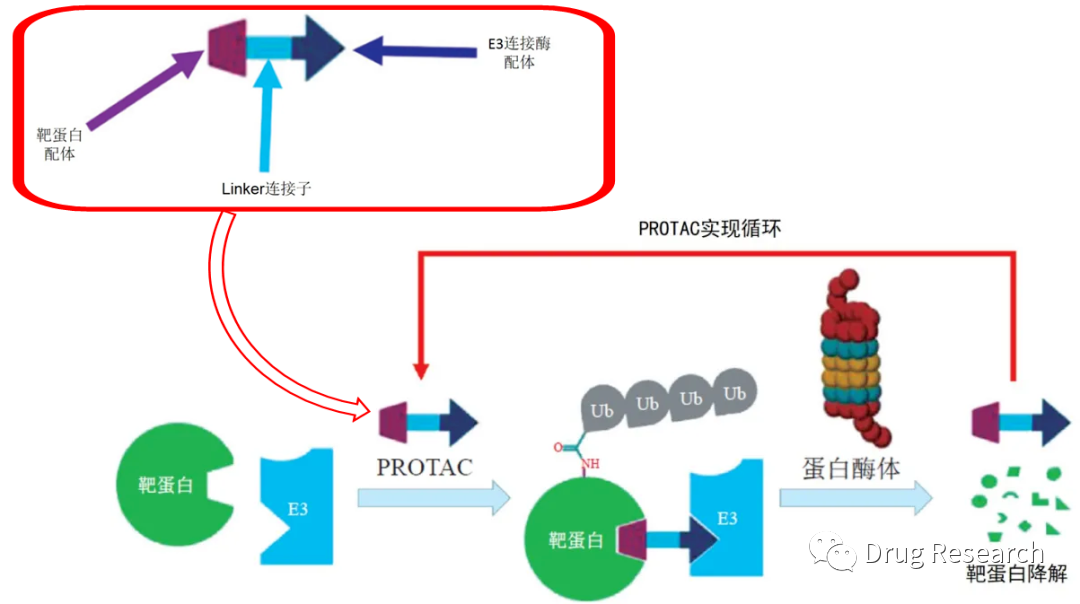
PROTAC结构组成及其作用原理(来源:文献2,已做修改)
PROTAC 可以在细胞中与 E3 泛素连接酶和靶蛋白结合,并形成三元复合物:靶蛋白-PROTAC-E3泛素连接酶,从而导致靶蛋白的多聚泛素化并随后被 26S 蛋白酶体识别并降解。在引发靶蛋白泛素化之后,PROTAC 可从复合物中解离,并参与下一轮的催化循环。
PROTAC 以催化和事件驱动模式发挥作用,可导致激酶的持续抑制和耗竭,并规避激酶抑制剂占用引起的 feedback loops。2023年 1 月 25 日由暨南大学丁克团队发表在 JMC 上的文章就报道了基于9im(4)(该团队一种临床研究中的分子 HH30134 的类似物)的新型高效 AXL 蛋白降解剂的发现。

研究团队之前已经设计并合成了一系列高效的 AXL 抑制剂,代表性化合物之一 4,以4.0 nM 的 IC50 值表现出较强的激酶抑制作用且激酶选择性好。因此,化合物 4 被选为新 PROTAC 设计的AXL binder。
鉴于无活性 AXL 激酶的晶体结构尚未被解析,选择与 AXL 具有 63% 序列同一性的DFG-out MER (PDB ID: 7AW1)的晶体结构来构建 AXL DFG-out 模型。分子模型研究表明化合物 4 的 7-甲氧基朝向溶剂暴露区域,表明该位点可用于 E3 连接酶配体链接而不影响 AXL 结合亲和力。对于 E3 连接酶配体,探索了广泛使用的 Von Hippel-Lindau (VHL) 和 CRBN 配体。通过在 MDA-MB-231 细胞中进行免疫印迹分析评估新 AXL PROTAC 的降解效率。

基于化合物 4 的 AXL PROTAC 设计(来源:文献3)
最终 6n 被发现是一种高效的 AXL PROTAC,在 MDA-MB-231 TNBC 细胞中表现出个位数的 nM DC50 值。降解剂 6n 对表达 AXL 的 TNBC 细胞的 AXL 信号转导、增殖、迁移和侵袭表现出明显优于相应激酶抑制剂 4 的抑制活性。
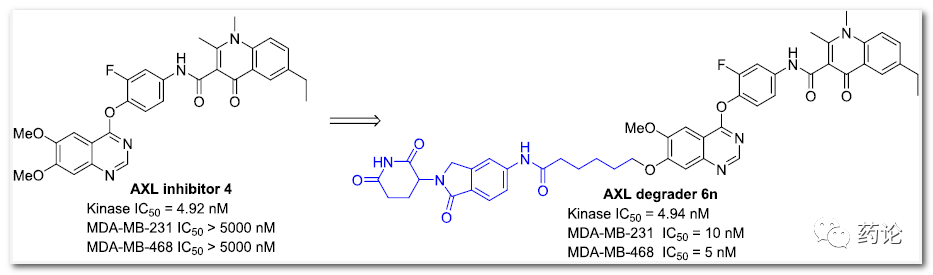
AXL抑制剂4和降解剂6n结构式(来源:文献3)
化合物 6n 还在 MDA-MB-231 细胞的异种移植小鼠模型中显示出有优良的体内抗肿瘤功效,并对四种具有高水平 AXL 激酶的 TNBC 患者来源的类器官的增殖表现出强烈的抑制作用。

降解剂 6n 对患者来源的 TNBC 类器官的抑制作用(来源:文献3)
这项研究可能提供第一个“proof-of-concept”investigation,以支持与激酶抑制剂治疗相比,AXL 的降解将是治疗 TNBC 的更好策略。
参考:
1.吴彦君,孙明明,习宁.Axl激酶抑制剂的研究进展[J].中国新药杂志,2016,25(11):1225-1235.
2.曾申昕,黄文海,沈正荣. 蛋白降解靶向嵌合体在小分子药物研发中的机遇与挑战[J]. 药学进展,2020,44(11):801-816.
3.https://doi.org/10.1021/acs.jmedchem.2c01682
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言