胰腺导管腺癌检出KRAS突变有什么预后意义?不同亚型的OS存在差异
2024-03-06 苏州绘真医学 苏州绘真医学 发表于上海
本研究阐明了KRAS突变的共突变图谱以及我中心胰腺癌KRAS突变与临床结局的突变亚型特异性相关性。
KRAS突变与胰腺癌(PDAC)临床结局的相关性尚无定论。MD安德森癌症中心对803例PDAC患者(42%为转移性疾病)进行了一项回顾性研究。总生存期(OS)分析表明,KRAS突变状态和突变亚型是预后因素(p < 0.001)。与KRAS野生型肿瘤患者(中位OS为38个月)相比,KRAS G12R患者的OS相似(中位34个月),KRAS Q61和KRAS G12D突变患者的OS较短(分别为中位20个月[HR:1.9,95% CI 1.2-3.0,p = 0.006]和22个月[HR:1.7,95% CI 1.3-2.3,p <0.001])。KRAS G12D突变在转移性肿瘤中富集(34% vs 24%,OR:1.7,95% CI 1.2–2.4,p = 0.001),KRAS G12R在高分化和中分化肿瘤中富集(14% vs 9%,OR:1.7,95% CI 1.05–2.99,p = 0.04)。在外部验证队列(PanCAN的Know Your Tumor®数据集,n = 408)中也观察到类似的发现。
研究背景
预计到 2040 年,胰腺导管腺癌(PDAC)将成为美国癌症死亡的第二大原因。转移性PDAC的可及治疗选择有限,5年生存率<5%。在转移性疾病的一线治疗中,当前标准化疗(奥沙利铂、伊立替康、氟尿嘧啶和亚叶酸钙 [FOLFIRINOX])的中位总生存期(OS)为 11.1 个月,客观缓解率(ORR)为 31.6%,中位无进展生存期(PFS)为 6.4 个月。另一种可及的一线化疗方案吉西他滨/白蛋白结合型紫杉醇的中位 OS 为 8.5 个月,ORR 为 23%,中位 PFS 为 5.5 个月。在二线治疗中,化疗(脂质体伊立替康、氟尿嘧啶和亚叶酸钙)的中位 OS 仅为 6.1 个月,ORR 为 16%,中位 PFS 为 3.1 个月。迫切需要更好的PDAC疗法。
在已识别的 PDAC 基因变异(GA)中,致癌性 KRAS 突变最常见,发生于近 90% 的患者,其次是 TP53、CDKN2A 和 SMAD4。大多数KRAS突变位于密码子12,其中G12D突变最常见(35%),其次是G12V(20-30%)、G12R(10-20%)、Q61(~5%)、G12C(1-2%)和其他罕见突变。几十年来,靶向KRAS一直具有挑战性,直到发现变构KRAS G12C突变特异性抑制剂,通过与switch-II区域下方的突变半胱氨酸共价结合,将其锁定在无活性的GDP结合形式中。KRAS G12C抑制剂索托雷塞(AMG510)和阿达格拉西布(MRTX849)临床试验报告了令人振奋的结果,两种药物均已获得美国FDA批准,用于经治KRAS G12C突变晚期肺癌。此外,还观察到索托雷塞和阿达格拉西布对 PDAC 的疗效。在既往接受过化疗的胰腺癌患者中,索托雷塞的ORR为21%,中位PFS为4.0个月。在化疗难治性胰腺癌患者(n=21)中,阿达格拉西布单药治疗的ORR为33.3%,中位PFS为5.4个月(95% CI 3.9-8.2),中位OS为8.0个月(95% CI 5.2-11.8)。此外,KRAS G12D抑制剂(MRTX 1133)的临床前开发已显示出有希望的结果,MRTX 1133目前正处于1期临床试验。最近,泛KRAS抑制剂RMC-6236也在患者中进行了测试(NCT05379985),该抑制剂与伴侣蛋白亲环蛋白A和活性GTP结合的RAS结合(RAS ON抑制剂)。最后,使用靶向KRAS G12D的 T 细胞受体(TCR)的 T 细胞疗法导致胰腺癌患者肿瘤消退,靶向其他 KRAS 突变(如KRAS G12V)的 TCR 的 T 细胞正在开发中。
我们在尝试靶向胰腺癌KRAS方面正处于突破点。其余的挑战包括缓解持续时间短和对KRAS抑制剂的原发性/继发性耐药性。此外,虽然多种基因组和非基因组因素与对KRAS抑制剂的耐药性有关,例如在肺癌患者中观察到的KEAP1/STK11与KRAS共突变,KEAP1/STK11共突变在胰腺癌中很少见,对胰腺癌KRAS突变和共突变图谱以及其对临床结局的影响知之甚少。
KRAS突变癌症存在异质性,具有不同的突变亚型和共突变。每种KRAS突变亚型都具有独特的生化和临床病理学特征,胰腺癌中突变亚型和共突变的差异尚未得到很好的研究。KRAS G12D突变具有内在的野生型和 SOS1 鸟嘌呤交换活性,而 KRAS Q61 突变在 GTP 水解方面存在缺陷。KRAS G12R突变约占胰腺癌中 KRAS 突变的 15%,占肺癌中 KRAS 突变的不到 1%,据报道,与其他 KRAS 突变相比,与不同的下游信号通路相关。研究显示,KRAS G12D突变具有较强的免疫抑制作用,与肺癌和胰腺癌生存期较短相关。此外,在肺癌患者中,最常与KRAS共突变的基因因KRAS突变亚型而异,并且这些不同的KRAS共突变模式对临床结局的影响不同。例如,KRAS G13 突变肺癌患者的KEAP1/STK11 共突变率高于 KRAS G12D 突变肺癌患者,并且 KEAP1/STK11 与 KRAS G13 共突变与不良预后和治疗耐药性相关。
目前,关于KRAS突变亚型和共突变对PDAC临床结局影响的研究有限,结论仍存在争议。一项单中心研究显示,与KRAS G12R突变PDAC相比,KRAS G12D突变PDAC与较差的OS相关(n=126);在KRAS G12R突变PDAC中,PI3K通路共突变的患者OS较差。同时,另一项研究发现,不同KRAS突变亚型之间的OS没有统计学上的显著差异。本研究阐明了KRAS突变的共突变图谱以及我中心胰腺癌KRAS突变与临床结局的突变亚型特异性相关性。此外,在胰腺癌行动网络(PanCAN)的Know Your Tumor®(KYT)数据集的外部队列中验证了我们的研究结果。
研究结果
患者特征
识别了 803 例在 MD 安德森癌症中心进行肿瘤组织体细胞突变检测的 PDAC 患者(图1)。表1总结了该队列的人口统计学和临床特征。中位年龄为63岁(范围26-86),43%为女性,29.3%有吸烟史(当前或以前)。336 例(42%)患者在初始诊断时记录了 IV 期疾病,321 例(40%)患有低分化肿瘤。703 例患者检测了 KRAS 基因突变状态,其中 302 例为 IV 期疾病,578 例患者(82%)KRAS突变阳性。除KRAS外,604例患者检测了TP53,418例(69%)阳性;509例患者检测了CDKN2A,102例(20%)阳性;536 例患者检测了SMAD4,68 例(13%)阳性。从初始诊断开始的中位随访时间为41个月。整个队列 803 例患者的中位 OS 为 19 个月(范围 0.07-348)。
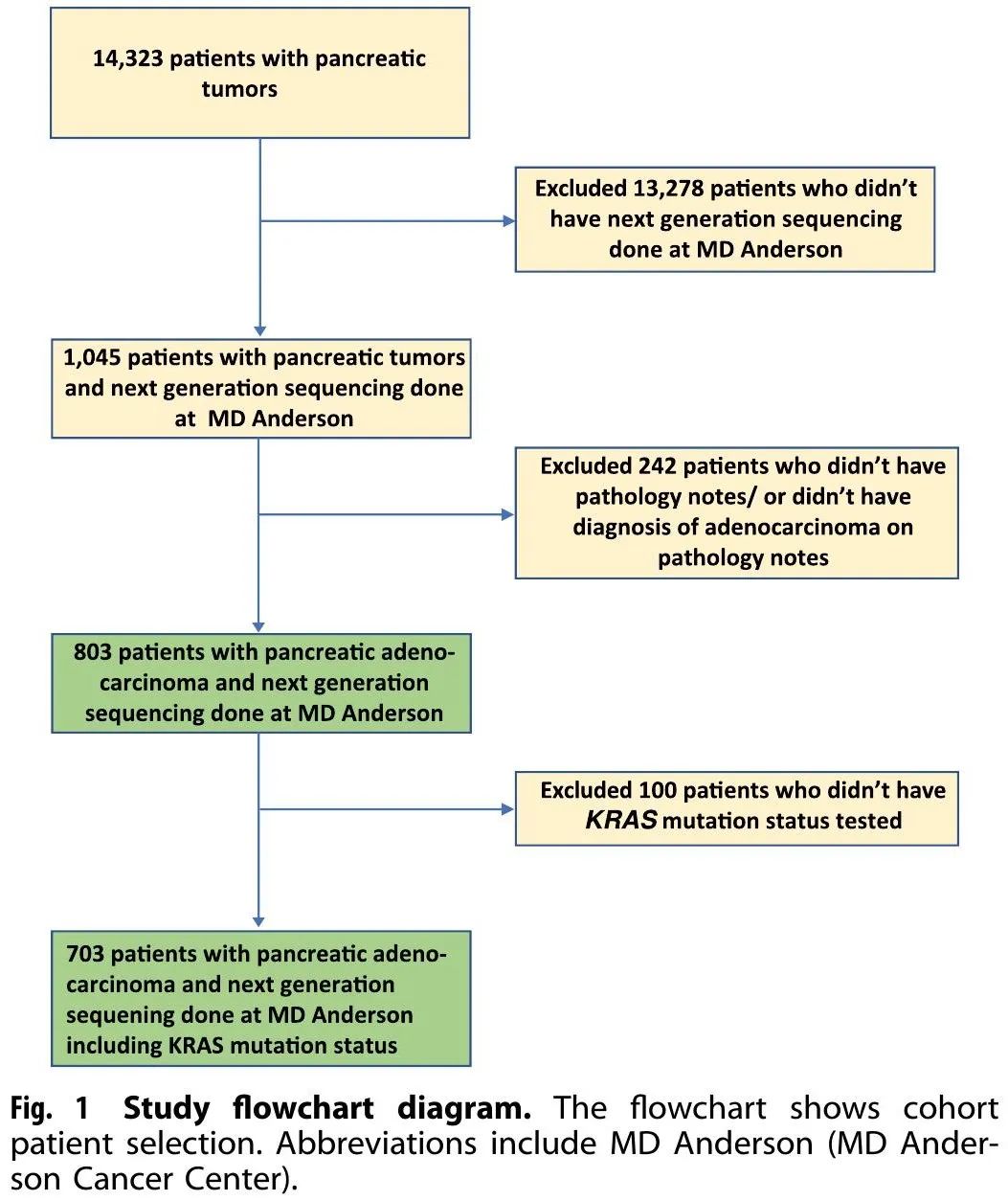
图1

表1
KRAS突变状态和亚型与OS的相关性
在 578 例 KRAS 突变阳性患者中,227 例为 KRAS G12D(39%),182 例为 KRAS G12V(31%),81 例为 KRAS G12R(14%),35 例为KRAS Q61(6%),53 例为其他罕见 KRAS 变异(9%)(图2d)。对所有 703 例已知 KRAS 突变状态(包括所有分期)的患者进行 OS Kaplan-Meier(KM)分析,结果表明 KRAS 突变状态和突变亚型是影响 OS 的预后因素(p < 0.001)(图2a);KRAS野生型肿瘤患者的中位OS为38个月,KRAS G12R肿瘤患者的中位OS为34个月(HR:1,95% CI 0.71-1.5,p = 0.88),KRAS Q61肿瘤患者的中位OS为20个月(HR:1.9,95% CI 1.2-3.0,p=0.006),KRAS G12D肿瘤患者的中位OS为22个月(HR:1.7,95% CI 1.3–2.3,p < 0.001)(图2c)。当仅限于IV期转移性疾病患者(n = 302)时,KRAS突变仍然与OS显著相关(p = 0.034)(图2b)。同样,KRAS Q61 和 KRAS G12D 突变患者的中位 OS(分别为 15 个月和 11 个月)短于 KRAS G12R 突变和 KRAS 野生型肿瘤患者(中位 OS 分别为 25 个月和 24 个月)。与 KRAS 野生型肿瘤相比,KRAS G12D突变肿瘤与显著较差的OS相关(HR = 1.7,95% CI 1.1–2.6,p = 0.009) 。
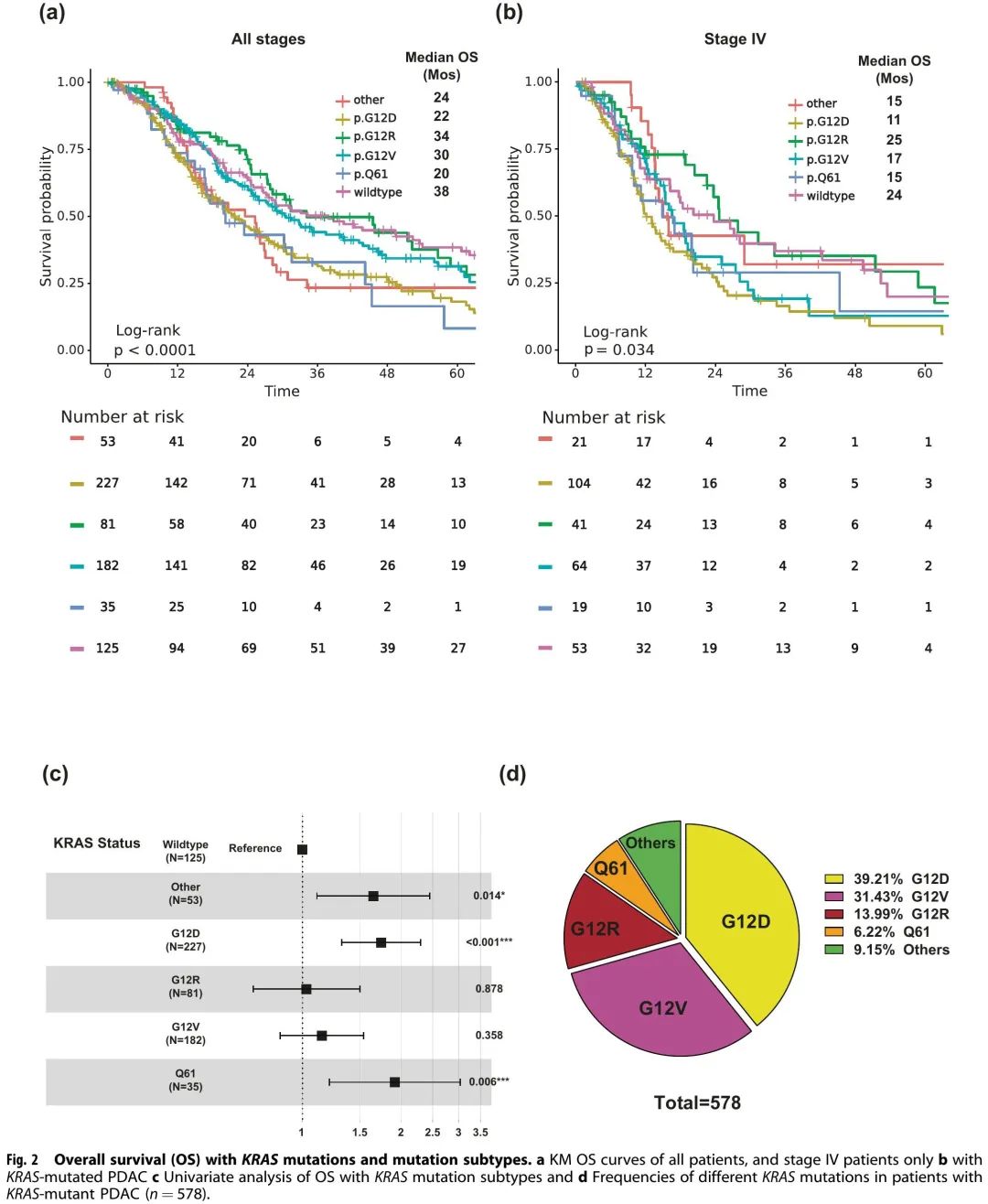
图2
KRAS突变亚型与分期和肿瘤分化的相关性
晚期疾病分期与较短的OS相关(p < 0.001)。IV 期 PDAC 患者的中位 OS 为 16 个月(HR:3.3,95% CI 2.4–4.4),I 期 PDAC 患者的中位 OS 为 48 个月(图3a)。在已知KRAS突变状态的完整队列中(包括所有分期),肿瘤组织病理学也是影响OS的预后因素(p < 0.001);低分化/间变性肿瘤患者的OS(中位OS = 21个月;HR:2.3,95% CI 1.4-3.9)短于高分化肿瘤患者(中位 OS = 62 个月)(图3b)。我们还发现,转移性疾病(IV期)患者的KRAS G12D突变发生率高于局限性疾病(I-III期)患者(34% vs. 24%,OR:1.7,95% CI:1.2–2.4,p = 0.001)(图3c),高分化和中分化肿瘤的KRAS G12R突变发生率高于低分化/间变性肿瘤(14% vs. 9%,OR:1.7,95% CI:1.05–2.99,p = 0.04)(图3d)。
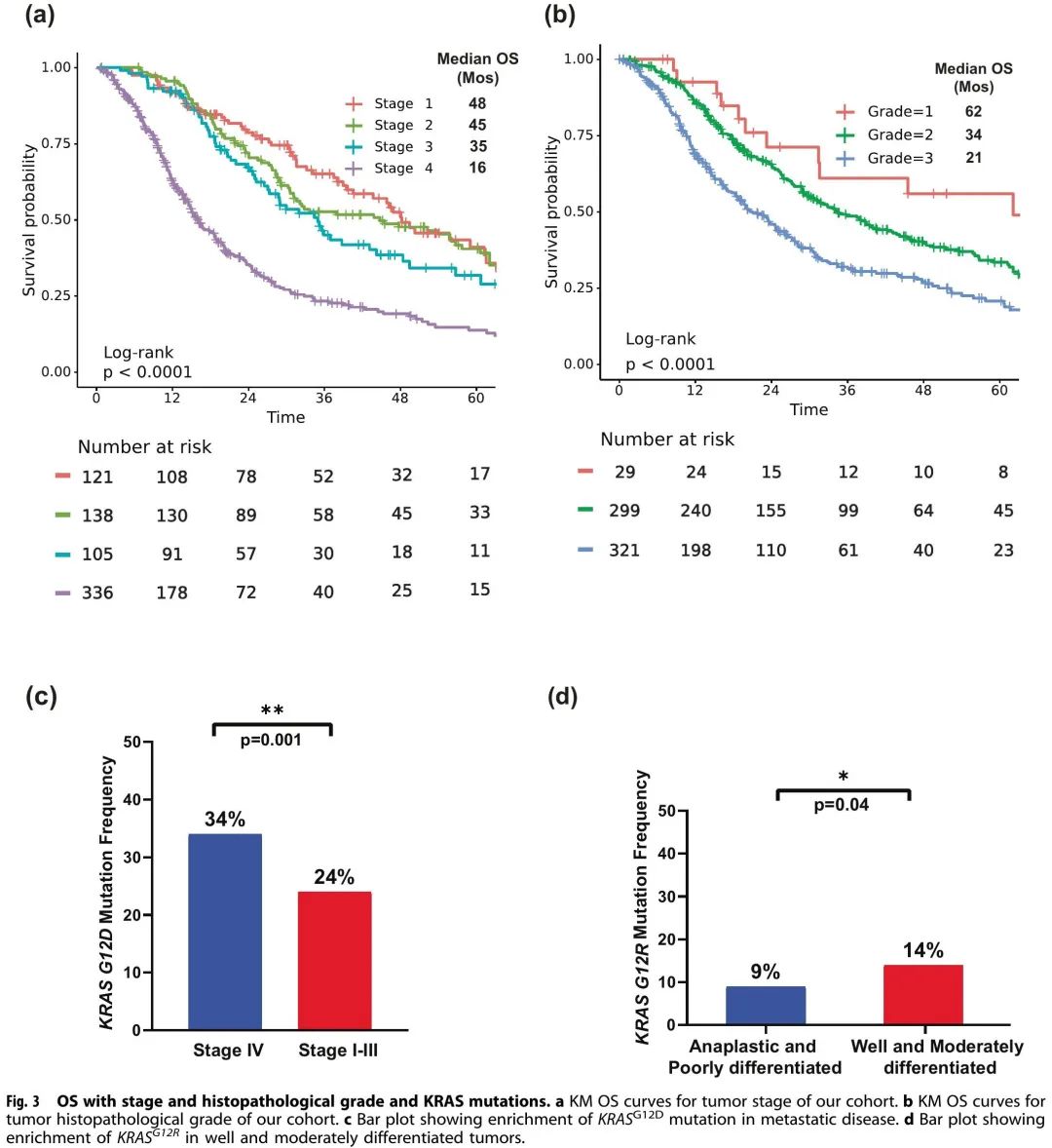
图3
KRAS共突变与OS
将GA按照阳性率高低进行排序(每个基因的检测患者数量因检测panel不同存在差异)(图4a)。KRAS(82%,N = 578/703)、TP53(69%,N = 418/608)、CDKN2A(20%,N = 102/509)、SMAD4(13%,N = 68/536)和 ARID1A(7%,N = 34/482)是 MD 安德森队列中突变频率最高的基因(图4c)。TP53 最常与 KRAS 共突变,TP53 共阳性率为 67%,其次是 CDKN2A(17%)、SMAD4(11%)和 ARID1A(6%)(图4b)。共突变分析显示,KRAS经常与TP53(OR:1.77,95% CI 0.85-3.6,错误发现率(FDR)校正p = 0.29)和CDKN2A(OR:2.05,95% CI 0.71-8.13,FDR校正p = 0.47)共突变。有趣的是,KRAS和GNAS是相互排斥的(OR:0.23,95% CI 0.07-1.05,FDR校正p = 0.14),而TP53和ATM是相互排斥的(OR:0.31,95% CI 0.12-0.81,FDR校正p = 0.095)(图5a)。此外,TP53 和 CDKN2A 经常共突变(OR:2.11,95% CI 1.17–4.04,FDR 校正 p = 0.095)。ARID1A 与 CDKN2A(OR:2.7,95% CI 1.18–6.02,FDR 校正 p = 0.095)和 SMARCA4(OR:5.17,95% CI 1.15–8.44,FDR 校正 p = 0.1)显著共突变。
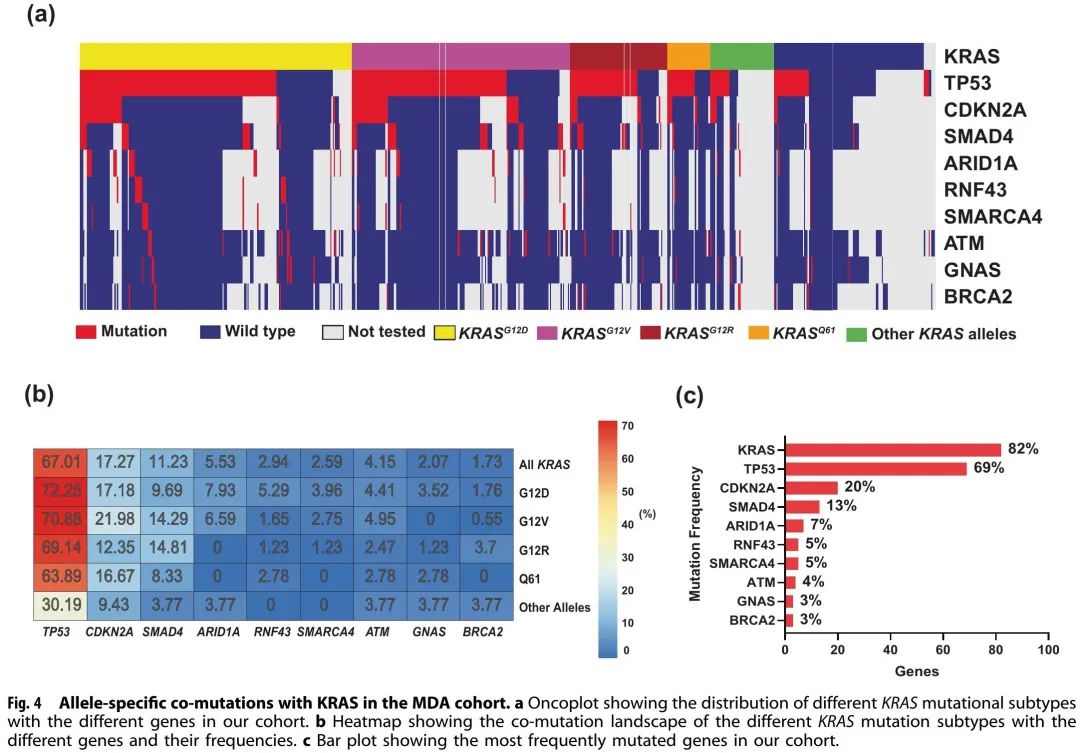
图4
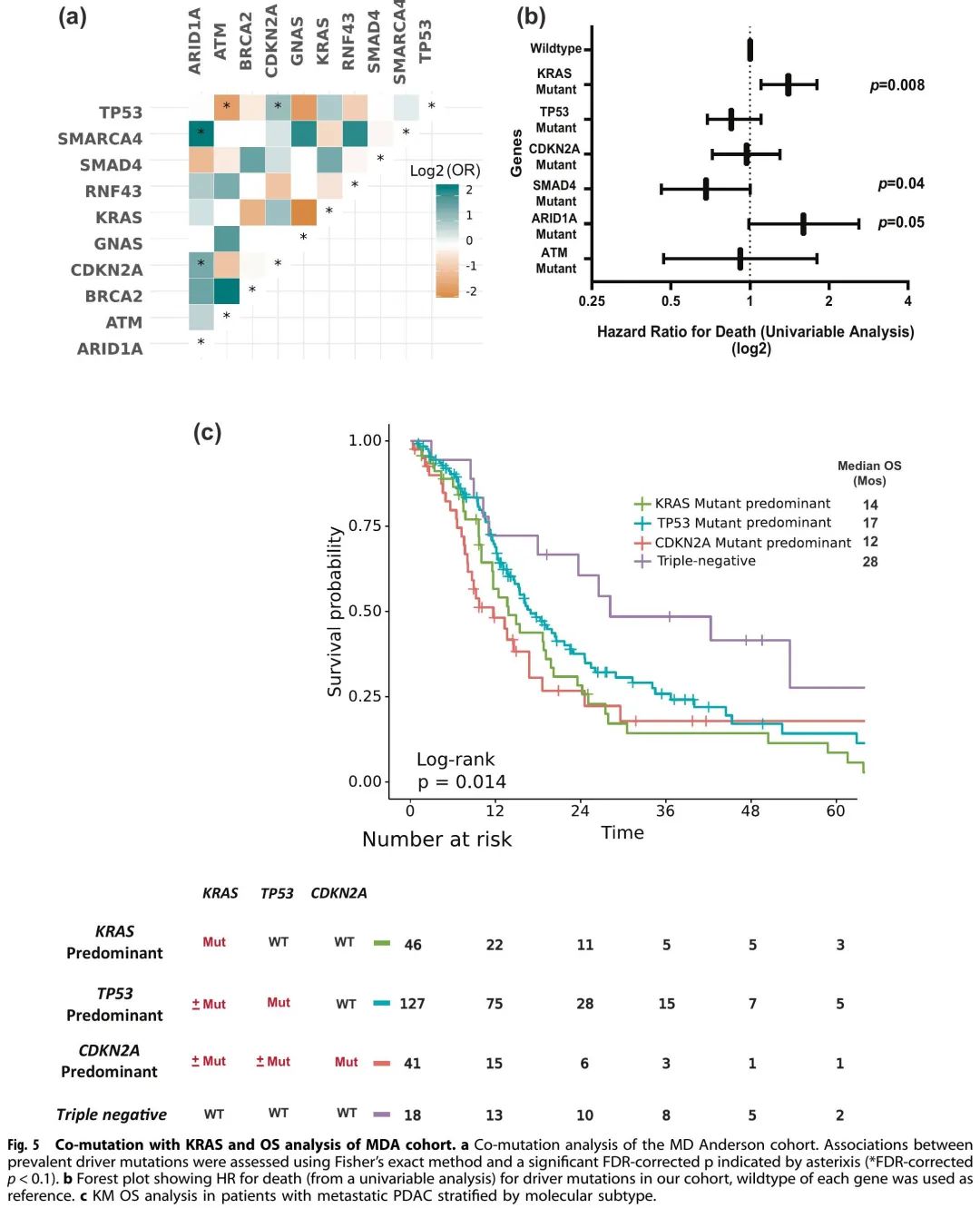
图5
MD安德森队列突变频率最高基因的单因素Cox比例风险分析显示,ARID1A突变与较差的OS相关,ARID1A突变肿瘤患者的中位OS为18个月,ARID1A野生型肿瘤患者的中位OS为31个月(HR:1.6,95% CI 0.99-2.6,p = 0.05)。而SMAD4突变肿瘤的OS优于SMAD4野生型肿瘤(中位OS分别为35个月和27个月,HR:0.67,95% CI 0.46–0.99,p = 0.046)(图5b)。有趣的是,没有KRAS G12R突变肿瘤患者存在ARID1A共突变,而8%的KRAS G12D突变肿瘤患者存在ARID1A共突变(p = 0.02)。相反,SMAD4 共突变见于 15% 的 KRAS G12R 突变肿瘤患者和 10% 的 KRAS G12D 突变肿瘤患者(p = 0.22)(图4b)。
对于已知 KRAS、TP53 和 CDKN2A 突变状态的转移性疾病患者(n = 232),我们分为四种不同的转移性 PDAC 分子亚型(图5c):(1)KRAS 突变为主(KRAS 突变,TP53 野生型/CDKN2A 野生型)(n = 46/232),(2)TP53 突变为主(TP53 突变,KRAS 突变或野生型/CDKN2A 野生型)(n = 127/232),(3)CDKN2A 突变为主(CDKN2A 突变,KRAS突变或野生型/TP53突变或野生型)(n = 41/232)和(4)三阴性(KRAS、TP53和CDKN2A均野生型)(n = 18/232)。三阴性组(KRAS-/TP53-/CDKN2A-)的中位OS最长(28个月),CDKN2A为主组的OS最短(中位12个月);TP53 为主组(中位 17 个月)和 KRAS 为主组(中位 14 个月)的 OS 中等(p = 0.014)(图5c)。
PanCAN KYT数据集
为了验证我们的发现,分析了外部PanCAN KYT数据集队列(n = 408)。表2总结了KYT队列患者的基线特征。诊断时的中位年龄为 65 岁(范围 36-88)。46%为女性,54%为男性。诊断后的中位随访时间为15个月。该队列中大多数患者(59.8%)疾病分期信息不可及;在已知分期的患者中,23.8%(n = 97)诊断时记录了 IV 期疾病。所有患者的中位OS为22个月(范围为0.2-93个月)。KRAS(92%)、TP53(77%)、SMAD4(24%)、CDKN2A(21%)和ARID1A(5%)是PanCAN队列中突变频率最高的基因(图6a)。
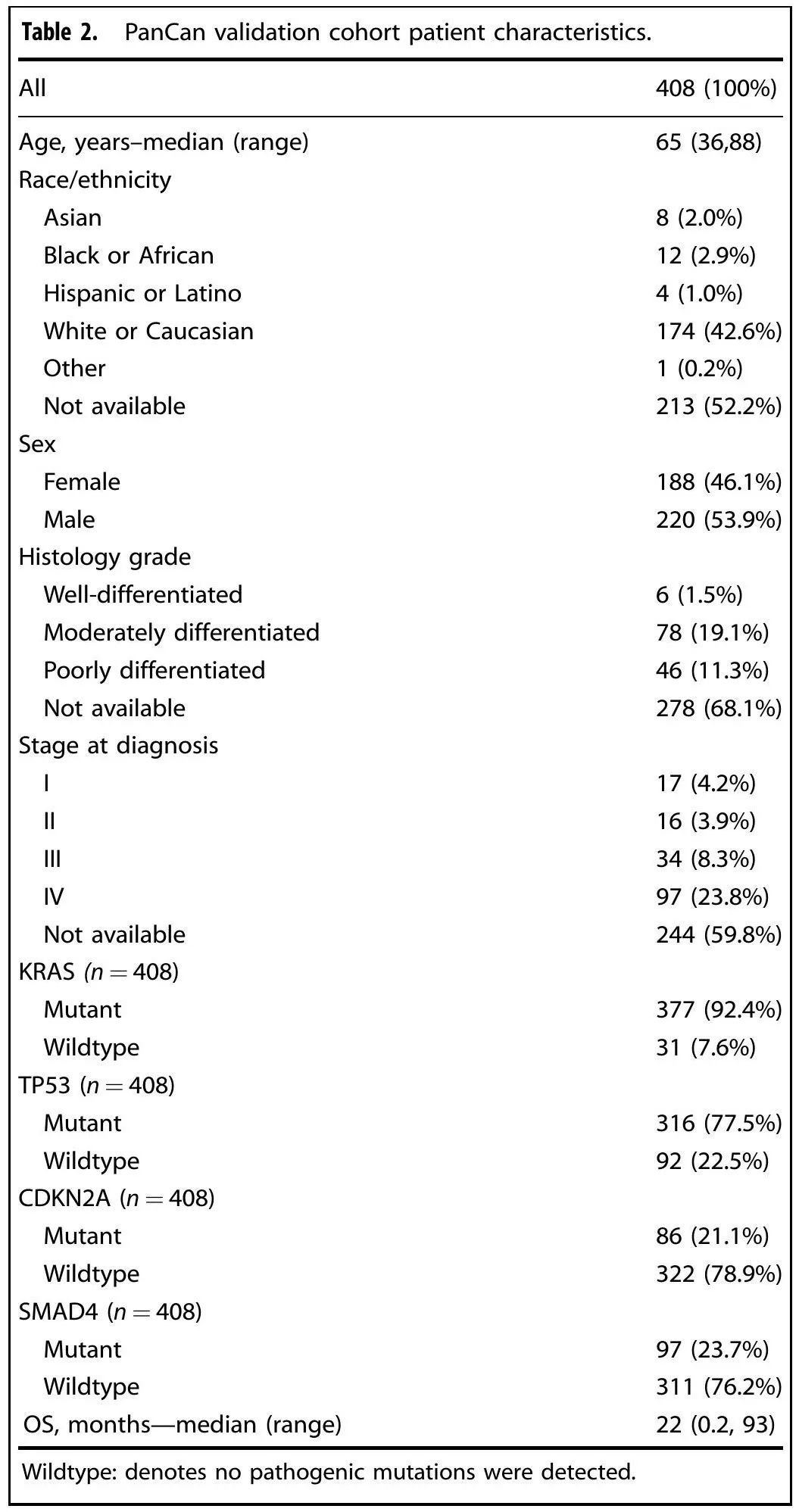
表2
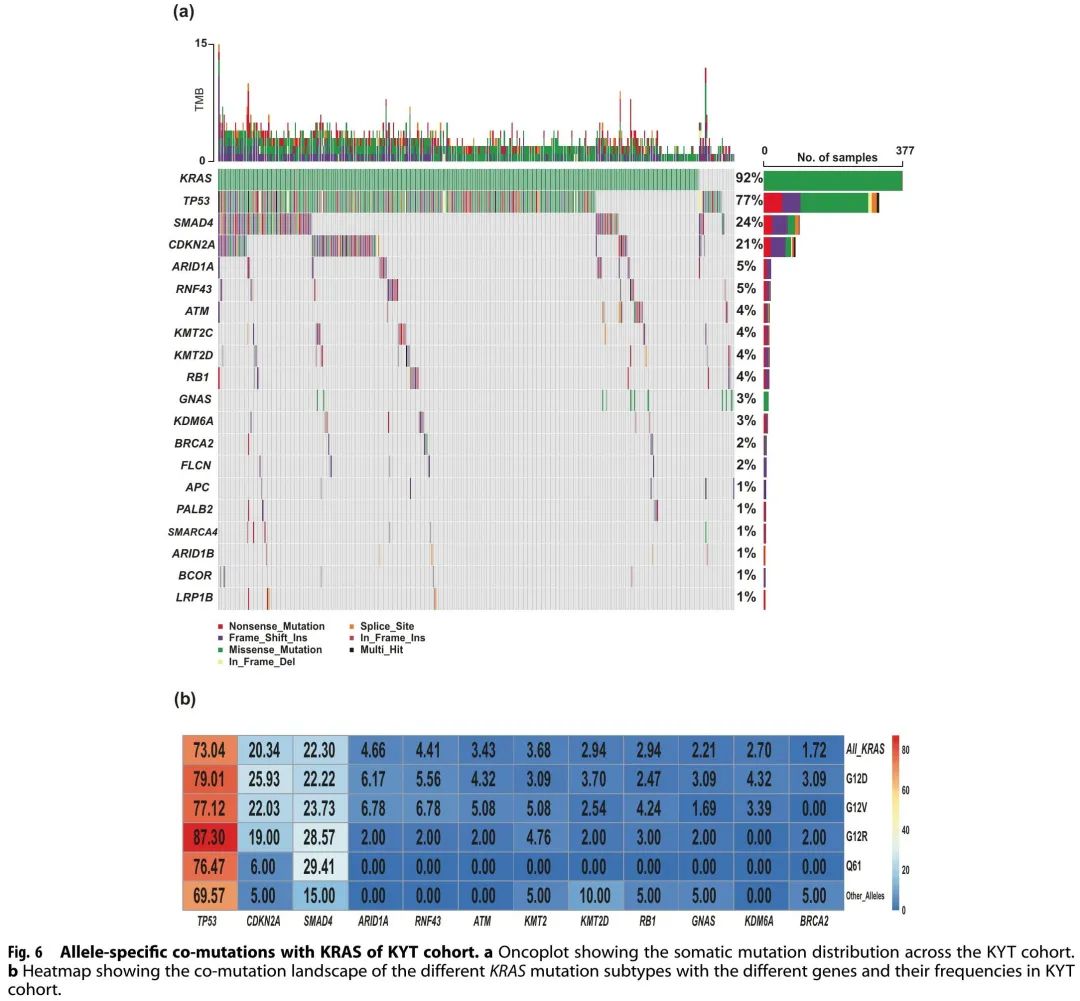
图6
与MD安德森队列相似,TP53最常与KRAS共突变(阳性率为73%),其次是CDKN2A(20%)、SMAD4(22%)和ARID1A(5%)(图6b)。共突变分析显示(图7a),KRAS经常与TP53(OR:2.6,FDR校正p = 0.18)和CDKN2A(OR:2.6,FDR校正p = 0.84)共突变。TP53 和 CDKN2A 经常共突变(OR:3.54,FDR 校正 p = 0.009)。TP53突变与ATM(OR:0.04,FDR校正p = 9.8E-07)和GNAS(OR:0.05,FDR校正p = 6.65E-05)突变是相互排斥的。KRAS和GNAS突变也是相互排斥的(OR:0.17,FDR校正p = 0.18)(图7a)。KRAS G12R的中位OS(32个月)显著长于KRAS Q61(16个月,HR:2.6,95% CI 0.88-7.8,p = 0.02)和KRAS G12D(23个月,HR:1.68,95% CI 1.06-2.65,p = 0.04)(图7b)。
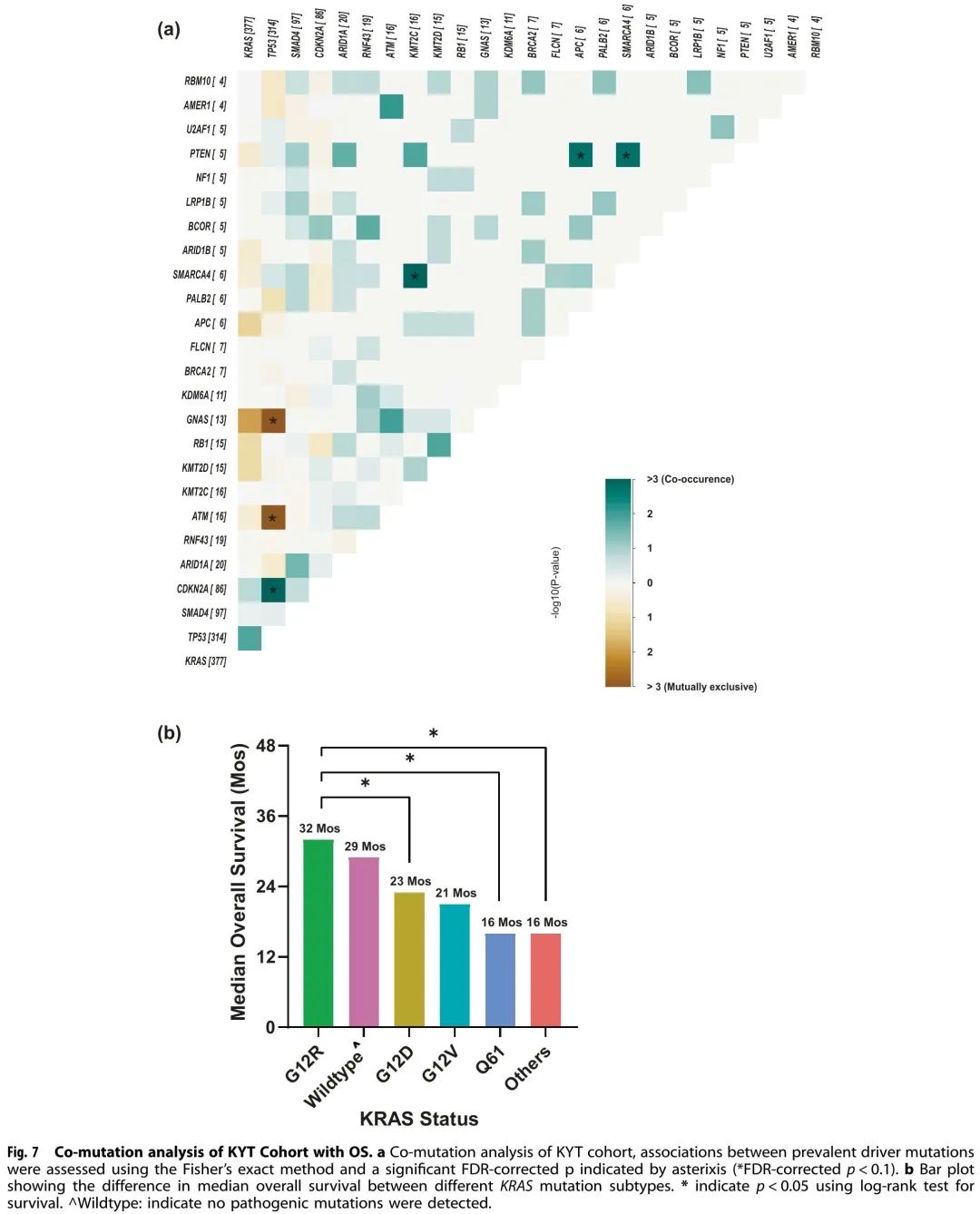
图7
讨 论
本研究使用两个真实世界的数据集,分析了KRAS突变状态、KRAS突变亚型和共突变对PDAC患者临床结局的影响。本研究包括 803 例在 MD 安德森癌症中心接受肿瘤体细胞突变检测的患者,以及来自 PanCAN KYT® 数据集的外部胰腺癌患者队列(n = 408)。我们发现KRAS突变状态和突变亚型与OS相关;与KRAS G12D或KRAS Q61突变肿瘤患者的中位OS相比,KRAS野生型和KRAS G12R突变肿瘤患者的中位OS更长。此外,描述了KRAS突变的共突变图谱。ARID1A突变与较差的OS相关,而SMAD4与较好的OS相关。TP53 和 ATM 突变是相互排斥的。与KRAS G12R患者相比,KRAS G12D患者的ARID1A突变率更高。KRAS G12D在转移性疾病中富集,KRAS G12R在中高分化肿瘤中富集。
在MD安德森接受肿瘤体细胞突变检测的803例PDAC患者中,703例进行了KRAS突变检测(图1)。KRAS突变的总体阳性率为82%(n=578);最常见的突变是KRAS G12D(39%),其次是KRAS G12V(31%)、KRAS G12R(14%)、KRAS Q61(6%)和其他罕见KRAS变异(9%)(图2d)。OS因KRAS突变状态和突变亚型而异,在总体人群(所有分期,图2a)和IV期疾病患者亚群(n = 302)(图2b)中均是如此。与KRAS野生型肿瘤患者(无论疾病分期如何)相比,KRAS G12D(中位OS 22个月,HR:1.7,95% CI 1.3-2.3,p<0.001)或KRAS Q61(中位OS 20个月,HR:1.9,95% CI 1.2-3.0,p = 0.006)突变肿瘤患者的OS较差。KRAS G12R突变患者的OS(中位OS 34个月,HR:1,95% CI 0.71–1.5,p = 0.88)与野生型患者(中位OS 38个月,参考)相似(图2c)。来自PanCAN KYT®数据集的外部队列(n=408)验证了KRAS G12R突变与最长的中位OS(32个月)相关,而KRAS Q61(16个月,HR:2.6,95% CI 0.88-7.8,p = 0.02)和KRAS G12D突变(23个月,HR:1.68,95% CI 1.06-2.65,p = 0.04)与较短的中位OS相关(图7b)。我们的结果与既往研究一致,与非KRAS G12R PDAC患者(n = 88)相比,KRAS G12R突变PDAC患者的OS显著较长(HR 0.55)。另一项比较 KRAS G12C(n = 30)和其他 KRAS 突变的研究显示,在转移性 PDAC 患者中,KRAS 野生型肿瘤(n = 91)的中位 OS较长(从一线治疗开始,p = 0.03),这与我们 KRAS 野生型患者OS较优的发现一致;然而,该研究未显示与KRAS G12C患者相比,其他KRAS突变存在统计学显著差异。由于KRAS G12C突变频率较低,我们将KRAS G12C突变患者与其他罕见突变患者分为一组。在我们的队列中,OS定义为从初始诊断开始,KRAS G12D突变在转移性疾病(IV期)中富集(OR:1.7,95% CI 1.2-2.4,p = 0.001)(图3c)。我们的数据表明,KRAS G12D肿瘤患者的预后较差。这与先前纳入 356 例切除 PDAC 患者的研究一致,该研究报告,KRAS 突变患者的无病生存期(DFS)(中位 12.3 个月)和 OS(中位 20.3 个月)差于KRAS 野生型患者(DFS 16.2 个月,OS 38.6 个月),并且 KRAS G12D 突变患者的结局特别差(中位 OS 15.3 个月)。
为什么KRAS G12D 相比其他亚型预后较差,除了ARID1A 共突变和转移性疾病的富集之外,相关机制尚不完全清楚。据报道,KRAS G12D肺癌的肿瘤微环境(TME)较具免疫抑制性。KRAS G12D突变驱动的PDAC小鼠模型展示了免疫抑制细胞因子IL-4和IL-13以及TME中髓系细胞组成的重塑。在使用KRAS G12D抑制剂MRTX 1133的PDAC小鼠模型中,观察到TME中巨噬细胞(CD11b和F4 / 80 +)增加和总髓系细胞减少。该项目不包括潜在KRAS突变亚型特异性免疫特征相关的组织和血液样本,或可作为未来PDAC患者研究的方向。
KRAS G12R在PDAC中的发生率(~15%)高于其他癌症类型。KRAS G12R具有与 KRAS G12D/V 不同的生化特征,包括改变的开关 II 结构,不能直接激活 p110α/PI3K43。我们发现KRAS G12R突变患者的中位OS与野生型KRAS患者相似,比KRAS G12D或KRAS Q61突变患者长。与低分化/间变性肿瘤相比,高分化和中分化肿瘤中KRAS G12R突变富集(OR:1.7,95% CI 1.05–2.99,p = 0.04)(图3d),提示KRAS G12R突变肿瘤的侵袭性较小,预后较好。另一方面,KRAS Q61突变肿瘤的 GTP 水解率较低,RAF 依赖性 MEK 磷酸化较高,且对 SOS1 抑制剂没有反应。在我们的队列中,KRAS Q61突变具有较短的中位OS,但关于该KRAS突变亚型的临床特征,知之甚少。据我们所知,这是首个报告KRAS Q61 OS较差的研究,这可能与其生化特征一致。由于KRAS Q61突变的罕见性,我们将不同的KRAS Q61突变归为一类,尽管与OS的相关性可能是突变特异性的。KRAS G12R和KRAS Q61突变PDAC的临床和分子特征值得进一步研究。进行更多更大人群研究可能有助于开发KRAS突变亚型特异性抑制剂,如KRAS G12R抑制剂。
与KRAS的共突变可能是PDAC突变亚型特异性临床结局的促成因素之一。在肺癌中 KEAP1 与 KRAS 共突变与 KRAS G12C 抑制剂索托雷塞治疗的早期进展有关。共突变在PDAC中很常见,基于观察到的共突变模式提出的疾病进展模型是早期KRAS突变,然后CDKN2A,之后TP53和SMAD4缺失。我们的数据与既往研究一致,TP53(67%)是最常见的KRAS共突变,其次是CDKN2A(17%)、SMAD4(11%)和ARID1A(6%)(图4b)。在进行了 KRAS、TP53 和 CDKN2A 突变检测的患者中,我们将转移性患者(n = 232)分为四种不同的分子亚型,测试 KRAS/CDKN2A/TP53 疾病进展模型。我们发现三阴性(KRAS−/TP53−/CDKN2A−)肿瘤患者具有最好的OS(中位28个月),而CDKN2A为主的肿瘤具有最差的OS(中位12个月,p = 0.014)(图5c)。在我们的研究中,CDKN2A 突变包括任何突变(CDKN2A 错义或缺失)。胚系 CDKN2A 突变与黑色素瘤和胰腺癌风险增加有关,体细胞 CDKN2A 缺失在胰腺癌中较常见。体细胞 CDKN2A 缺失切除 PDAC 患者的生存状况(中位 DFS 11.5,OS 19.7)差于CDKN2A 野生型患者(中位 DFS 14.8 和中位 OS 24.6)。另一项研究纳入了 100 例 PDAC(包括转移性和非转移性)患者,也发现 CDKN2A 突变与较短的 OS 相关(22 个月 vs 35 个月;P = 0.018)。在 KRAS 突变肺癌中,CDKN2A 突变与免疫疗法的生存率较差有关。在小鼠模型中,CDKN2A 缺失加速KRAS G12D驱动肿瘤的生长。一种靶向 KRAS突变 PDAC 中 CDKN2A 的治疗方法正在研究中;然而,在早期试验中未观察到 CDK4/6 抑制剂的临床活性。甲基硫代腺苷磷酸化酶基因(MTAP)的位置与 CDKN2A 相邻,大多数具有 CDKN2A 缺失的 PDAC 肿瘤也存在 MTAP 缺失。CDKN2A 的替代作用尚不清楚,我们队列中报告的 MTAP 缺失率较低。
本研究中单因素OS分析未显示TP53或CDKN2A共突变与OS的统计学显著相关性,但发现ARID1A突变与较差的OS相关(中位18个月 vs 31个月,HR:1.6,95% CI 0.99–2.6,p = 0.05),SMAD4突变与较好的OS相关(中位35个月 vs 27个月,HR:0.67,95% CI 0.46–0.99,p = 0.046)(图5b)。SMAD4 是一种抑癌基因,关于 SMAD4 预后价值的研究报告了不一致的结果。有研究表明在切除 PDAC 中 SMAD4 失活与不良预后存在相关性,但一项荟萃分析并未显示 SMAD4 突变与 OS 相关。我们的数据显示 SMAD4 突变率为 13%,并且与较好的 OS 相关。对于这些不同的结果,未来需要开展纳入不同人群的更大样本量研究。发现 ARID1A 与 CDKN2A(OR:2.7,95% CI 1.18–6.02,FDR 校正 p = 0.095)和 SMARCA4(OR:5.17,95% CI 1.15–18.44,FDR 校正 p = 0.1)显著共突变。KRAS G12R突变患者的ARID1A共突变率低于KRAS G12D突变患者(0% vs 8%,p = 0.02)(图4b)。在PanCAN KYT®数据集的验证队列中也观察到了类似的发现。ARID1A 和 SMARCA4 都是开关/蔗糖不可发酵(SWI/SNF)染色质重塑复合物基因,对 PDAC 的表观遗传重编程很重要。在 PDAC 中观察到 SWI/SNF 染色质调节的背景特异性肿瘤抑制或致癌功能。在小鼠模型中,改变的 ARID1A 促进了从 KRAS 突变导管内乳头状黏液瘤(IPMN)到 PDAC 的癌变。在 KRAS 突变结肠癌中,MEK/ERK 信号传导需要类似的 ARID1A 肿瘤支持作用。本研究结果显示,ARID1A突变与较差的OS相关,这支持ARID1A的致癌作用以及PDAC中靶向ARID1A的潜在益处。ARID1A 调节 DNA 损伤检查点,使细胞对 DNA 损伤反应(DDR)靶向药物敏感。ATM-TP53 信号通路在胰腺癌的 DDR 靶向中很重要。有趣的是,在我们的两个队列中,TP53突变均与ATM突变相互排斥。PDAC 中 ARID1A 突变与较差的 OS 相关,以及 TP53 和 ATM 突变相互排斥,本研究的这些发现为PDAC治疗脆弱性提供了信息。
本研究的局限性在于患者群体、肿瘤突变检测方法和基因panel的异质性。本研究仅包括在MD安德森进行组织分子检测的患者;进行其他panel检测的患者不包括在内。这是一项单个三级癌症中心的回顾性研究,存在偏倚。外部验证队列的临床信息有限,无法获得治疗史。肿瘤基因组因素可能不是KRAS突变亚型特异性的主要因素。患者相关的组织和血液样本不可及,无法评估其他可能导致临床结局差异的非基因组因素。
总之,我们使用单中心回顾性研究和外部验证队列报告了PDAC患者KRAS突变亚型特异性临床结局。本研究结果表明,考虑到与KRAS共同发生的突变,KRAS靶向和联合策略可能需要突变亚型特异性方法。在对 803 例 PDAC 患者的分析中,我们发现 KRAS 突变状态和突变亚型与 OS 相关。KRAS 野生型和 KRAS G12R 突变肿瘤患者的生存期长于 KRAS G12D 或 KRAS Q61 突变肿瘤患者,这一观察结果在外部验证队列中得到证实。我们还观察到,KRAS G12D突变在转移性疾病患者中富集,KRAS G12R突变在中高分化肿瘤患者中富集。此外,共突变可能导致KRAS突变亚型特异性临床结局。ARID1A 突变患者 OS 较差,KRAS G12R 的 ARID1A 共突变率较低。不同的KRAS 突变亚型和共突变状态具有不同的临床结局,这提示KRAS 突变对胰腺癌结局的突变亚型和共突变特异性影响,为改善胰腺癌中靶向 KRAS 的方法提供了指导。
参考文献:
Yousef, A., Yousef, M., Chowdhury, S. et al. Impact of KRAS mutations and co-mutations on clinical outcomes in pancreatic ductal adenocarcinoma. npj Precis. Onc. 8, 27 (2024). https://doi.org/10.1038/s41698-024-00505-0

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#胰腺导管腺癌# #KRAS突变#
17