欧盟批准德喜曲妥珠单抗(T-DXd)作为HER2 阳性胃或胃食管交界处 (GEJ) 腺癌的二线治疗
2022-12-20 MedSci原创 MedSci原创 发表于上海
欧盟委员会已批准 fam-trastuzumab deruxtecan-nxki (T-DXd; Enhertu) 作为单一疗法,用于治疗既往接受过曲妥珠单抗(赫赛汀)方案的晚期 HER2 阳性胃或胃
欧盟委员会已批准 fam-trastuzumab deruxtecan-nxki (T-DXd; Enhertu) 作为单一疗法,用于治疗既往接受过曲妥珠单抗(赫赛汀)方案的晚期 HER2 阳性胃或胃食管交界处 (GEJ) 腺癌患者 .
T-DXd 是欧盟第一个批准的 HER2 靶向疗法,用于在采用基于曲妥珠单抗的方案进行一线治疗后疾病进展的转移性胃癌患者。 该批准是在人用医药产品委员会于 2022 年 11 月发布的积极意见之后,基于 2 期 DESTINY-Gastric02 (NCT04014075) 和 DESTINY-Gastric01 (NCT03329690) 试验的结果。
开放标签、单臂 2 期 DESTINY-Gastric02 试验评估了 6.4 mg/kg T-DXd 在 HER2 阳性转移性和/或不可切除的胃癌或 GEJ 腺癌患者中的疗效,这些患者在接受含曲妥珠单抗的治疗方案期间或之后出现疾病进展。
DESTINY-Gastric02的主要终点是基于 ICR 确认的 ORR。 次要终点包括无进展生存期(PFS)、OS、DOR 和安全性。 DESTINY-Gastric02 2 期试验的主要结果在 2021 年 ESMO 大会上公布,更新数据在 2022 年 ESMO 上公布。详细见:ESMO 2022:Trastuzumab Deruxtecan在转移性胃癌/GEJ癌中维持临床获益(DESTINY-Gastric02研究)
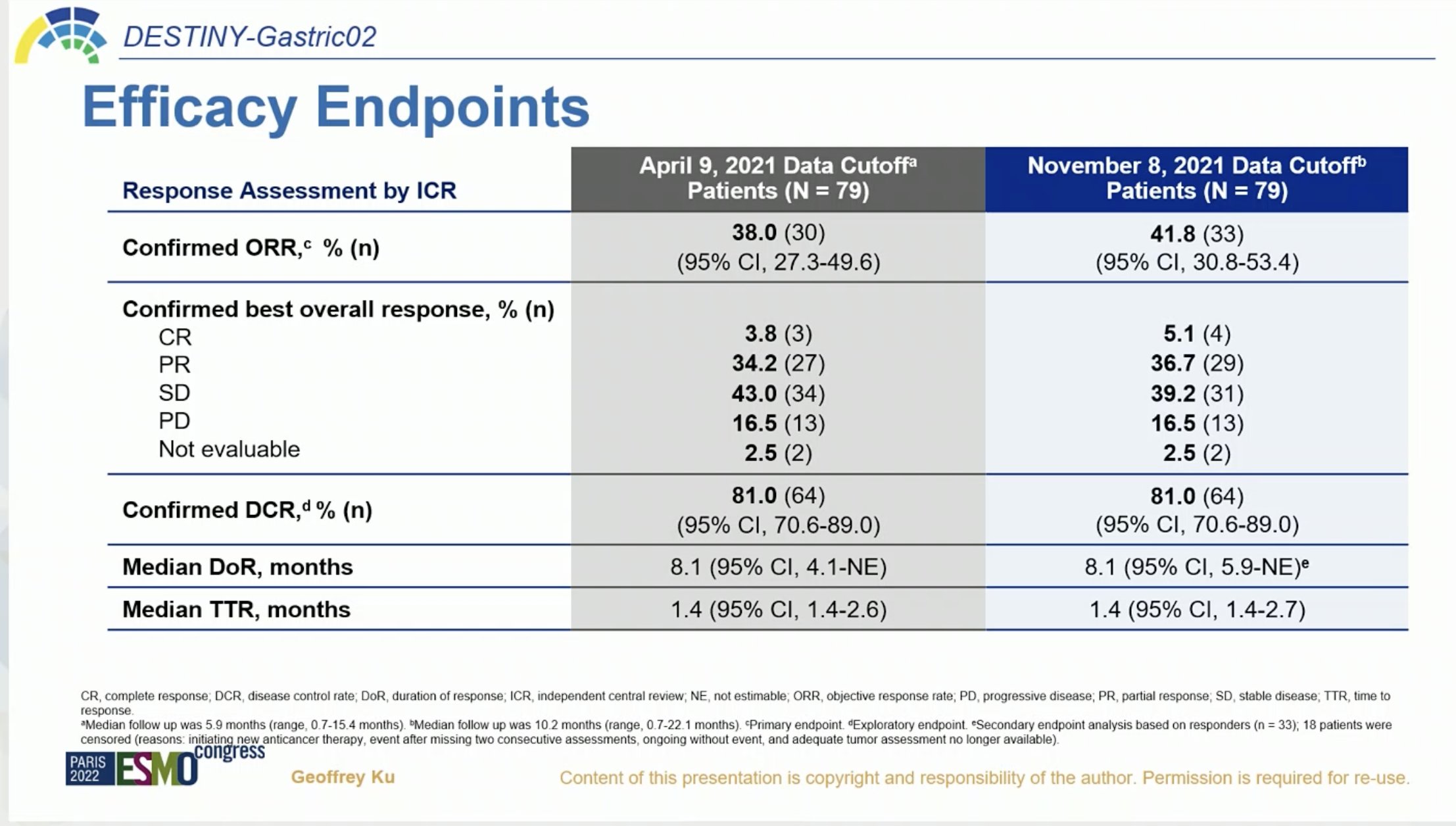
在 DESTINY-Gastric02 中,经独立中心评估,欧洲和北美患者使用 6.4 mg/kg T-DXd 治疗后确认的客观缓解率 (ORR) 为 41.8%(95% CI,30.8%-53.4%)(ICR)。 中位反应持续时间 (DOR) 为 8.1 个月(95% CI,5.9-不可评估)。
随机、开放标签的 2 期 DESTINY-Gastric01 试验招募了 HER2 阳性晚期胃癌或 GEJ 腺癌患者,这些患者在接受至少 2 种既往治疗方案(包括氟嘧啶 (5-FU)、铂类化疗和曲妥珠单抗)后出现疾病进展。 HER2 阳性定义为免疫组织化学 (IHC) 3+ 或 IHC 2+/原位杂交阳性。 符合条件的患者接受了 6.4 mg/kg 剂量的曲妥珠单抗 deruxtecan。
DESTINY-Gastric01 的主要终点是 ORR。 次要终点包括 OS、PFS、DOR、疾病控制率、治疗失败时间、药代动力学和安全性。 主要分析发表在《新英格兰医学杂志》上,并在 2022 年胃肠道癌症研讨会上公布了最新数据。

在 DESTINY-Gastric01 中,根据 ICR 评估,在日本和韩国患者中Enhertu、化疗组(依立替康或紫杉醇)的ORR分别为40.5% 和 11.3%。 Enhertu的中位 DOR 为 11.3 个月,化疗组为 3.9 个月。 T-DXd 和化疗组的中位总生存期 (OS) 分别为 12.5 个月(95% CI,9.6-14.3)和 8.4 个月(95% CI,6.9-10.7)(HR,0.59;95% CI,0.39- 0.88;P =0.0097)。

在这两项试验中,曲妥珠单抗 deruxtecan 表现出与其他评估该药物的试验中报告的相似的安全性,没有新发现的安全信号。
在一项针对接受 6.4 mg/kg T-DXd 的多种肿瘤类型患者的汇总安全性分析中,常见的 3/4 级治疗相关不良反应 (TRAE) 包括中性粒细胞减少症 (27.9%)、贫血 (23.1%)、白细胞减少症 ( 12.9%)、血小板减少症(9.0%)、疲劳(8.2%)、食欲下降(8.1%)、淋巴细胞减少症(7.4%)、恶心(5.8%)、转氨酶升高(4.7%)、低钾血症(4.2%)、肺炎( 2.9%)、发热性中性粒细胞减少症 (2.9%)、呕吐 (2.4%)、腹泻 (2.1%)、体重下降 (2.1%)、血液碱性磷酸盐升高 (1.8%)、间质性肺病 (ILD) (1.6%)、 呼吸困难 (1.3%) 和射血分数降低 (1.1%)。5 级 TRAE 发生在 2.6% 的患者中,包括间质性肺病 (1.9%)。
“今天的消息对于 HER2 阳性晚期胃癌患者来说是一个可喜的进步,”比利时鲁汶大学肿瘤学系主任 Eric Van Cutsem 医学博士说。 “患有这种疾病的患者在使用 HER2 靶向药物进行初步治疗后会面临较差的结果,因为许多人对进一步治疗没有反应,即使是那些有反应的患者也往往没有持久的反应。 来自 DESTINY-Gastric02 和 DESTINY-Gastric01 试验的数据支持 Enhertu 成为这种情况下患者的新护理标准。”
“Enhertu 是第一个在欧洲获批用于治疗晚期胃癌的 [ADC],代表着治疗这种难治性癌症的重大进展,”Daiichi 肿瘤业务全球负责人兼总裁兼首席执行官 Ken Keller 说。 Sankyo, Inc.“通过这一批准,我们现在可以为先前接受过治疗的 HER2 阳性胃癌患者提供具有临床意义疗效的治疗方法。”
参考资料:
https://www.onclive.com/view/european-commission-approves-trastuzumab-deruxtecan-in-pretreated-her2-advanced-gastric-gej-cancer
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






