8位共同一作!清华大学,最新Nature!
2023-07-20 BioMed科技 BioMed科技 发表于上海
在这项研究中,研究人员发现了OBOX家族作为小鼠ZGA的重要调控因子,部分通过促进Pol II的预配置和优先在低CG启动子和增强子上进行染色质开放来实现。
新发现!OBOX蛋白唤醒休眠的胚胎基因组
在动物受精过程中,动物基因组处于不活跃状态,早期发育阶段是由存储在卵子中的预先存在的蛋白质和RNA转录本所驱动的。随着受精卵分裂为两个细胞,发育控制逐渐转移到胚胎中。
为了实现正常发育,特定基因在特定时间点被激活至关重要。然而,负责转录的RNA聚合酶II(RNA pol II)通常缺乏识别需要转录的基因的内在能力。转录因子的作用是通过结合到DNA的特定区域(启动子和增强子)上,结合RNA pol II到这些位点,从而引导基因表达。
合子基因组激活(ZGA)是将休眠基因组激活,实现母源-合子过渡的过程。虽然在果蝇和鱼类中已经鉴定了参与合子基因组激活的关键转录因子,但在哺乳动物中,这些因子长期以来一直不为人们所了解。
2023年7月17日,清华大学生命科学学院颉伟教授和宾夕法尼亚大学生物系Richard M. Schultz教授合作,发现了一组参与小鼠合子转录程序启动的转录因子家族OBOX,并提供了这些因子在将转录机制定位到正确基因上的证据。相关论文以OBOX regulates murine zygotic genome activation and early development为题,作为预印本发表在Nature期刊上。论文共同第一作者为嵇姝妍博士后,陈凤玲博士后,王嘉程博士,周子茗博士,王利娟研究助理、Qing Zhao, Zili Lin以及美国科学研究所生殖与发育生物学实验室的Paula Stein博士。

当日,瑞士洛桑大学综合基因组学中心的Nadine L. Vastenhouw和Edlyn Wu在Nature杂志上发表了题目为Sleeping embryonic genomes are awoken by OBOX proteins的报道,该报道指出在早期胚胎中,基因转录的激活受到精确的调控。现在,通过鉴定关键的转录因子,我们可以看到在小鼠中转录机制是如何在正确的时间将“转录机器”导向正确的位置的。

【Obox在ZGA周围高度表达】
鉴定可能参与合子基因组激活的转录因子有两种方法。一种方法是观察在受精卵中丰富产生的蛋白质,因为假设任何参与合子基因组激活的因子应该是母源加载的,可以立即起作用。另一种方法是查找在早期胚胎中激活的基因的启动子和增强子中的特定DNA序列,并确定哪些转录因子可能与这些序列结合。研究人员使用这两种方法的组合,鉴定出OBOX转录因子家族(Obox1-8)作为有望参与小鼠合子基因组激活的候选因子。

图1 小鼠卵母细胞和植入前胚胎中的OBOX表达
【Obox基因敲除损害了ZGA】
合子基因组激活从单细胞阶段开始,有少量基因的小波次转录被激活。随后在晚期双细胞阶段发生一大波次转录,大约有1000个基因被激活。小波次转录对于大波次和发育过程至关重要。
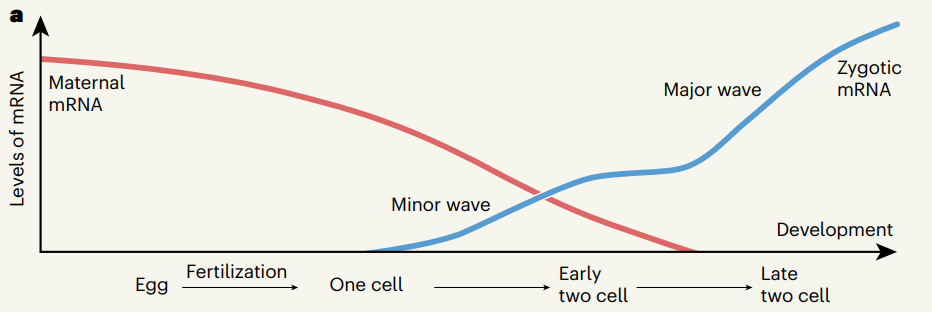
图2 母源RNA被降解,合子基因组被激活的过程
研究人员发现,删除六个Obox基因(Obox1, 2, 3, 4, 5和7)会影响小波次和大波次的转录,胚胎停止在双细胞或四细胞阶段发育。这六个相关的Obox基因在早期胚胎中的表达时间不同,有些是母源加载的,有些是合子表达的。令人惊讶的是,恢复这两类基因的表达都可以恢复发育进程和转录。这表明不同的Obox基因可以在一定程度上互补,与参与基因组激活的因子应该是母源加载的假设相矛盾。

图3 母源和合子的OBOX共同支持胚胎发育

图4 OBOX的缺失导致小波次和主波次的ZGA缺陷
【OBOX因子调控ZGA的机制】
RNA pol II必须加载到基因的启动子上才能激活转录。如果启动子富含胞嘧啶和鸟嘌呤(因此被称为富CG的启动子),RNA pol II似乎可以不需要基因特异性转录因子即可结合到启动子上,在单细胞阶段,RNA pol II已经加载到这种启动子上。然而,在低CG启动子上,需要序列特异性转录因子来结合RNA pol II。
研究人员发现,OBOX蛋白特异性地识别和结合到低CG的合子基因组激活基因的调控序列上,从而结合RNA pol II并激活大波次基因的转录。OBOX促进了RNA Pol II的“预配置”,因为Pol II从最初的单细胞结合靶点重新定位到ZGA基因的启动子和远端增强子。

图5 OBOX转录因子引导RNA pol II酶定位到目标基因。OBOX蛋白在双细胞阶段结合RNA pol II到低CG启动子上的ZGA基因,可能是因为酶从CG富集的非ZGA基因中重新定位(虚线箭头)。通过RNA pol II和OBOX介导的大波次ZGA基因的转录始于双细胞阶段。
研究人员发现,在没有OBOX蛋白的情况下,RNA pol II异常地停留在这些启动子上。这表明将RNA pol II从富CG的非合子基因组激活基因转移到低CG的合子基因组激活基因上需要OBOX蛋白的结合。因此,OBOX蛋白不仅在基因组激活过程中起到激活转录的作用,还防止了异常转录的发生。
【小结】
人类体外受精的一个障碍是大约40%的胚胎在合子基因组激活(ZGA)过程中停止发育。在这项研究中,研究人员发现了OBOX家族作为小鼠ZGA的重要调控因子,部分通过促进Pol II的预配置和优先在低CG启动子和增强子上进行染色质开放来实现。虽然Obox基因是特定于啮齿动物的,但人类基因组已经演化出一组属于同一类转录因子的基因。这项研究为理解这些转录因子如何启动人类发育程序铺平了道路。
原文链接:
https://doi.org/10.1038/d41586-023-01618-5
https://doi.org/10.1038/s41586-023-06428-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








