吴一龙教授团队:梳理经治EGFR突变非小细胞肺癌患者的新型系统疗法
2023-11-06 苏州绘真医学 苏州绘真医学 发表于威斯康星
广东省肺癌研究所的吴一龙教授团队在Ther Adv Med Oncol期刊上发表了一篇关于经TKI治疗的EGFR突变NSCLC患者的新型系统疗法的综述。

EGFR-TKI是携带EGFR突变非小细胞肺癌(NSCLC)患者的标准一线治疗选择。然而,治疗一段时间后,耐药性不可避免地发生。铂类化疗是接受EGFR-TKI治疗期间出现疾病进展患者的标准治疗方法,但其疗效有限。经大量治疗的EGFR突变NSCLC患者的管理亟需新的治疗方案。近日,广东省肺癌研究所的吴一龙教授团队在Ther Adv Med Oncol期刊上发表了一篇关于经TKI治疗的EGFR突变NSCLC患者的新型系统疗法的综述。
EGFR依赖性耐药机制患者的治疗策略
虽然第三代EGFR-TKI(包括奥希替尼、拉泽替尼、阿美替尼和伏美替尼)在有或无T790M突变(常见于接受第一代或第二代EGFR-TKI治疗后疾病进展的患者)的激活性EGFR突变患者中显示出了较好的疗效,但这些患者在疾病进展后可选择的治疗方案很少。最常见的获得性靶内EGFR-TKI耐药突变是EGFR C797S,约占接受奥希替尼二线治疗的患者的15%和接受奥希替尼一线治疗的患者的7%。无论是否使用EGFR-TKI治疗,EGFR C797S的激活可导致下游丝裂原激活蛋白激酶(MAPK)通路的持续激活,目前尚无批准的靶向治疗药物。既往研究表明,对于同时携带EGFR T790M和反式C797S突变的患者,再次使用第一代EGFR-TKI联合第三代EGFR-TKI仅有短暂的临床改善,中位PFS为1.5~3.0个月。几种旨在克服EGFR C797S耐药的第四代EGFR-TKI最近对这些患者显示出令人鼓舞的疗效(图1)。
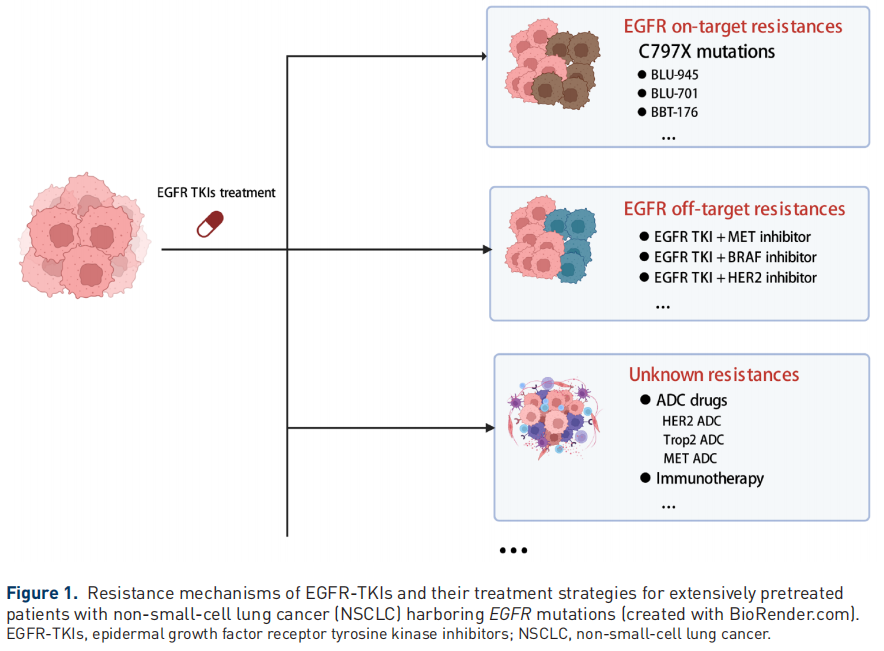
图1
BLU-945:
BLU-945是一种选择性第四代EGFR-TKI,旨在靶向常见的激活性和靶内耐药突变,如EGFR C797S和T790M。尽管存在EGFR T790M和C797S突变,但BLU-945仍可抑制EGFR信号激活。临床前数据表明,BLU-945对C797S和T790M突变的选择性比野生型基因高450倍以上。在奥希替尼耐药细胞系来源的肿瘤异种移植瘤和患者来源的异种移植瘤模型中,BLU-945单药治疗或与奥希替尼联合治疗均显示出抗肿瘤活性。基于BLU-945的药理学活性,一项正在进行的I/II期首次人体研究(SYMPHONY,NCT04862780)旨在评估BLU-945作为单一疗法或与奥希替尼联合治疗奥希替尼耐药的EGFR突变NSCLC患者的耐受性和抗肿瘤活性。截至2022年1月7日,该试验纳入了33例患者,其中大多数既往接受过三线以上治疗。初步分析显示BLU-945总体耐受性良好,无4级或5级不良事件(AEs)报告。1例患者出现3级转氨酶升高,停药后缓解。接受BLU-945治疗患者的循环肿瘤DNA(ctDNA)显著减少。BLU-945剂量的增加与更大的肿瘤缩小相关。这些初步结果表明,在接受过大量治疗的EGFR突变NSCLC患者中,BLU-945联合奥希替尼治疗具有安全、有前景的抗肿瘤活性。更大样本的进一步研究正在进行中。
BLU-701:
BLU-701是另一种脑穿透性、可逆的下一代EGFR-TKI,旨在克服奥希替尼耐药的EGFR C797S突变。无论是否存在EGFR C797S耐药突变,BLU-701都能强烈抑制EGFR 19del和L858R突变。在一项临床前研究中,BLU-701显示出对EGFR自磷酸化的持久抑制和肿瘤减小作用。HARMONY试验(NCT05153408)是一项正在进行的I/II期首次人体研究,旨在既往接受过治疗的EGFR突变NSCLC患者中,评估BLU-701单药治疗或与奥希替尼或化疗联用的安全性和抗肿瘤活性。目前,这项研究正在招募接受一线或多线EGFR-TKIs治疗的转移性EGFR突变NSCLC患者。接受I期剂量递增的患者将被分配到三个不同的治疗组:1A部分(BLU-701单药治疗)、1B部分(BLU-701+奥希替尼)和1C部分(BLU-701+卡铂和培美曲塞)。在II期单药治疗期间,携带获得性EGFR C797S耐药突变的患者将接受BLU-701单药治疗。
另一项研究旨在评估BLU-945和BLU-701在EGFR L858R/C797S驱动的Ba/F3细胞系来源的肿瘤异种移植皮下肿瘤模型中的抗肿瘤活性。给予BLU-945或BLU-701单药治疗使肿瘤明显消退。此外,联合使用BLU-945和BLU-701可产生更强的抗肿瘤活性和肿瘤消退,因为这些药物可能覆盖更广泛的靶内耐药机制突变谱。
BBT-176:
BBT-176可以特异性和非共价地抑制三重EGFR突变残基(外显子19del或L858R/T790M/C797S)。临床前数据显示BBT-176在Ba/F3工程细胞和患者来源的异种移植的EGFR三重突变模型中具有良好的抗肿瘤效果。一项I期研究(NCT04820023)旨在评估BBT-176在既往接受过至少一线EGFR-TKI治疗的EGFR突变患者中的耐受性和抗肿瘤活性。中期结果表明,在纳入的18例患者中,5例携带三重EGFR突变基因(外显子19del/T790M/C797S或L858R/T790M/C797S)。毒性耐受性良好,未发生停止治疗或剂量限制性毒性。2例携带三重EGFR突变(外显子19del/T790M/C797S)的患者肿瘤缩小,其中一例患者显示肿瘤消退高达30.3%。总体而言,本研究的中期结果表明BBT-176具有初步的抗肿瘤活性,且毒性可接受。目前正在进一步探索推荐的II期剂量。
许多其他第四代EGFR-TKIs目前正在评估中。表1总结了正在进行的试验和这些研究中调查的药物。
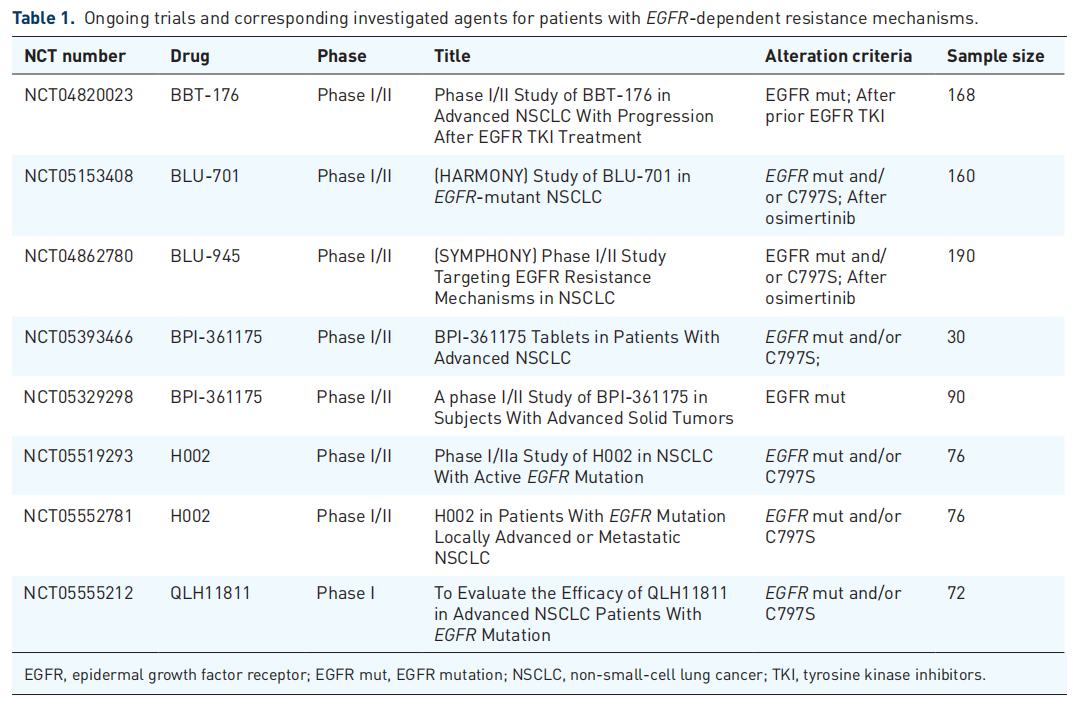
表1
第四代EGFR-TKIs未解决的临床问题和前景:
与第三代EGFR-TKIs一样,靶向EGFR C797S耐药突变的新型药物最终可使患者获益。理想的第四代EGFR-TKIs不仅应靶向EGFR C797S突变,还应改善EGFR L858R突变和中枢神经系统(CNS)转移患者的预后。然而,目前关于第四代EGFR-TKIs的数据有限。此外,除了EGFR C797S是耐药机制外,野生型EGFR基因扩增也被描述为第三代EGFR-TKIs治疗失败后的耐药机制。然而,关于EGFR扩增患者的数据报道很少。该人群迫切需要有效的治疗。
EGFR非依赖性耐药机制患者的治疗策略
EGFR非依赖性耐药(也称为脱靶耐药)是EGFR-TKI治疗期间肿瘤进展后的另一个主要机制。EGFR非依赖性耐药涉及多种突变,包括MET扩增、EGFR扩增和HER2扩增。一般来说,具有脱靶耐药性的患者会接受 EGFR-TKI 联合其他靶向耐药性突变以抑制肿瘤生长的特定药物。
MET扩增患者的治疗策略:
在接受第一代或第二代EGFR-TKIs治疗的患者中,5-15%的患者出现获得性MET扩增耐药,在接受第三代EGFR-TKIs治疗的患者中,约20%的患者出现获得性MET扩增耐药。一项研究表明,EGFR突变NSCLC在第三代EGFR-TKI治疗期间发生进展,耐药机制为获得性MET扩增,EGFR-TKIs和MET-TKIs联合治疗有效。几种小分子MET- TKIs(包括卡马替尼、特泊替尼和赛沃替尼)被设计用于在EGFR-TKI耐药的情况下靶向MET扩增,这些药物均显示出有前景的结果(图2)。表2总结了在先前EGFR-TKIs治疗中发生进展的EGFR突变和MET变异患者的临床试验。


图2


表2
总体而言,MET抑制剂(包括卡马替尼、特泊替尼和赛沃替尼)与EGFR-TKIs联合治疗对EGFR-TKIs耐药且携带MET变异的患者显示出令人鼓舞的疗效,尤其是对高水平MET调节异常的患者。
携带其他旁路介导的耐药机制患者的治疗策略:
其他旁路介导的耐药机制虽然罕见,但也会在EGFR-TKIs治疗EGFR突变肺癌期间导致疾病进展。这些机制包括HER2扩增、KRAS扩增、CCND1扩增和BRAF突变。在一项研究中,在接受第三代EGFR-TKIs治疗后发生疾病进展的患者中,2-7%检测到HER2扩增。获得性HER2扩增可通过持续激活下游通路(如MAPK和PI3K通路)导致EGFR-TKI耐药。对于有原发性HER2变异(包括NSCLC中的HER2扩增和HER2突变)的患者,一些ADC药物显示出很有前景的疗效,包括恩美曲妥珠单抗(TDM1)和德曲妥珠单抗(T-DXd,DS-8201)。与携带MET扩增的EGFR突变NSCLC患者一样,奥希替尼联合恩美曲妥珠单抗在HER2扩增介导耐药的EGFR突变NSCLC患者中显示出很有前景的疗效。此外,一份病例报告表明,即使携带HER2错义突变的患者对吉非替尼产生耐药,EGFR-TKI联合吡咯替尼(一种选择性HER2-TKI)也可达到持久缓解。这些结果支持在HER2驱动的EGFR-TKI耐药情况下使用这种新型药物进行进一步研究。
在1-3%接受EGFR-TKI治疗期间出现疾病进展的患者中发现了BRAF V600E突变,也是一种耐药机制。临床前和回顾性证据支持将EGFR-TKI与BRAF V600E特异性抑制剂联用,以阻断旁路信号通路。然而,目前发布的前瞻性临床试验数据很少。
正在进行的II期ORCHARD试验是一项基于筛选生物标志物的研究,纳入了携带EGFR突变,并且在奥希替尼一线治疗期间发生疾病进展的晚期NSCLC患者。在该研究中,根据识别的奥希替尼一线耐药机制给予各种联合用药,包括EGFR C797S突变、MET变异、EGFR扩增、ALK重排、RET融合和未知的耐药机制。本试验的主要目的是解决既往接受过多种治疗的患者所面临的挑战。
耐药机制未知患者的新型药物
在服用第三代奥希替尼期间发生疾病进展的患者中,约有30~50%没有可识别的耐药机制。以生物标志物指导治疗的策略在这些患者中不可行,建议采用铂类双药化疗联合抗血管生成药物。此外,新型的治疗方法已对这些患者显示出初步疗效,这些方法包括ADC、双特异性抗体埃万妥单抗和免疫检查点抑制剂(ICIs)。
德帕瑞妥单抗(Patritumab deruxtecan,HER3-DXd,U3-1402):
德帕瑞妥单抗是一种新型靶向HER3的ADC,由通过基于四肽的可裂解接头将HER3抗体连接到拓扑异构酶I抑制剂负荷上组成。83%的NSCLC有HER3表达,一项I期研究(NCT03260491)表明,在接受过EGFR-TKI治疗的患者中,德帕瑞妥单抗安全有效。数据显示了有前景的结果,ORR为39%(95%CI,26.0~52.4%),疾病控制率(DCR)为72%(95%CI,59~83%),中位PFS为8.2个月(95%CI,4.4~8.3)。德帕瑞妥单抗在有CNS转移的患者中显示出强效CNS活性,ORR为32%,DCR为80%,与其在无CNS疾病患者中的疗效相似。此外,在携带多种基因耐药变异的患者中,德帕瑞妥单抗显示出有前景的临床疗效和可控的安全性。由于在试验中获得了令人惊讶的结果,在2021年圣地亚哥世界ADC会议上,德帕瑞妥单抗被评为世界ADC奖“最具前景的临床候选药物”。这再次证明了DXd-ADC技术是一项全球性突破。此外,目前HETHENA-Lung01和HERTHENA-Lung02试验正对二线或三线德帕瑞妥单抗治疗进行全面研究。HER3作为生物标志物需要进一步探索。
Datopotamab deruxtecan (Dato-DXd,DS-1062):
滋养层细胞表面抗原2(TROP2)是一种跨膜糖蛋白,在NSCLC和其他实体肿瘤中高表达。TROP2过表达可导致生存率低。Datopotamab deruxtecan是一种靶向TROP2的ADC,由靶向TROP2的单克隆抗体、新型拓扑异构酶1抑制剂和基于四肽的接头组成。临床前研究表明,在TROP2阳性肿瘤小鼠中,Datopotamab deruxtecan具有良好的抗肿瘤活性。一项关于Datopotamab deruxtecan的I期研究(NCT03401385)表明,在既往接受过大量标准治疗的NSCLC患者中,ORR为26%,DCR为70%,初步中位PFS为6.9个月(95%CI,2.7~8.8),并且安全性可控。基于Datopotamab deruxtecan令人鼓舞的疗效,一项纳入EGFR-TKI治疗后发生疾病进展的EGFR突变NSCLC患者的II期研究正在进行中(TROPION-Lung05,NCT04484142)。
维汀-特立妥珠单抗(Telisotuzumab vedotin,ABBV-399,Teliso-V)
维汀-特立妥珠单抗是一种靶向MET蛋白的新型ADC,可将细胞毒性有效负荷(单甲基澳瑞他汀E)递送至MET过表达的肿瘤细胞中。在约50%的NSCLC中观察到MET蛋白过表达。维汀-特立妥珠单抗单药治疗晚期实体瘤显示出可耐受的安全性和良好的抗肿瘤活性。在I/Ib期研究中,维汀-特立妥珠单抗联合厄洛替尼在MET过表达和EGFR激活的经EGFR-TKI治疗过的NSCLC患者中显示出抗肿瘤活性,ORR为32.1%,所有可评估疗效患者的中位PFS为5.9个月(95%CI,2.8个月至未达到)。在EGFR突变癌症患者中,MET高过表达患者的ORR为52.6%。EGFR T790M突变阴性患者的中位PFS为6.8个月。毒性是可以接受的,64%的患者发生⩾3级AEs。在接受过EGFR-TKI治疗的EGFR突变、MET过表达NSCLC患者中,维汀-特立妥珠单抗联合厄洛替尼显示出令人鼓舞的抗肿瘤活性和可接受的毒性。
埃万妥单抗联合拉泽替尼:
埃万妥单抗是一种EGFR-MET双特异性抗体,可与每种受体的细胞外结构域结合,绕过TKI结合位点的耐药性。CHRYSALIS-2(NCT04077463)研究旨在评估埃万妥单抗联合拉泽替尼治疗EGFR敏感突变NSCLC患者的疗效,这些患者在接受奥希替尼和铂类化疗后疾病进展。在50例可评价疗效的患者中,ORR为36%,中位PFS为5.1个月。毒性是可以接受的,最常见的⩾3级TRAEs的是输液相关反应(7%)、痤疮样皮炎(5%)和低白蛋白血症(4%)。在对奥希替尼和铂类化疗获得性耐药的未经选择人群中,埃万妥单抗联合拉泽替尼表现出令人鼓舞的抗肿瘤活性。当埃万妥单抗和拉泽替尼联合化疗时,显示出高达50%的ORR(95%CI,27-73%)。正在进行的III期随机MARIPOSA-2研究(NCT04988295)正在奥希替尼治疗后的患者中评估埃万妥单抗联合拉泽替尼和化疗的疗效。
免疫疗法的现有数据和正在进行的临床试验:
ICIs在驱动基因阴性的NSCLC中取得了巨大成功,其在EGFR突变阳性NSCLC中的治疗效果也备受关注。EGFR突变NSCLC具有较低的PD-L1表达和较低的肿瘤突变负荷(TMB),从而导致抑制性肿瘤免疫微环境。多中心注册的IMMUNOTARGET研究表明,携带驱动基因突变(例如KRAS、EGFR、BRAF、MET)的患者接受免疫治疗后的效果较差,平均ORR为19%。在125例EGFR突变阳性的患者中,ORR仅为12.2%,中位PFS为2.1个月。对186名EGFR突变癌症患者进行的三项大型临床试验的汇总分析也显示,在这一特定人群中,免疫治疗的疗效显著低于化疗(HR,1.05;95%CI,0.70-1.55)。因此,除IMpower150研究外,大多数一线免疫治疗临床试验均未纳入EGFR突变患者。IMpower150研究在124例既往接受过EGFR-TKI治疗的EGFR突变阳性癌症患者中研究了阿替利珠单抗的疗效。与之前的研究一致,免疫治疗+化疗组未观察到生存获益。然而,在免疫治疗+化疗和贝伐珠单抗组中,该研究首次证明了免疫治疗与化疗相比的生存获益,两组的PFS分别为10.2个月和6.9个月。在WJOG8515L试验和IMpower130试验的亚组分析中,接受免疫治疗的患者获得了阴性结果。最近的随机III期CheckMate772试验也未能达到主要终点,对于既往EGFR-TKI治疗后发生进展的EGFR突变癌症患者,纳武利尤单抗+化疗和单独化疗之间未观察到PFS获益,中位PFS分别为5.6个月和5.4个月(HR,0.75;95%CI,0.56-1.00;p=0.05)。此外,在EGFR突变NSCLC患者中,CTLA-4抑制剂(伊匹木单抗)+纳武利尤单抗联合治疗未能显示生存获益,中位PFS仅为1.22个月。
抗血管生成药物似乎有助于EGFR突变患者的生存获益。一些转化研究表明,抗血管生成药物可以通过限制未成熟树突状细胞的NF-κB激活来增强免疫系统。这一发现得到了近期III期ORIENT-31试验的进一步支持,该试验在接受EGFR-TKIs治疗后发生疾病进展的EGFR突变NSCLC患者中,比较了信迪利单抗+化疗(联用或不联用IBI305)与化疗的疗效和安全性。结果显示信迪利单抗+IBI305+化疗组优于单独化疗组,中位PFS显著较长(6.9个月vs . 4.3个月;HR,0.46;p<0.001)。然而,与化疗组相比,信迪利单抗+化疗组有小幅PFS获益,中位PFS分别为5.5个月和4.3个月(HR,0.723;95%CI,0.552~0.948)。
一项研究探讨了基于CRISPR基因编辑手段改造的T细胞免疫疗法在难治性NSCLC患者中的安全性和实用性。改造的T细胞过继性转移带来了持久疗效。中位PFS为7.7周,中位OS为42.6周。然而,需要更多关于CRISPR基因编辑的数据和试验。
总体而言,ICIs对EGFR突变NSCLC患者的疗效有限。随着抗血管生成药物的加入,免疫治疗比单纯化疗显示出更好的疗效,表明抗血管生成药物在EGFR突变患者中的关键作用。ICI联合化疗和抗血管生成药物已成为这些既往接受过大量治疗的EGFR突变NSCLC患者的治疗选择。在既往EGFR-TKI治疗后发生进展的EGFR突变NSCLC患者中,关于化疗和免疫治疗联合策略的几项大型临床试验正在进行中(表3)。
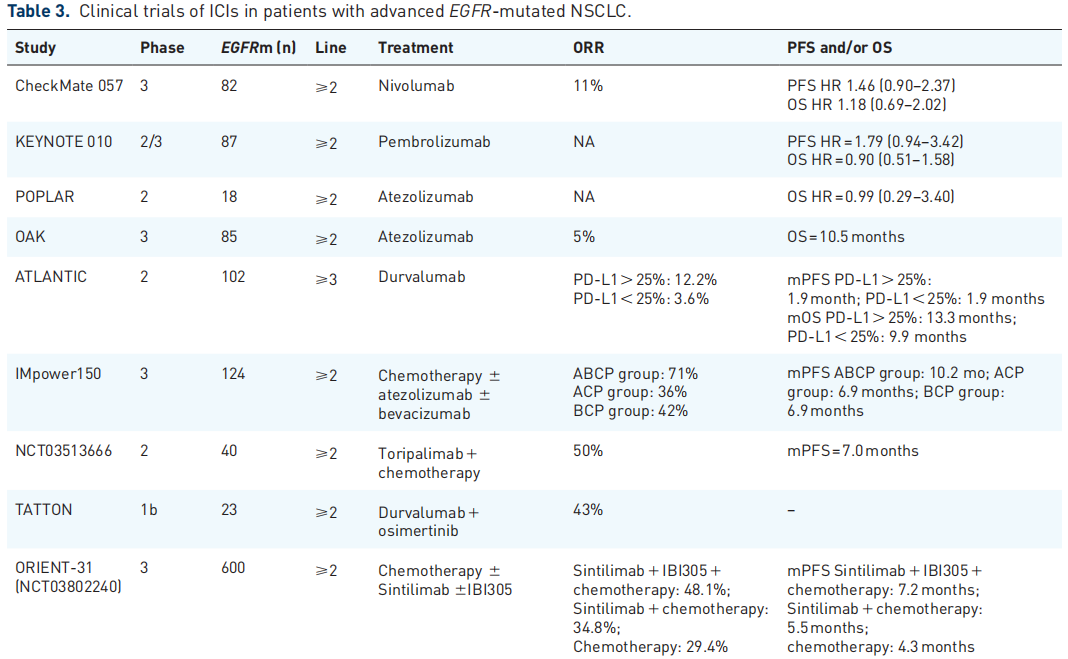
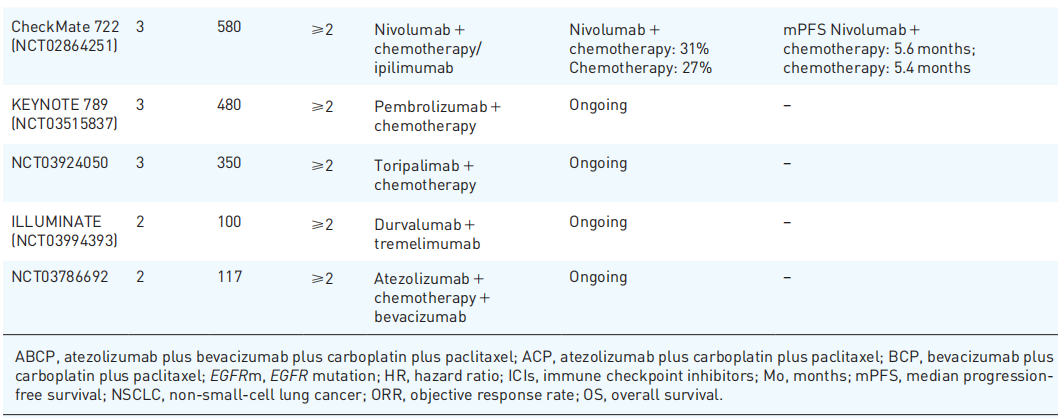
表3
中枢神经系统转移的治疗策略
EGFR突变肺癌患者更易发生CNS转移,大多数EGFR-TKI治疗失败可归因于CNS进展。中枢神经系统转移包括脑转移和软脑膜转移(LM),LM的临床预后不佳。BRAIN研究揭示了埃克替尼在EGFR突变NSCLC伴多发脑转移患者中的颅内活性,表明EGFR-TKIs在这种情况下是一种有前景的一线治疗选择。此外,在FLAURA和AURA3试验中,第三代EGFR-TKI奥希替尼作为CNS一线和二线治疗均显示出良好疗效。另外两种第三代EGFR-TKIs(阿美替尼和伏美替尼)在一线治疗中也显示出显著的CNS活性。在ANEAS试验中,阿美替尼治疗可评估的CNS病变的ORR为85.7%,中位CNS-PFS为29.0个月。在评估伏美替尼的FURLONG研究中,可测量CNS病变的ORR为91%,持续缓解为100%。这些研究巩固了第三代EGFR-TKIs在多发性脑转移患者一线治疗中的作用。
在LM患者中,双倍剂量奥希替尼的ORR为62%,中位OS为11个月。在对AURA系列研究进行的汇总分析中,标准剂量奥希替尼的LM抗肿瘤活性得到了进一步证实。另一种药物佐利替尼(zorifertinib,AZD3759)在一项I期研究中显示出对血脑屏障的有效穿透性和有前景的临床CNS活性,评估其CNS活性的随机III期研究结果将发表在2023年美国临床肿瘤学会(American Society of clinical Oncology)会议记录上。然而,在EGFR突变的NSCLC患者中,CNS进展仍然频繁,并且第三代EGFR-TKIs治疗LM后的后续治疗有限。最近的一项回顾性研究表明,根据LM的耐药机制,72.7%(16/22)接受匹配靶向治疗的患者获得了临床缓解,并显示继续奥希替尼联合强化治疗可延长未接受匹配治疗患者的生存期。放疗、神经外科手术、鞘内注射等局部治疗有效缓解了患者的神经症状。最近一项纳入30例LM患者的I/II期临床试验显示,鞘内注射培美曲塞的临床缓解率为84.6%,中位OS为9个月(95%CI,6.6~11.4),安全性可耐受。
对于EGFR突变疾病患者,治疗CNS进展仍然是一个未满足的需求,纳入活动性CNS疾病患者的试验很少。EGFR-TKI联合抗血管生成药物或放疗仍需进一步探索。此外,基于CNS转移机制或治疗反应生物标志物的治疗策略可能是有希望的。
专家见解
自IPASS研究以来,EGFR-TKIs已成为携带EGFR活性突变的NSCLC患者的标准一线治疗选择。晚期NSCLC的临床疗效显著改善。然而,在接受EGFR-TKIs或化疗进行大量治疗后,由于缺乏标准治疗方案,患者面临进一步的挑战。几十年来,改善患者的生活质量和生存率一直是人们关注的焦点。新药在标准治疗发生进展的患者中,显示出令人鼓舞的疗效,包括旨在克服EGFR C797S耐药的第四代EGFR-TKIs、EGFR-TKIs联合对应的靶向药物以克服脱靶耐药机制,以及用于抵消未知耐药变异的新型ADC和 ICIs。涉及这些新药或联合策略的临床试验正在进行中。因此,建议患者参与临床试验,这将提供另一种治疗选择,进一步加快新型药物的开发,最终使患者受益。ORCHARD试验是一项基于筛选生物标志物的研究,重点关注奥希替尼治疗失败的患者,旨在根据特定的耐药机制探索有效的疾病进展后联合策略。由于NGS的广泛应用,在标准EGFR-TKIs治疗进展后,必须根据耐药机制(包括EGFR依赖性耐药机制和非EGFR依赖性的旁路耐药机制)选择最佳疗法。
MET抑制剂、ADCs和ICIs似乎特别有效。多项II期临床试验已经证明,对于有获得性MET扩增的EGFR突变NSCLC患者,MET抑制剂和EGFR-TKIs联合治疗具有更好的疗效和可耐受的安全性。更多数据预计将从III期研究中获得。大多数在奥希替尼治疗期间出现疾病进展的患者(约30-50%)并未发现特定的耐药机制。因此,未来的探索应集中于攻克EGFR治疗耐药机制和开发新药用于耐药机制不明的患者,如ADCs和双特异性抗体药物。靶向每位患者特异性耐药基因的方法可能会在一定程度上局限治疗范围。因此,以ADCs为代表的广谱药物能够克服EGFR-TKIs的多重耐药机制,可能在大量治疗的EGFR突变NSCLC中发挥重要作用。德帕瑞妥单抗和Datopotamab deruxtecan令人鼓舞的初步结果提示,对于既往接受过大量治疗的EGFR突变NSCLC患者,ADCs可能是有前景的新型药物。此外,正如两项随机III期研究(ORIENT31和CheckMate772)所证明的那样,免疫疗法对EGFR突变NSCLC患者的疗效较小。免疫治疗和以铂类为基础的化疗联合抗血管生成药物可能是一种治疗选择。
今后应重点关注耐药性的预防。迫切需要识别可能容易发生耐药的患者,并给予适当的治疗以延迟或预防耐药。例如,对于EGFR突变伴TP53和RB1基因变异(这种共突变可能导致小细胞肺癌转化)的患者,可能建议采用更彻底的治疗,如EGFR-TKIs和化疗联合治疗。由于第三代EGFR-TKIs奥希替尼、阿美替尼和伏美替尼具有显著的CNS活性,并且可减轻或延缓CNS进展,因此这些药物应成为CNS转移风险高患者的一线治疗方案。此外,ctDNA对于进行全面的基因组分析、监测耐药和预测预后至关重要。因此,患者应接受ctDNA监测,以获得潜在有效的精准策略,这将有助于克服EGFR-TKIs耐药性。此外,确定EGFR-TKIs治疗患者的具体耐药机制并确定合适的治疗策略也至关重要。一些临床前研究表明,靶向CD70和CD24可能对于EGFR-TKIs耐药至关重要。靶向这些分子可改善获得性EGFR-TKI耐药患者的治疗结局。
随着对耐药机制的不断了解,克服EGFR-TKIs耐药机制的临床试验取得了重大进展。第四代EGFR-TKIs显示出克服EGFR依赖性耐药的潜力。EGFR-TKIs与相应的靶向药物(如MET抑制剂)联合用于治疗脱靶变异。此外,新型药物如ADCs也在探索中,以治疗无特定耐药机制的患者。我们的目标是改善患者的生活质量和OS。对于既往接受过大量治疗的NSCLC患者,预防或延缓EGFR-TKI耐药的发生、开发更广谱的药物至关重要。
参考文献:
Li YS, Jie GL, Wu YL. Novel systemic therapies in the management of tyrosine kinase inhibitor-pretreated patients with epidermal growth factor receptor-mutant non-small-cell lung cancer. Ther Adv Med Oncol. 2023 Aug 31;15:17588359231193726. doi: 10.1177/17588359231193726. PMID: 37667782; PMCID: PMC10475243.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







