辛颖教授:miR-222抑制病理性心肌肥大和心力衰竭
2024-03-14 医悦汇 医悦汇 发表于上海
虽然miR-222是心脏生长期所必需的,但它在压力过载时抑制心脏肥大,并减少不良重构和心功能障碍。miR-222靶向HMBOX1、NFATc3和PUMA,有望成为病理性心肌肥大和心力衰竭的治疗靶点。
编者按:心力衰竭的前期常伴有心肌肥大,而运动后生理性心肌肥大也常有发生。在生理和病理形式的肥大中发生显著变化的少数转录本通常会发生相反的变化,这表明两种形式的心肌肥大在机制上是不同的。本期文献内容由吉林大学基础医学院辛颖教授课题组许可分享肿瘤治疗相关领域及病理生物学研究领域最新进展,以供交流!
研究背景
心力衰竭的前期常伴有心肌肥大,而运动后生理性心肌肥大也常有发生。通过对转录组分和长链非编码RNA的无偏倚基因表达谱分析,作者发现在生理和病理形式的肥大中发生显著变化的少数转录本通常会发生相反的变化,这表明两种形式的心肌肥大在机制上是不同的。特别值得注意的是,长链非编码RNA lncExACT1在人类和心力衰竭动物模型的心脏中上调,而在运动训练中下调,抑制或过表达lncExACT1分别导致心肌生理性或病理性肥大。作者先前通过使用无偏倚转录分析确定了miR-222是在游泳训练和自主跑步两种运动中具有相同表达趋势的16种miRNA之一。已有报道证实健康运动员在急性和慢性运动后循环中miR-222上调,于是作者猜测急性运动后发生心力衰竭的患者中miR-222也上调。作者进一步发现,用锁核酸(LNA)修饰的miR抑制剂对小鼠miR-222的抑制完全阻断了运动后心脏的生长和发育。在心脏中miR-222过表达不足以诱导心肌肥大,但缺血损伤后过表达miR-222的小鼠心功能更好,较少出现纤维化和心室扩张。
在本研究中,作者报道miR-222在由压力过载引起的病理性心肌肥大和心力衰竭的横向主动脉收缩(TAC)模型中表达也增加。然而,与已证实的其促进心脏生理性生长的作用相反,miR-222实际上是通过靶向一组不同的基因来抑制病理性肥大以及相关的不良重构和心功能障碍。这些数据为病理性和生理性的心脏肥大在非编码RNA水平上的差异提供了新的证据。
研究结果
结果一:心肌miR-222在病理性心肌肥大和心力衰竭中表达升高
作者首先检测了心肌miR-222在TAC诱导的病理性心肌肥大和心力衰竭中的表达。在TAC后7天和14天,心脏重量(HW)与胫骨长度(TL)之比增加(图1A),而肺重量(LW)与胫骨长度(TL)之比没有增加(图1B),表明没有发生肺充血或心力衰竭。qRT-PCR检测的心脏基因表达与病理性肥大一致,利钠肽A(ANP)、利钠肽B(BNP)和β-MHC(Myh7)升高(图1C)。TAC后7天和14天,心脏中miR-222表达增加(图1D)。有趣的是,miR-222的初级转录产物pri-miR-222早在TAC后3天就增加了,并且在随后的时间点上没有显著的增加趋势(图1E),这表明miR-222早期的转录增加导致随后的表达增加。直到TAC后42天,小鼠出现了严重的心功能障碍,射血分数(EF)显著下降(P < 0.05)。在这个时间点,小鼠的HW/TL增加幅度更大(图1F),反映了心室扩张。LW/TL也大幅增加(图1G),表明肺充血与明显的心力衰竭一致。在衰竭的心脏中,miR-222的表达也比假对照组增加了大约两倍(图1H)。因此,在无心衰的病理性心肌肥大患者(TAC后7天)和明显心衰患者(TAC后6周),miR-222均升高。
为了确定miR-222增加的来源,作者在TAC或假手术后2周表现出心肌肥大的动物中分离心肌细胞和非心肌细胞。既往研究报道miR-208b主要在心肌细胞中表达,作者证实了TAC后心肌细胞中miR-208b升高并作为阳性对照。与以往研究报道的一致,假手术组miR-222在非心肌细胞中的表达高于心肌细胞。然而,作者观察到TAC后的心肌细胞中miR-222的表达显著增加(约两倍),而非心肌细胞中miR-222的表达没有显著变化(图1I)。miR-222的初级转录物pri-miR-222在假手术组的非心肌细胞中也比在心肌细胞中更丰富,但与成熟的转录物不同的是,它的表达量没有被TAC显著改变。有趣的是,与miR-222具有相同种子序列的同一簇miRNA miR-221在心肌细胞中的表达水平高于非心肌细胞,并且与miR-222一样,TAC后其在心肌细胞中的表达特异性增加。
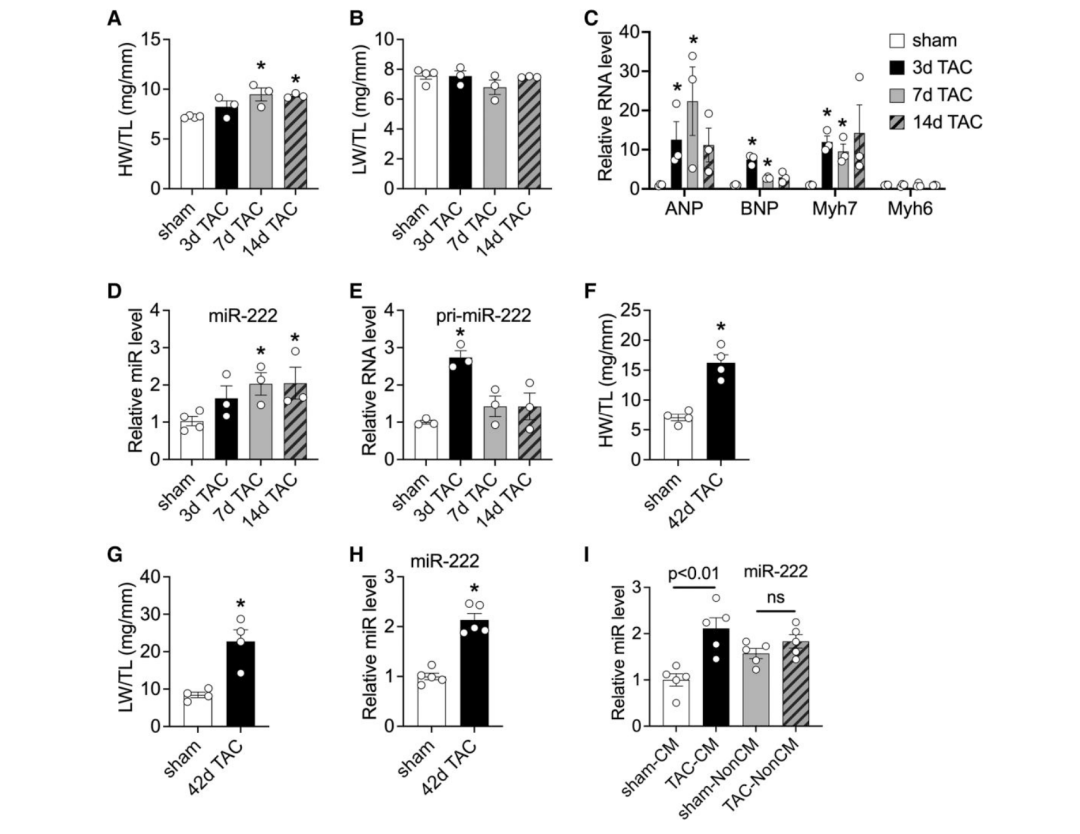
图1
结果二:抑制miR-222可加速病理性心肌肥大和心力衰竭的发展
为了确定miR-222上调在病理性心肌肥大和心力衰竭中的功能作用,作者使用了先前已经证明可以有效地特异性抑制miR-222的LNA-anti-miR-222治疗小鼠。qRT-PCR证实,LNA -anti-miR-222在注射后1周和3周均能有效抑制miR-222。虽然抑制miR-222对假手术小鼠的心脏功能和结构没有影响(图2A-C),但经LNA-anti-miR-222处理的动物在TAC后明显加速了心脏功能的衰退(图2A),并伴有心脏壁变薄(图2B)和左心室扩张增加(图2C)。值得注意的是,在TAC小鼠中,与LNA-anti对照组相比,miR-222的抑制不影响TAC的压力梯度或舒张功能。同样,与LNA-anti对照组相比,假手术动物的重量测量不受LNA-anti-miR-222处理的影响,治疗后1周和3周的HW/TL或LW/TL的比率没有差异。然而,在TAC后,尽管所有组的HW/TL均增加,但在TAC后1周使用LNA-anti-miR-222处理的小鼠心脏重量增加多于LNA-anti对照组的小鼠(图2D)。为了确定增加的心脏重量是否反映心肌细胞肥大还是仅仅反映了超声记录的心室扩张,作者测量了心肌细胞的大小。TAC后1周,LNA-anti-miR-222处理的小鼠心肌细胞明显大于LNA-anti对照组小鼠(图2E)。与LNA-anti对照组相比,LNA-anti-miR-222处理的小鼠在TAC后3周LW也增加(图2F),表明发生肺充血和心力衰竭增加,与超声显示的心功能障碍恶化一致(图2A)。程序性细胞死亡(凋亡)在病理性心肌肥大到心力衰竭的过程中起重要作用。TUNEL染色显示,在TAC后3周,与LNA-anti对照组的小鼠相比,miR-222的抑制导致细胞凋亡增加约两倍(图2G),表明miR-222抑制病理性肥大和心力衰竭的细胞凋亡。相比之下,在TAC后3周,miR-222的抑制并未改变纤维化(图2H)。综上所述,这些数据表明,TAC后miR-222的增加有助于减缓病理性肥大的发展,抑制细胞凋亡和心力衰竭的进展。
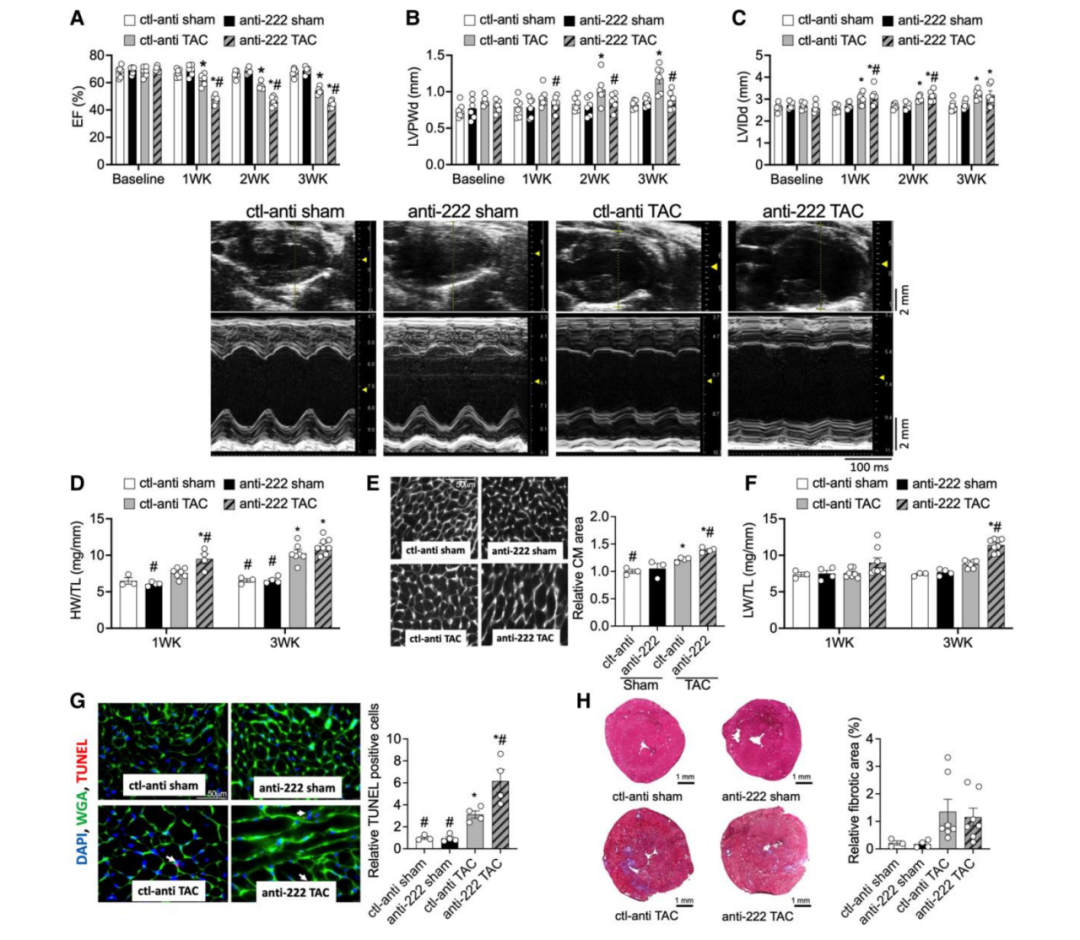
图2
结果三:心脏特异性表达miR-222可改善TAC后病理性心肌肥大和心力衰竭
由于miR-222可能是预防TAC后病理性肥大和心力衰竭所必需的,作者接下来探索上调miR-222是否可以预防这些疾病。作者建立了miR-222心脏特异性表达的转基因小鼠并且证实了转基因小鼠miR-222的表达比内源性水平高10倍(TgC-miR-222)。转基因表达主要在心脏中增加,qPCR显示其骨骼肌中也有适度增加。如前所述,即使转基因miR-222过表达10倍也不会改变心脏结构或功能,TgC-miR-222在HW/TL或LW/TL比率上没有差异,与同窝对照小鼠相比,心脏大小没有明显差异。
接下来,作者对4个月大的TgC-miR-222小鼠和同窝对照小鼠进行TAC处理。与经TAC处理的WT对照组小鼠相比,miR-222过表达不影响TAC间的压力梯度。超声心动图分析显示,在TAC后2周,TgC-miR-222小鼠的心功能(P < 0.01,图3A)更好,心脏室壁厚度更大(P < 0.01,图3B),心室扩张更小(P < 0.01,图3C和D),舒张功能略有改善,但不显著。TgC-miR-222小鼠的心脏重量也减轻,反映了心脏扩张受到抑制(HW/TL, P < 0.05,图3E)。有趣的是,miR-222的表达完全阻断了WT对照小鼠在TAC后2周的心肌细胞肥大(图3F)。此外,TAC处理后的WT小鼠中LW的增加表明TgC-miR-222小鼠心力衰竭显著受到抑制(图3G)。与年龄和性别匹配的WT对照组相比,TgC-miR-222小鼠的存活率也显著提高(78 vs.22% P < 0.05,图3H)。
为了探索潜在的机制,作者对纤维化和凋亡的标志物,如Cal3a1、MMP2、Casp1和Casp3进行了qRT-PCR验证。在TAC处理的TgC-miR-222小鼠中这些标志物有一部分被抑制(图3I和J)。相应地,TUNEL染色显示,与WT小鼠相比,TgC-miR-222的凋亡明显减少(图3K)。此外,在TAC后2周,miR-222的表达完全阻断TAC诱导的心脏纤维化(图3L)。综上所述,这些数据表明,心脏miR-222过表达足以抑制病理性心肌肥大,并阻止TAC诱导的细胞凋亡、纤维化和心力衰竭。
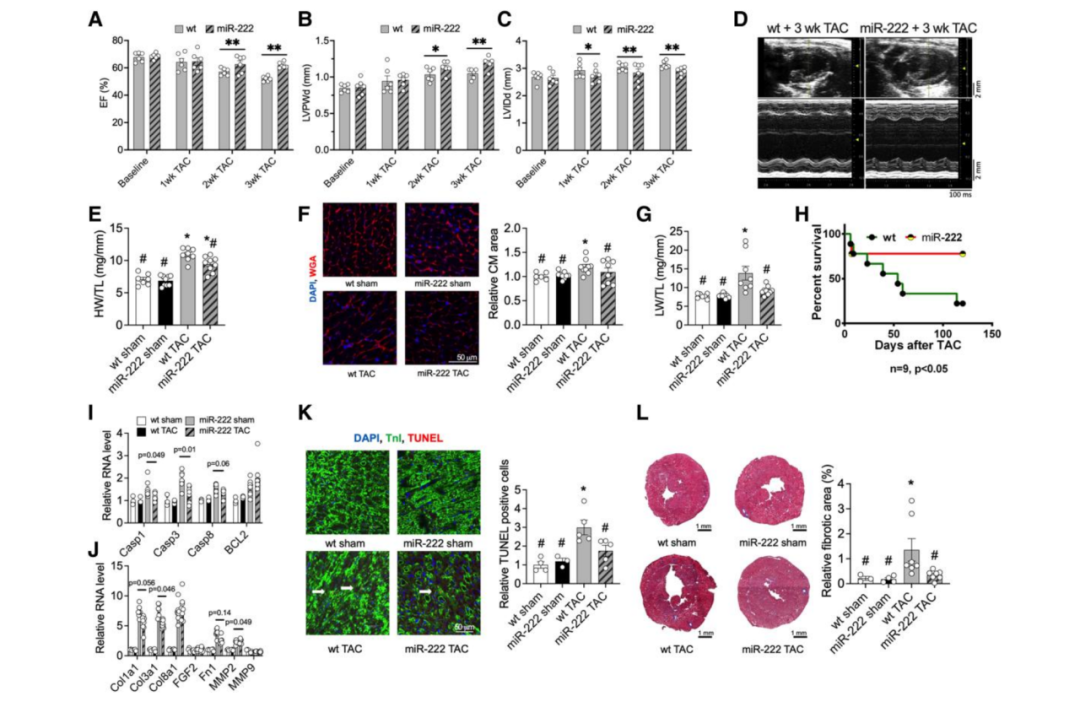
图3
结果四:miR-222靶向HMBOX1、NFATc3和p53正向细胞凋亡调控因子
为了研究TAC后miR-222作用的下游机制,作者在 TAC 一周后对4个月大的 TgC-miR-222 转基因动物和 WT 对照组进行了基于芯片的转录本分析。此时,转基因动物和 WT 动物的心脏功能开始有区别,这表明对这些组织进行分析可能会更深入地了解主要机制。作者将表达谱分析结果与作者之前在表达miR-222的大鼠心肌细胞中进行的表达谱分析(GSE59641)以及两个生物信息学程序(Targetscan, Pictar)预测的miR-222靶点和已知的miR-222靶点进行了比较。这些分析确定了三个潜在的miR-222靶点:转录因子Homobox containing 1 (Hmbox1),作者之前确定它是抑制心肌细胞生长的miR-222的直接靶点;NFATc3,以前未被认为是miR-222的靶点;p53正向细胞凋亡调控因子(PUMA),它是Bcl-2蛋白家族成员中的一个促凋亡的BH3蛋白家族成员,也是miR-222的已知靶点,但在先前的研究中未涉及。值得注意的是,遗传性缺失PUMA可以保护心脏免受凋亡和由此导致的功能障碍。Molkentin实验室先前的研究表明,通过基因干扰NFATc3可减少TAC后病理性心肌肥大。因此,miR-222协同靶向Hmbox1、NFATc3和PUMA有望减轻病理性心肌肥大,减少心肌细胞凋亡和心力衰竭。
由于Hmbox1和PUMA是miR-222的既定靶点,作者接下来探索NFATc3是否也是miR-222的直接靶点。作者进行了双荧光素酶基因报告实验发现miR-222的表达导致WT NFATc3 3ʹ-UTR结构的荧光素酶活性降低,但当 miR-222 结合位点发生突变时荧光素酶活性没有变化(图4A)。这些数据表明NFATc3 mRNA是miR-222的直接靶点。为了研究 NFATc3 在 miR-222 对心肌细胞影响中的功能性作用,原代心肌细胞在没有或通过腺病毒过表达 NFATc3 的情况下接受 miR-222 模拟物处理,并暴露于阿霉素(诱导细胞凋亡)或苯肾上腺素(诱导病理肥大)。多柔比星增加了乳酸脱氢酶的释放,从而增加了心肌细胞的死亡,并降低了细胞的活力(ATP含量减少)。这些病理作用被miR-222过表达降低,而miR-222的作用被NFATc3过表达减弱(图4B和C)。同样,苯肾上腺素诱导心肌细胞大小增加,其基因表达模式与病理性肥大一致(ANP、BNP、β/αMHC比值增加,PGC1α减少,图4D和E),但同时过表达 NFATc3则不会减弱(图4D和E)。这些数据表明,NFATc3是miR-222调节心肌细胞存活和肥大的直接下游靶点。
为了确定miR-222是否在体内调节这些靶点,作者对TAC后miR-222功能获得和功能丧失小鼠模型的心脏样本进行了免疫印迹分析。转基因miR-222表达抑制TAC诱导的NFATc3、PUMA和Hmbox1蛋白水平的升高(图4F)。相反,LNA对miR-222的抑制加剧了TAC诱导的NFATc3、PUMA和HMBOX1的增加(图4G)。有趣的是,p27(miR-222 在多种细胞和组织中的已知直接靶标)的表达并没有因为 miR-222 的表达或抑制而改变。这些数据表明,Hmbox1、PUMA和NFATc3是miR-222的直接靶点,很可能有助于 miR-222 在压力过载诱导的病理性心肌肥大和心力衰竭中发挥作用。
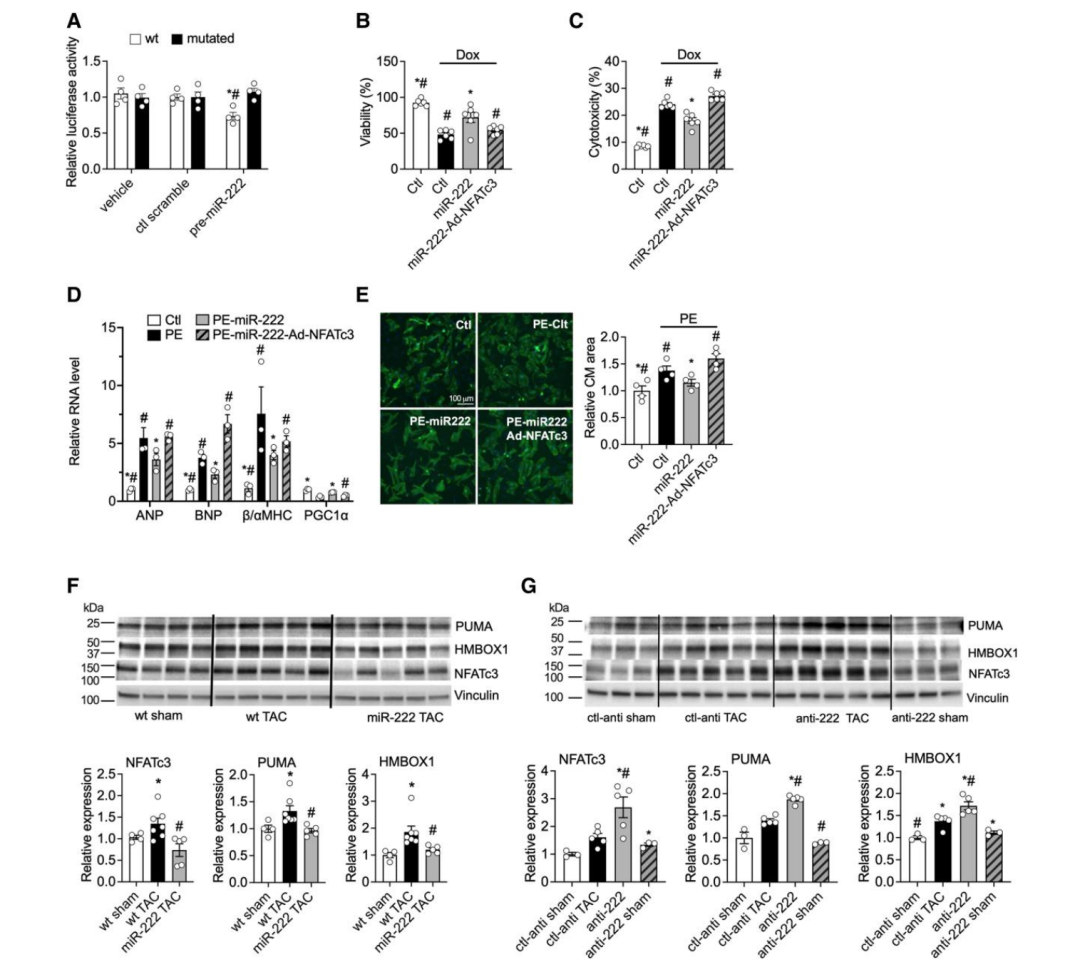
图4
研究结论
虽然miR-222是心脏生长期所必需的,但它在压力过载时抑制心脏肥大,并减少不良重构和心功能障碍;抑制miR-222可加速病理性心肌肥大和心力衰竭的发展,特异性表达miR-222可改善TAC后病理性心肌肥大和心力衰竭;miR-222靶向HMBOX1、NFATc3和PUMA,有望成为病理性心肌肥大和心力衰竭的治疗靶点。
原文出处:
Liu X, Li H, Hastings MH, Xiao C, Damilano F, Platt C, Lerchenmüller C, Zhu H, Wei XP, Yeri A, Most P, Rosenzweig A. miR-222 inhibits pathological cardiac hypertrophyand heart failure. Cardiovasc Res. 2023 Dec 12:cvad184. doi: 10.1093/cvr/cvad184. Epub ahead of print. PMID: 38084908.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#miR-222# #心肌肥大# #心力衰竭#
19