“可乐组合”再遭滑铁卢,在泛癌种道路上接连失利,但未来仍可期
2023-04-10 找药宝典 网络 发表于上海
pembrolizumab (Keytruda) 联合 lenvatinib (Lenvima) 挑战一线治疗晚期黑色素瘤和晚期结直肠癌失败
近日,默沙东发布新闻,宣告旗下的可乐组合——pembrolizumab (Keytruda) 联合 lenvatinib (Lenvima) 挑战一线治疗晚期黑色素瘤和晚期结直肠癌失败,两项Ⅲ期实验均未达到总生存期 (OS) 的主要终点。此前“可乐组合”已在一线治疗晚期NSCLC、晚期尿路上皮癌及肝癌三个癌种中进行了探索,不幸的是,这3项III期研究都惨遭失败。
 1.黑色素瘤:Ⅲ期 LEAP-003
1.黑色素瘤:Ⅲ期 LEAP-003LEAP-003是一项随机、安慰剂对照的Ⅲ期试验,旨在评估帕博利珠单抗
+仑伐替尼与单独使用帕博利珠单抗一线治疗成人不可切除或转移性黑色素瘤的效果。

研究参与者 (n = 674) 被随机分配为 1:1,在每个 3 周周期的第 1 天接受 300 mg 的静脉内 (IV) 帕博利珠单抗,联合或不联合口服仑伐替尼,每日剂量为 20 mg。符合 RECIST v1.1 标准的 OS 和无进展生存期 (PFS) 作为试验的共同主要终点。
来自该试验早期中期分析的数据表明,在该人群中,与单药帕博利珠单抗相比,双药显著改善了 PFS。然而独立数据监测委员会审查了计划的中期分析数据,结果发现,与单独使用帕博利珠单抗相比,帕博利珠单抗联合仑伐替尼并未改善总生存期(OS),基于此,默沙东/卫材宣布将停止 LEAP-003 Ⅲ期试验。
2.结直肠癌: Ⅲ期 LEAP-017
LEAP-017 是一项随机、开放标签的 Ⅲ 期试验,旨在评估帕博利珠单抗联合仑伐替尼对比瑞戈非尼或 TAS-102 对接受过治疗的 pMMR 或非 MSI-H 的不可切除和转移性结直肠癌患者的疗效,患者必须在接受标准治疗或接受标准治疗后出现进展,或者无法耐受此类治疗。
共有480名参与者按1:1随机分配,帕博利珠单抗(每6周周期的第1天 400 mg IV)加仑伐替尼(20 mg 口服,每天一次);或者瑞戈非尼(160 mg,在每个4周周期的第1至21天每天口服一次);或 TAS-102(35 mg/m2,在每个4周周期的第1至5天和第8至12天,每天口服两次)。试验主要终点是 OS,关键次要终点包括 PFS、ORR 和 DOR。
来自最终预设 OS 分析的数据表明,与瑞戈非尼或 TAS-102 相比,双联疗法有改善 OS 的趋势,但获益差异未确定具有统计学意义。研究人员还注意到,与瑞戈非尼或 TAS-102 相比,双联疗法在 PFS、ORR 和 DOR 方面有改善的趋势,但未根据预先指定的统计分析计划对这些结果进行统计显著性测试。
3.非小细胞肺癌:
Ⅲ期 LEAP-007
LEAP-007是一项评估帕博利珠单抗+仑伐替尼 vs 帕博利珠单抗一线治疗NSCLC的Ⅲ期、双盲、随机对照研究。
研究纳入≥18 岁,既往未接受治疗,IV 期 NSCLC,PD-L1 TPS ≥1%,ECOG PS 0/1,且无 EGFR、ROS1 或 ALK 突变。623 名患者按 1:1 随机分配至 帕博利珠单抗(200 mg IV Q3W,最多 35 个周期)+口服 仑伐替尼(20 mg/d )或安慰剂,直至疾病进展或出现不可耐药的毒性。主要终点是无进展生存期(PFS) 和 OS,次要研究终点是疾病缓解率(ORR)。
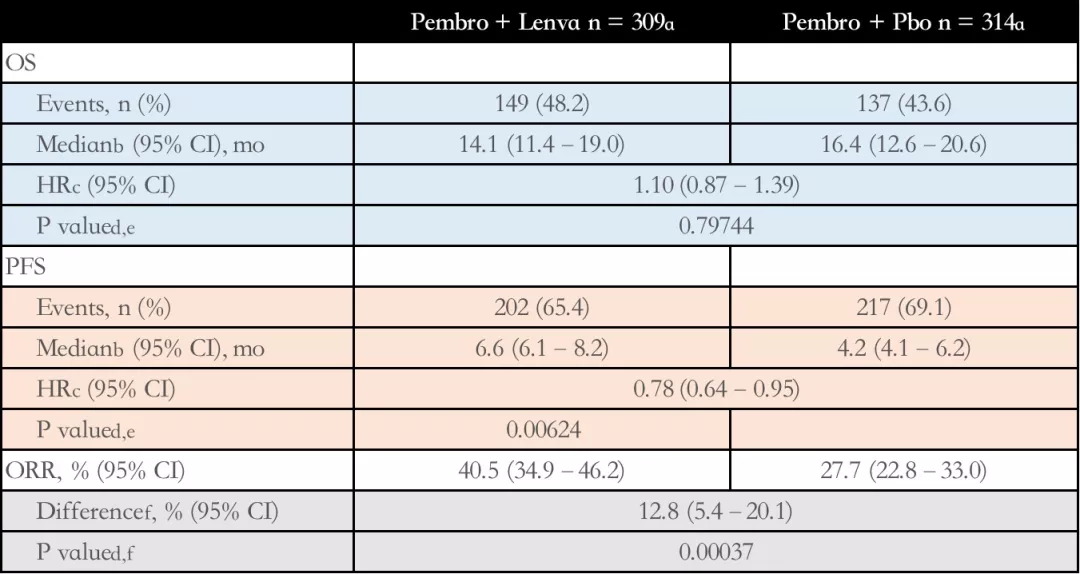
在2021 ESMO大会中,LEAP-007试验结果显示其达到了PFS主要终点和ORR次要终点,但错过了最重要的OS主要终点。
(1)帕博利珠单抗+仑伐替尼 与 帕博利珠单抗+安慰剂相比,中位 OS 没有改善,两组中位OS分别为14.1 vs 16.4个月(HR 1.10;95% CI 0.87–1.39;P = 0.79744)。
(2)与帕博利珠单抗+安慰剂 相比,帕博利珠单抗+仑伐替尼的中位 PFS 更长,两组中位PFS分别为6.6 vs 4.2个月(HR0.78;95% CI 0.64–0.95;P = 0.00624),相对于帕博利珠单抗+安慰剂,帕博利珠单抗+仑伐替尼降低了22%的疾病进展风险。
(3)与帕博利珠单抗+安慰剂相比,帕博利珠单抗+仑伐替尼的ORR更高,分别为40.5% vs 20.7%(P = 0.0037)。
(4) 安全性方面,帕博利珠单抗+仑伐替尼组和帕博利珠单抗+安慰剂组分别有57.9% 和24.4% 的患者发生 3-5 级治疗相关不良反应(AE)。
至于Leap-007为何错失OS终点,推测与较大毒性相关,毒性消耗了有效性带来的获益。
4.尿路上皮癌:
Ⅲ期 LEAP-011
在ASCO GU 2022年会上,公布了帕博利珠单抗(K药)联合仑伐替尼在不适合铂类化疗的晚期尿路上皮癌患者中作为一线治疗的临床III期研究(LEAP-011)最终数据。
结果显示,“可乐”组合相较于K药单药治疗没有显著提高无进展生存期(PFS)和总生存期(OS),毒副反应明显提升,研究未达到主要终点。

LEAP-011是一项评价可乐组合或帕博利珠单抗用于晚期尿路上皮癌患者一线治疗的国际多中心、Ⅲ期研究,主要终点是PFS和OS的联合终点,次要终点包括ORR、DOR、DCR、安全性/耐受性等。研究纳入了部分中国患者,旨在不适合接受顺铂治疗的PD-L1阳性肿瘤或不适合接受含铂化疗的局部晚期或转移性UC患者中比较一线帕博利珠单抗+仑伐替尼与帕博利珠单抗+安慰剂的疗效与安全性。
在441例参与随机分配的患者中,218例接受帕博利珠单抗+仑伐替尼(中位年龄74岁;ECOG PS 2,83.5%),223例(中位年龄73岁;ECOG PS 2,83.0%)接受帕博利珠单抗+ 安慰剂。
帕博利珠单抗+仑伐替尼组 对比 帕博利珠单抗+ 安慰剂组结果显示:中位治疗持续时间分别为3.8个月(0.0-20.7)vs 3.4个月(0.0-22.0);中位PFS为4.2个月(95%CI,3.8-5.9) vs 4.0个月(95%CI,2.7-5.4)(HR 0.91;95%CI,0.71-1.16);中位OS为11.2个月(95%CI,7.4-14.9) vs 13.8个月(95%CI,9.8-18.8);·6个月OS率为63.6% vs 70.7%;ORR为31.2% vs 26.5%。
综合而言,mPFS和mOS都没有显著优势,毒副反应明显升高,只有ORR具有相对优势。可乐组合一线治疗尿路上皮癌的III期临床研究以失败告终。
5.肝癌:
Ⅲ期 LEAP-002
LEAP-002是一项全球Ⅲ期研究,旨在确认仑伐替尼和帕博利珠单抗联合治疗一线晚期肝癌的效果优于单独使用仑伐替尼。这是一项全球性,双盲,安慰剂对照研究。每组约400名患者被随机分配接受仑伐替尼和帕博利珠单抗或仑伐替尼和安慰剂。双重主要终点是总生存期和无进展生存期。
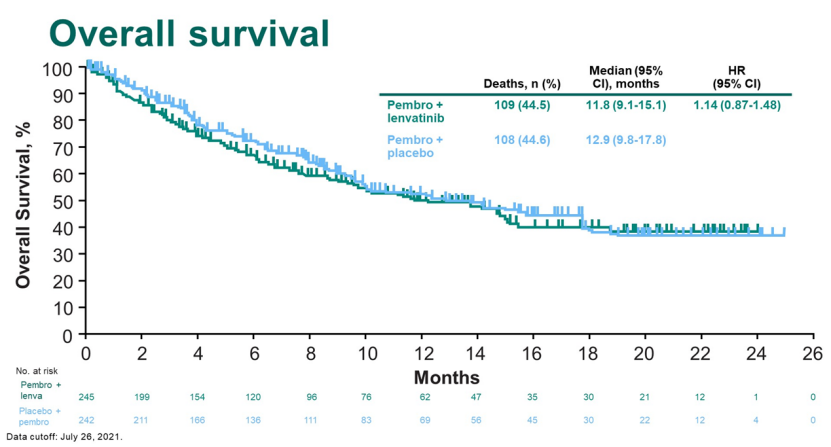
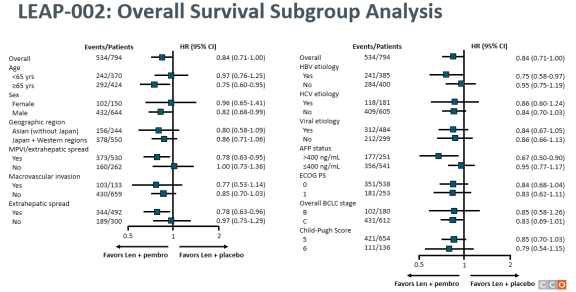
据2022年ESMO大会上发表的研究最终分析,尽管Ⅲ期LEAP-002研究的结果支持使用仑伐替尼作为不可切除肝细胞癌(uHCC)患者的一线治疗,但仑伐替尼与帕博利珠单抗联合使用未达到双重主要终点。总生存期(OS)的中位随访时间为32.1个月(范围25.8-41.1),仑伐替尼+帕博利珠单抗组与仑伐替尼单药组24个月的OS率分别为43.7% vs 40.0%(HR,0.840;95% CI,0.708-0.997;P=0.0227)。Geffen医学院肿瘤系医学教授Finn指出,“该研究没有达到0.0185的安全阈值。”

如森林图所示,亚组分析支持联合方案;Finn特别强调了大血管侵犯/肝外扩散(HR,0.78;95% CI,0.63-0.95)和AFP状态升高的高风险特征(HR,0.67;95% CI,0.50-0.90)。
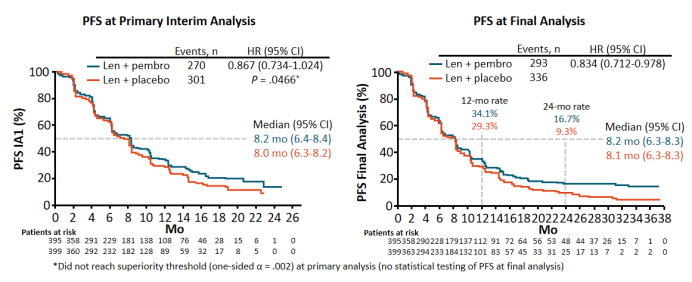
无进展生存期(PFS)的中位随访时间为17.6个月(11.3-26.6)。12个月PFS率分别为34.1%和29.3%,24个月PFS率分别为16.7%和9.3%(HR,0.834;95% CI,0.712--0.978)。结果不具备统计学显著性。
在最终分析中,仑伐替尼加帕博利珠单抗组中根据RECISTv1.1的中位DOR为16.6个月,而单独使用仑伐替尼为10.4个月。经BICR修改后的RECISTv1.1的中位DOR分别为11.2个月和8.5个月。
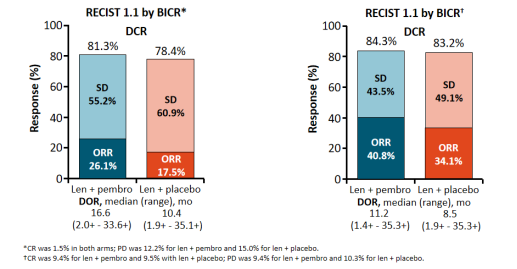
联合方案的总体缓解率(ORR)为26.1%,而单独使用仑伐替尼时为17.5%,疾病稳定(SD)率分别为55.2%和60.9%。根据BCIR修改后的RECISTv1.1,仑伐替尼加帕博利珠单抗的ORR为40.8%,而单独使用仑伐替尼的ORR为34.1%,其中CR率分别为9.4%和9.5%,PD率分别为9.4%和10.3%,SD率分别为43.5%和49.1%。
联合治疗方案的安全性与之前报道的数据一致,联合治疗组有381名患者(96.5%)和单药治疗组有378名患者(95.7%)发生任何级别的不良事件(AE)。仑伐替尼加帕博利珠单抗共发生4起5级事件,而单独仑伐替尼则发生3起。联合方案导致71名患者(18%)停止治疗,单药治疗组有42名患者停止治疗(10.6%)。
为了评估K药联合仑伐替尼治疗肿瘤的疗效,针对“可乐组合”布局了LEAP001-LEAP012共12项研究,上述5项研究的失利并不能完全否定“可乐组合”在其他癌种中的疗效。值得欣慰的是,“可乐组合”在子宫内膜癌、肾癌领域已获FDA完全获批,且在其他十大癌种中展现了非凡的实力。
2019年7月,FDA已授予K药与仑伐替尼组合突破性疗法认定,用于一线治疗不能局部治疗的晚期不可切除的肝细胞癌患者。同年9月,这对组合获FDA加速批准用于子宫内膜癌的治疗,2021年7月获完全批准。2018年,FDA授予“可乐”组合在肾癌领域的突破性疗法认定,2021年8月,FDA正式批准帕博利珠单抗联合仑伐替尼(可乐组合)一线治疗晚期肾细胞癌(RCC)的适应症。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言