医疗器械临床试验设计指导原则发布
近日,国家食品药品监管总局公布《医疗器械临床试验设计指导原则》(以下简称《指导原则》),明确了医疗器械临床试验设计的基本类型和特点、受试对象、评价指标等方面的技术指导原则。
中国医药报 - 医疗器械,临床试验,设计原则 - 2018-01-20
阿尔茨海默病新药LMTX三期临床试验失败,30年努力是否白费?
阿尔茨海默病新药LMTX三期临床试验失败,30年努力是否白费?<" border="0"> 来自新加坡生物技术公司TauRx研发的阿尔茨海默病(AD)新药LMTX在第一个三期临床试验中并没有如期达到主要研究终点,使得AD中的tau理论受到质疑,这是否意味着对此,TauRx表示应该乐观对待此次试验结果,因
MedSci原创 - 阿尔茨海默病,临床试验,LMTX - 2016-07-29
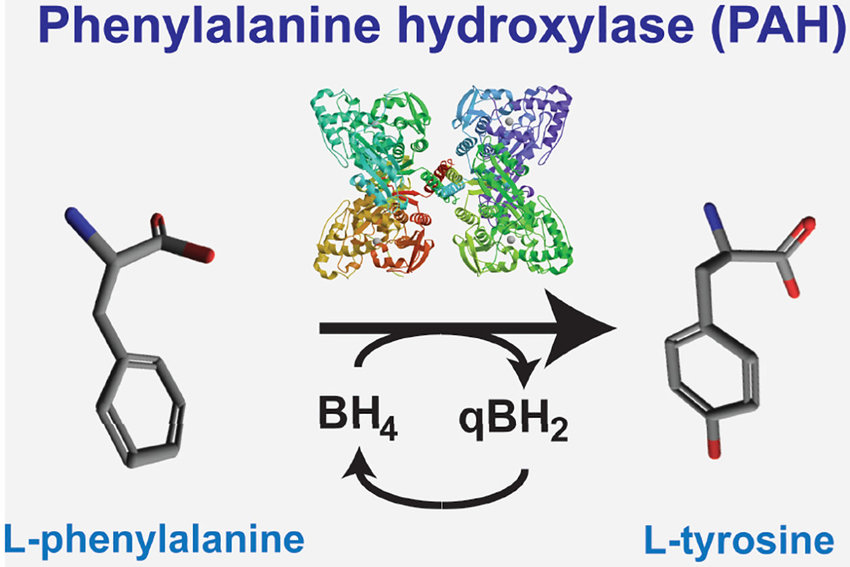
FDA暂停了苯丙酮尿症(PKU)基因疗法BMN 307的I/II期临床试验
在临床前试验中观察到致癌性(肝肿瘤)后,FDA 停止了在 PKU 成人中研究其 AAV5-苯丙氨酸羟化酶 (PAH) 基因治疗候选药物 BMN 307 的 I/II 期 PHEARLESS 试验。
MedSci原创 - 苯丙酮尿症,基因疗法BMN 307 - 2022-02-19
Catalyst制药宣布开展Firdapse治疗MuSK抗体阳性重症肌无力的IIb期临床试验
Catalyst是一家生物制药公司,专注于为患有罕见的慢性神经疾病的患者开发和商业化创新疗法,Catalyst近日公布了Firdapse(磷酸氨苄西林)治疗MuSK抗体阳性重症肌无力(MuSK-MG)的IIb期临床试验(MSK-001)的最新结果。
MedSci原创 - MuSK抗体阳性重症肌无力,Catalyst,Firdapse - 2019-01-06
化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(试行)
为鼓励创新,加快新药研发,提高申请人和监管机构沟通交流的质量和效率,在国家药品监督管理局的部署下,药审中心组织制定了《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(试行)》。
国家药品监督管理局药品审评中心 - 化学药品创新药Ⅲ期临床试验 - 2023-03-30
遗尿症中药临床试验设计与评价技术指南
《遗尿症中药临床试验设计与评价技术指南》为中华中医药学会标准化项目《儿科系列常见病中药临床试验设计与评价技术指南》之一。其目的是以临床价值为导向,主要是在病证结合模式下,重点讨论具有遗尿症疾病、儿童和
药物评价研究 - 遗尿症 - 2023-02-10
药物临床试验生物样本编码和标签操作指南
药物临床试验中一些重要数据基于生物样本的分析检测,生物样本的编码和标签识别的准确性和唯一性对保证研究质量十分重要,特别是对以药代动力学参数为终点的生物等效性研究、药动学研究等临床药理学研究尤为关键。
中国临床药理学与治疗学 - 生物样本,药物临床试验 - 2022-02-03
临床试验中缺失数据的预防与处理
缺失数据在临床试验中是非常常见且不可避免的。它一般是由于受试者在试验中失访、依从性差、不良事件、缺乏疗效等原因提前退出试验而造成,也可能是因为采集标本或测量中的问题,如疫苗临床试验中因采取的血液样本过少而未能检测到有效的抗体滴度值所造成的疗效指标缺失等缺失数据不仅会降低试验的把握度,而且会给试验结果的评价带来偏倚。因此,一方面,在数据统计分析时,采用适当的统计分析方法提高试验的检验效能,减小
药学学报 - 缺失,数据 - 2017-05-12
ACC 2015:将发布22项临床试验结果
本次大会共发布22项最新临床研究(Late-Breaking Clinical Trials)!PROMISE研究 稳定型冠心病患者的无创评估一直是心血管研究的热点,然而,目前并无相关大规模临床试验对这些评估策略进行比较. PROMISE研究是一项前瞻性的随机临床试验对两种冠心病
医学论坛网 - ACC,临床试验 - 2015-03-14
国际多中心药物临床试验指南(试行)
国家食品药品监督管理总局2015年第2号一、背景 近年来,药物研发日益趋于全球化,用于药品注册的国际多中心药物临床试验,已经从人用药品注册技术要求国际协调会(ICH)区域拓展到非ICH区域。药物全球同步研发,是一种共享资源的开发模式,可以减少不必要的重复临床试验,缩短区域或国家间药品上市延迟,提高患者获得新药的可及性。境内申办者为融入国际市场,也越来越关注全球同步研发。
NMPA - 多中心,药物,临床试验 - 2018-12-12
临床试验终点事件分类、定义采集与裁定
终点事件的分类 从预后角度分类,主要考核试验药物或治疗方法改善预后的疗效,一般都是与该疾病不良预后有关的事件。根据随访时间不同,可分为远期预后终点事件和近期预后终点事件。安全性终点是所有试验必须考核的。 最近,替代终点的使用问题在学术界引起热议。替代终点与临床效益有某种联系,但并不保证绝对相关。目前临床试验中,较多使用联合终点。使用联合终点的目的是能够更全面地考察试验对整个疾
中国医学科学院阜外心血管病医院 - 终点,试验 - 2013-08-01
临床试验的电子数据采集技术指导原则
为了促进我国临床试验电子数据的完整性、准确性、真实性和可靠性符合《药物临床试验质量管理规范》和监管部门相应技术指南的原则要求,有必要对临床试验中应用电子数据采集技术的基本考虑和原则进行明确阐释,本指导原则通过对电子数据采集技术的概念和基本考虑,电子数据采集系统的基本技术要求以及在临床试验实施不同阶段的应用要求的详细阐述,旨在帮助和指导相关各方,包括申办者、合同研究组织(CRO)、临床研究者等在临床
国家食药监总局 - 临床试验的电子数据采集技术,指导原则 - 2016-08-01
临床试验伦理审查知情同意书模版
GCP不允许受试者对试验不明了,或者强制性地参加试验,因此在开始试验程序之前,研究者必须得到受试者的知情同意书。知情同意(Informed consent, IC)实际上包括两个不可或缺的方面或步骤,其一,知情,即让受试者知晓和明了与临床试验有关的必要信息;
MedSci原创 - 知情同意书,临床试验 - 2013-09-24
药物临床试验中的几个重要环节
随着现代医药研究突飞猛进的发展,药物临床试验的研发也日渐增多。药物临床试验质量管理规范(GCP)[1]是国际公认的新药临床试验的标准。凡是以人为 对象的临床试验均应以此标准进行设计、实施、监查、记录和总结报告,以确保在科学与伦理道德两方面都符合GCP及国家政策法规的要求,既能保护受试者的权 益,又能保证其安全。
华西医学 - 临床试验,药物 - 2014-03-03
为您找到相关结果约500个