CCR:塞普替尼治疗RET融合阳性肺癌当心MET扩增,联合克唑替尼可克服!
2024-03-04 苏州绘真医学 苏州绘真医学 发表于上海
研究者验证了MET激活是靶向RET疗法耐药的可靶向机制,并在一系列单一患者方案(SPP)中将塞普替尼与MET/ALK/ROS1抑制剂克唑替尼(crizotinib)联合应用。

RET原癌基因编码一种受体酪氨酸激酶,该激酶在1%-2%的非小细胞肺癌(NSCLC)中通过基因融合被激活,而在其他癌症类型中很少被激活。塞普替尼(Selpercatinib)是一种高选择性RET激酶抑制剂,最近被FDA批准用于治疗有激活RET基因融合和突变的肺癌和甲状腺癌。对塞普替尼获得性耐药的分子机制尚不清楚。本文研究了在塞普替尼首次人体临床试验(NCT03157129)中接受治疗,并且发现MET扩增与塞普替尼耐药相关的患者。研究者验证了MET激活是靶向RET疗法耐药的可靶向机制,并在一系列单一患者方案(SPP)中将塞普替尼与MET/ALK/ROS1抑制剂克唑替尼(crizotinib)联合应用。
在接受塞普替尼治疗的4例RET融合阳性NSCLC患者的治疗后活检中发现MET扩增。至少1例患者在塞普替尼治疗前有明显的MET扩增。研究者证明,RET融合阳性肿瘤细胞中MET表达增加会导致对塞普替尼耐药,而塞普替尼与克唑替尼联用可以克服这一问题。使用SPPs,将塞普替尼和克唑替尼同时给药,产生了临床活性和耐受性的个例证据,其中1例患者缓解持续10个月。通过使用SPPs,研究者能够提供靶向耐药机制MET扩增的联合治疗,该耐药机制是在塞普替尼的首次人体研究中发现的。这些数据提示,在晚期NSCLC中,MET扩增是对选择性RET抑制剂疗法耐药的一个频繁出现和潜在的可靶向机制。
研究背景
靶向联合治疗是克服转移性癌症耐药的一种有说服力的治疗策略。然而,由于联合用药的毒性以及需要选择适当的患者,联合用药的临床开发一直具有挑战性。虽然有几种联合疗法被批准(例如在BRAF突变型黑色素瘤中,MEK抑制联合BRAF抑制;在ER+乳腺癌中,CDK4/6抑制联合内分泌治疗),但目前还没有药物组合达到监管部门批准的标准,可以有效治疗特定基因型患者对靶向TKI的耐药。由于靶向TKI的耐药普遍存在,因此克服获得性耐药的有效策略是延长临床获益的关键。为此,联合治疗仍然是癌基因依赖性非小细胞肺癌(NSCLC)令人信服的研究策略,数项临床试验正在进行中。
RET原癌基因编码一种受体酪氨酸激酶,在1%-2%的NSCLC中通过基因融合被激活,而在许多其他类型的肿瘤中很少见。RET基因融合是癌症驱动因素,在临床前显示了癌基因成瘾的关键特征。塞普替尼是一种高选择性和强效的抗RET TKI,最近报道了肺癌和甲状腺癌对塞普替尼的持久缓解,并且无论具体的RET变异或之前的TKI使用情况如何,以及在RET V804“看门人”突变的情况下,这些缓解都能保持。塞普替尼最近被FDA批准用于治疗这些癌症。对选择性RET抑制剂治疗产生获得性耐药的机制尚不十分清楚。虽然最近报道了RET激酶结构域的二次突变,但旁路通路的激活,如MET扩增,也代表了NSCLC中驱动基因耐药的频繁发生机制。在本研究中,研究者在4例对塞普替尼耐药且检测到MET扩增的RET阳性非小细胞肺癌患者(在所有三个中心登记的总共 79 名 NSCLC 患者中筛选)中进行了靶向MET扩增的联合治疗。这是通过使用多个单一患者方案(SPP)实现的,该方案允许快速向明确未满足临床需求的患者提供潜在有效的联合治疗。
研究结果
患者的病程及治疗史总结于表1。

表1
晚期NSCLC患者对塞普替尼的MET依赖性耐药:
病例1:
一名36岁女性,既往吸烟,患有IV期NSCLC骨转移,既往接受过大量治疗。分子检测通过FISH发现了RET重排(83%的细胞)和MET拷贝数增加(CNG,6拷贝)。患者开始接受阿来替尼治疗,阿来替尼是一种临床前具有一定程度抗RET活性的ALK TKI,在不到2个月内进展。对血浆循环无细胞肿瘤DNA(cfDNA)进行的二代测序(NGS)分析发现了EML4-RET融合(变异丰度AF:14%)。患者开始接受塞普替尼治疗,并达到临床缓解(肿瘤相关疼痛和厌食减轻),影像学上的肿瘤缩小(16周后肿瘤负荷降低21%,图1A,表1)。患者在4.5个月后出现进展,出现肝转移灶生长和颈部新发皮肤结节。皮肤结节活检显示转移性腺癌,NGS分子分析再次证实EML4-RET融合和MET拷贝数增加(56拷贝,图1B)。考虑到持续的临床获益,患者在疾病进展后继续接受塞普替尼治疗,总治疗时间为6.5个月。
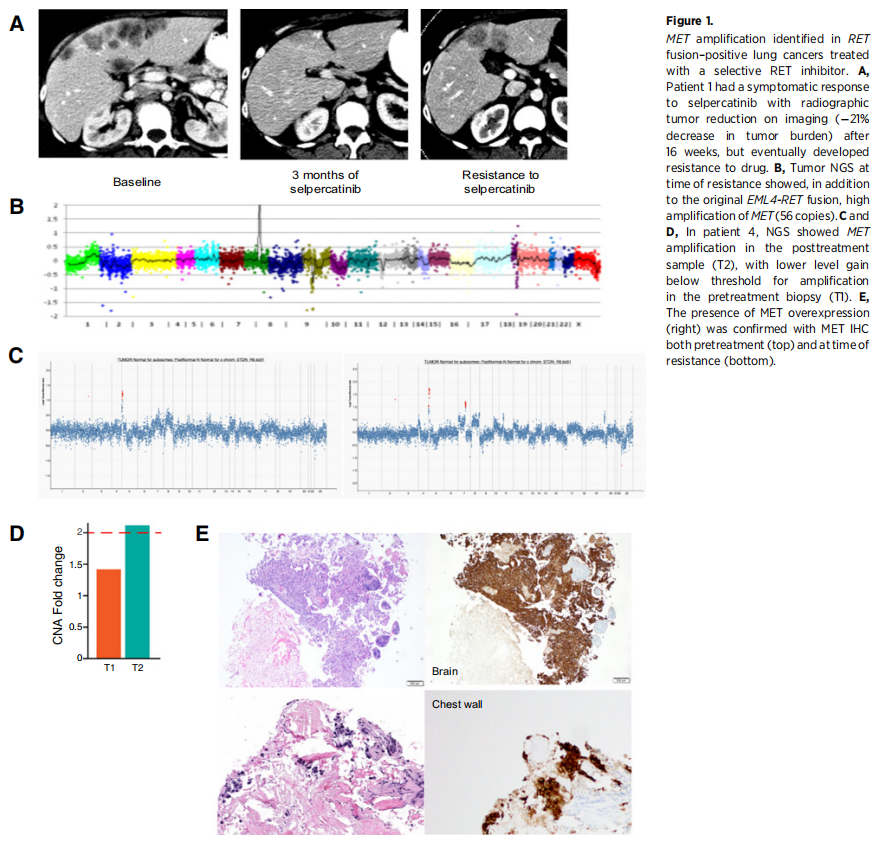
图1
病例2:
一名48岁男性患者,既往轻度吸烟,患IV期PD-L1阳性NSCLC,肿瘤NGS检测出KIF5B-RET融合。帕博利珠单抗一线治疗进展后,患者启动塞普替尼,并在3个月治疗后达到部分缓解(最佳缓解为靶病变减少49%,表1)。患者最终在塞普替尼治疗11个月后出现疾病进展。对治疗前和疾病进展后配对的肿瘤样本进行NGS分析发现,疾病进展后样本存在但治疗前样本完全不存在获得性MET扩增(9拷贝数)。
病例3:
一名69岁的亚裔男性,不吸烟,被诊断为IV期NSCLC,在出现单发脑转移后接受了开颅手术。肿瘤NGS检测发现脑内KIF5B-RET融合和MET扩增(18拷贝)。患者开始接受塞普替尼治疗,使肺结节缩小,临床症状改善,但患者也出现了新的左肾上腺结节,这表明疾病进展。对先前切除的脑转移瘤进行RNA测序,证实了高水平的MET mRNA表达。考虑到MET基因扩增和过度表达,患者随后开始克唑替尼单药治疗,再次表现出复杂反应,左肾上腺结节缩小,但右肾上腺结节和左肺门腺病增大,患者继续服用克唑替尼3个月。
病例4:
一名61岁女性患者,从不吸烟,患有IV期肺腺癌脑转移,PD-L1阳性。帕博利珠单抗一线治疗出现进展后,肿瘤NGS发现了KIF5B-RET融合,并启动了塞普替尼治疗。患者的最佳应答是疾病稳定(6周时肿瘤直径总和增加1%),但6个月后疾病进展并停止治疗。治疗后肿瘤的NGS分析显示MET扩增(倍数变化2.1),而治疗前活检显示低水平MET CNG,无明显扩增(图1C和D)。通过FISH,治疗后活检显示MET扩增(66%的细胞),而治疗前活检显示78%的细胞有MET扩增(3-6拷贝)。随后在两个时间点的样本中通过IHC证实了MET过表达的存在(图1E)。
临床前MET过表达导致对塞普替尼的获得性耐药,塞普替尼与MET抑制剂克唑替尼联用可能克服这一问题:
为了确定MET过表达对RET融合阳性肿瘤细胞对塞普替尼敏感性的潜在影响,研究者在HBEC-RET细胞中过表达MET。HBEC-RET细胞被设计为表达CCDC6-RET融合cDNA,并且对RET抑制剂敏感(图2A和B)。与同基因对照组相比(IC50=0.09 μmol/L),HBEC-RET+MET细胞对塞普替尼的敏感性要低得多(图2C和D;IC50=10.92 μmol/L),在MET过表达的情况下,生长抑制的IC50值变化超过100倍,提示MET过表达驱动了RET选择性抑制剂的耐药性。
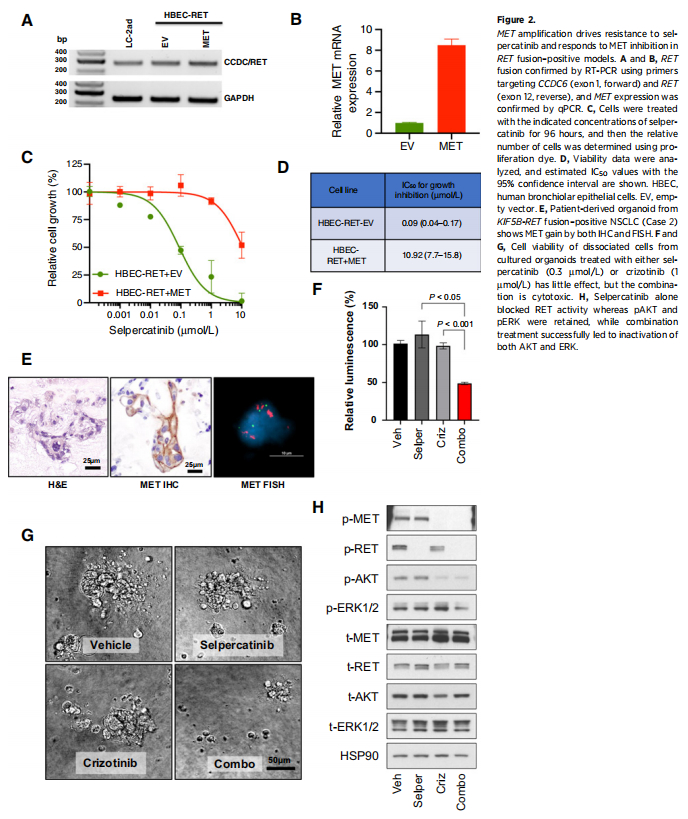
图2
此外,研究者从病例2患者的胸腔积液中分离出肿瘤细胞,并对其进行了类器官培养。通过MET FISH对类器官进行的分析证实了高水平MET扩增,IHC证实了高水平MET蛋白表达,这与塞普替尼治疗后的NGS分析一致(图2E)。塞普替尼或克唑替尼单药治疗的体外治疗无效,但塞普替尼和克唑替尼联合治疗显示出细胞毒性(图2F和G)。正如预期,只有联合治疗同时降低了磷酸化RET和磷酸化MET水平(图2H)。塞普替尼单独用药可阻断RET活性,而AKT和ERK活性保持,这可能表明该患者存在耐药机制。值得注意的是,克唑替尼单独用药可抑制MET和AKT信号传导,但对pERK无影响(图2H)。最后,联合治疗成功地导致了ERK和AKT的失活,这表明了该联合治疗在RET融合/MET扩增患者中的潜在作用机制。这些数据表明,MET扩增导致RET融合阳性NSCLC患者对塞普替尼耐药,塞普替尼和克唑替尼联合治疗可在临床前克服这一问题。
塞普替尼和克唑替尼联合治疗可克服患者的MET依赖性耐药:
研究者动力来自于塞普替尼的高选择性和安全性,以及在其他特定生物标志物的NSCLC患者亚群中将克唑替尼添加到其他靶向TKI中的已知可行性。因此,研究者使用FDA许可、IRB批准的SPP,对上述4例患者进行了塞普替尼和克唑替尼联合治疗。
病例 1(患者对塞普替尼反应轻微,治疗前MET CNG,治疗后MET扩增高)开始使用一半推荐II期(RP2D)剂量的塞普替尼(80 mg,每日两次)和一半批准剂量的克唑替尼(每天250 mg)。患者耐受这些剂量4周后,逐步增加剂量,直至分别达到RP2D/批准剂量(塞普替尼:每日2次,每次160 mg;克唑替尼:每日2次,每次250 mg)。患者仅出现轻度恶心,可耐受治疗。实时药代动力学分析表明,塞普替尼暴露与患者在塞普替尼单药治疗期间的暴露保持一致,而克唑替尼暴露与已发表的单药治疗期间的暴露保持一致。联合治疗1个月后,患者骨痛临床好转,然而,2.5个月后的扫描显示反应复杂:肝转移灶改善,但肺部疾病进展。由于骨痛的持续改善,患者继续接受总共3.5个月的研究治疗,然后死于癌症。
病例2(塞普替尼治疗后部分缓解持续11个月,并获得MET扩增) 开始了塞普替尼和克唑替尼联合治疗,药代动力学分析显示了用于单药治疗时每种药物的预期水平。患者对联合治疗有临床和影像学肿瘤缓解,气短缓解,肿瘤最大直径缩小38%。患者缓解持续了10个月,之后因肺部进展和腹水增加而停止治疗(图3A)。患者对治疗耐受性良好,不良事件(AE)为下肢水肿(可能与克唑替尼有关)和反流等。耐药活检的NGS显示RET融合持续存在,但MET基因扩增消失(图3B)。值得注意的是,唯一检测到的其他变异是ATM剪接变异[c.8988–1G>C(splice)]。
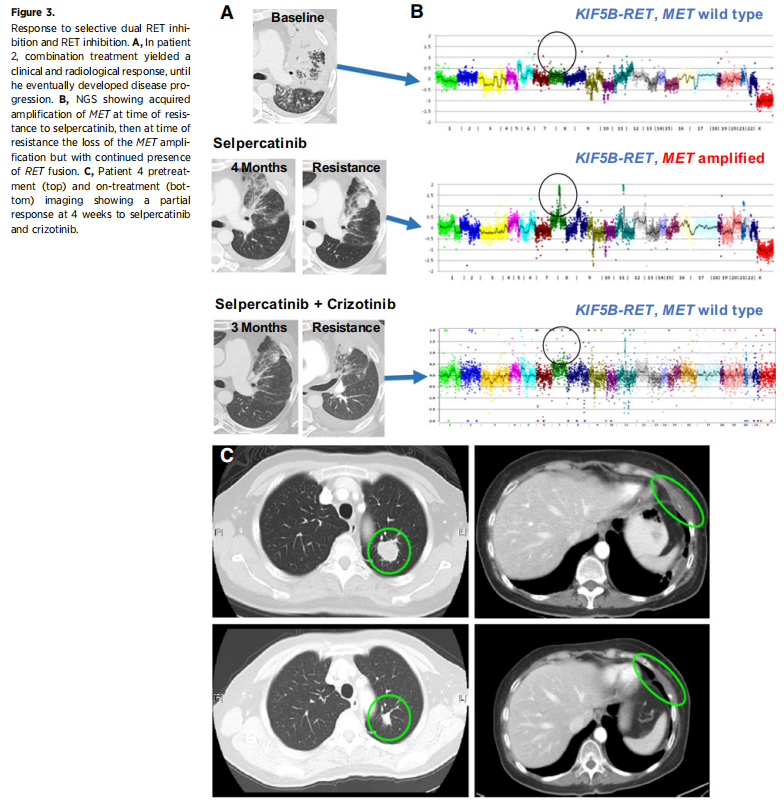
图3
病例3(患者在塞普替尼治疗中出现复杂应答,随后在克唑替尼治疗中出现复杂应答,治疗前MET扩增)继续接受克唑替尼治疗,同时重新开始塞普替尼治疗,剂量为每日2次,每次80 mg,之后增加剂量。在1.5个月的联合治疗后,患者达到了RECIST 1.1的部分缓解(肿瘤最大降幅低于基线42%)。患者在4个月后死于一项不相关的心脏事件。联合治疗的其他耐受性良好,无AEs。
病例4(患者对塞普替尼治疗获得疾病稳定的最佳反应,治疗前MET CNG,治疗后MET扩增)以全剂量塞普替尼(每日2次,每次160 mg)和克唑替尼(每日2次,每次250 mg)开始治疗。4周时,患者迅速达到部分缓解(-40%,图3C),左肺肿块和左胸壁肿块的疾病消退。虽然患者对联合治疗的耐受性良好,无与药物相关的不良事件,但患者发生了结肠炎(研究者确定与治疗无关),最终需要中断治疗和手术,患者选择过渡到临终关怀。
讨 论
研究者将MET扩增描述为RET重排NSCLC对塞普替尼耐药的可靶向机制。随着越来越多的患者对塞普替尼产生耐药,系统量化MET扩增和其他可能作为靶点的耐药机制(如最近描述的继发性RET突变)的发生率将具有重要意义。三个中心纳入了79例NSCLC患者,其中4例在该情形下检测到MET扩增,这确实为读者提供了这种类型耐药的罕见性的粗略估计。MET基因扩增水平在塞普替尼单药治疗期间明显增加,在这4例患者中,有3例在塞普替尼治疗前已经存在一定程度的MET扩增。这让人想起EGFR突变型NSCLC,在EGFR抑制剂治疗之前,基线时可能检测到具有高水平MET扩增的罕见克隆。值得注意的是,近期的一项早期EGFR突变/MET扩增NSCLC试验表明,奥希替尼(EFGR-TKI)和赛沃替尼(MET-TKI)治疗的ORR达44%。
据报道,塞普替尼治疗RET阳性NSCLC的中位无进展生存期为18个月,而相比之下,本研究的患者从塞普替尼治疗中获益的时间异常短。这种小幅PFS获益的原因尚不清楚,但这可能是由于这些患者基线时存在一定程度的MET扩增,或者可能与MET癌基因的侵袭性有关。此外,这些短暂缓解可能是由于存在其他驱动突变,要么可能是由于不同转移部位对塞普替尼耐药的异质性,要么可能是由于存在NGS未检出的其他亚克隆驱动突变。
为了更好地了解这一联合治疗的临床效果,需要前瞻性地研究塞普替尼+MET抑制剂联合治疗。此外,个体 SPP的治疗耐受性难以评估,但这些患者在治疗期间未诉有不可耐受的毒性,1例患者死于明显不相关的心脏事件,另1例患者发生了重度结肠炎。这两种不良反应被认为与该联合用药无关,但这些联合用药的潜在毒性需要在未来具有适当体能状态和合并症的患者队列中进行研究。最后,研究者希望使用更新、更特异的MET抑制剂,包括卡马替尼(已获得 FDA 批准)以及特泊替尼,与塞普替尼联用可能会提高疗效和更好的耐受性。
在这些SPPs中,由于已批准的第二种药物的可获得性,申办方愿意允许早期使用联合治疗和仍在首次人体试验中进行研究的研究性疗法,以及FDA和当地IRB对每个SPP的快速审核和批准,从而能够将可能有效的联合治疗快速递送给临床需求高度未得到满足的患者。研究者的经验进一步证明了对靶向治疗耐药的患者进行常规的、多癌基因panel的分子分析的重要性,以便能够在可以帮助每位患者的时间范围内识别潜在的可靶向的获得性耐药机制。这些病例为该方法的可行性提供了证据,在没有其他治疗方案的情况下,这可能使其他具有明确生物学原理的潜在有效联合疗法立即提供给个体患者,同时也提供了临床概念验证,这些临床概念验证可能在随后的前瞻性临床试验中进行验证。
参考文献:
Rosen, Ezra Y et al. “Overcoming MET-Dependent Resistance to Selective RET Inhibition in Patients with RET Fusion-Positive Lung Cancer by Combining Selpercatinib with Crizotinib.” Clinical cancer research : an official journal of the American Association for Cancer Research vol. 27,1 (2021): 34-42. doi:10.1158/1078-0432.CCR-20-2278

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肺癌# #克唑替尼# #塞普替尼#
28