Opdivo vs. Keytruda中国PD-1/L1市场的激烈角逐
2018-08-28 IQVIA艾昆纬咨询 IQVIA艾昆纬咨询
在新药审批加速,国家医保谈判的双重加持下,2018年无疑是中国靶向药和精准医疗的元年,面对高速增长的中国抗癌药市场,跨国药企“唯快不破”,只有快速抢占市场先机,才能更快地渗透市场。而本土药企需要另辟蹊径,找准深耕的适应症,凭借价格优势,抢占细分市场。 未来10年,拥有这些昂贵药物的药企,将打响一场激烈、持续的市场争夺战。 市场份额竞争一触即发 8月20日,中国首个PD-1单抗
在新药审批加速,国家医保谈判的双重加持下,2018年无疑是中国靶向药和精准医疗的元年,面对高速增长的中国抗癌药市场,跨国药企“唯快不破”,只有快速抢占市场先机,才能更快地渗透市场。而本土药企需要另辟蹊径,找准深耕的适应症,凭借价格优势,抢占细分市场。
未来10年,拥有这些昂贵药物的药企,将打响一场激烈、持续的市场争夺战。
市场份额竞争一触即发
8月20日,中国首个PD-1单抗Opdivo(欧狄沃,纳武利尤单抗注射液,Nivolumab)的价格公布。官方零售价建议100mg/10ml 9260元;40mg/10ml 4591元,其用法用量为3mg/kg,如果按患者的体重为60kg计算,每两周静脉注射一次;一次需使用1支100mg/10ml和2支40mg/10ml,每两周花费18442元,一个月共计花费36884元。50kg的患者以此推算,每月花费27702元。
在早前Opdivo的上市沟通会上,百时美施贵宝中国大陆及香港地区总裁赵萍就表示,将通过实施多元化的举措、响应各级医保谈判等方式,促进Opdivo在中国的可及性。
在美国,根据FDA在2016年9月批准修改后的Opdivo给药方案,非小细胞肺癌患者按照“每2周1次,每次240mg”给药,直至疾病无进展或出现不可耐受毒性。Opdivo 240mg规格在美国的定价大约是6500美元,不考虑商业保险的因素,一年的治疗成本约为16.9万美元(约合108万元人民币)。国外临床上一般连续使用两年后停药。而在亚洲其他地区,以100mg/10ml的Opdivo为例,日本的价格最高,今年初调价后还需要约2万多元一支;新加坡的价格是1.5万元一支;香港地区的价格约为1.6-1.7万元一支。
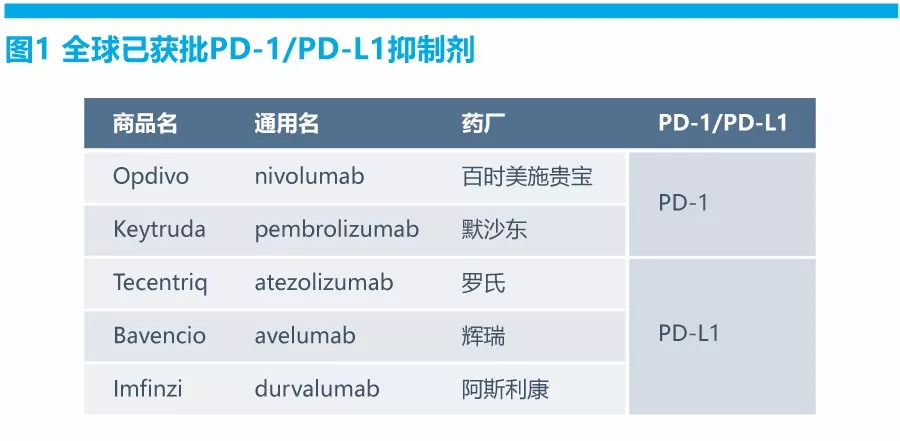
目前,多家跨国药企和中国本土企业都在研发PD-1药物,截至2018年7月,全球共有5种PD-1/PD-L1获批上市(见图1)。在中国,除了BMS的Opdivo和默沙东的Keytruda,恒瑞、信达、君实3家企业也已经提交了上市申请,并被列入优先审评通道。企业在PD-1/L1药物赛道上的竞速或促使了BMS在中国采取更“亲民”的定价策略,以率先占领市场。
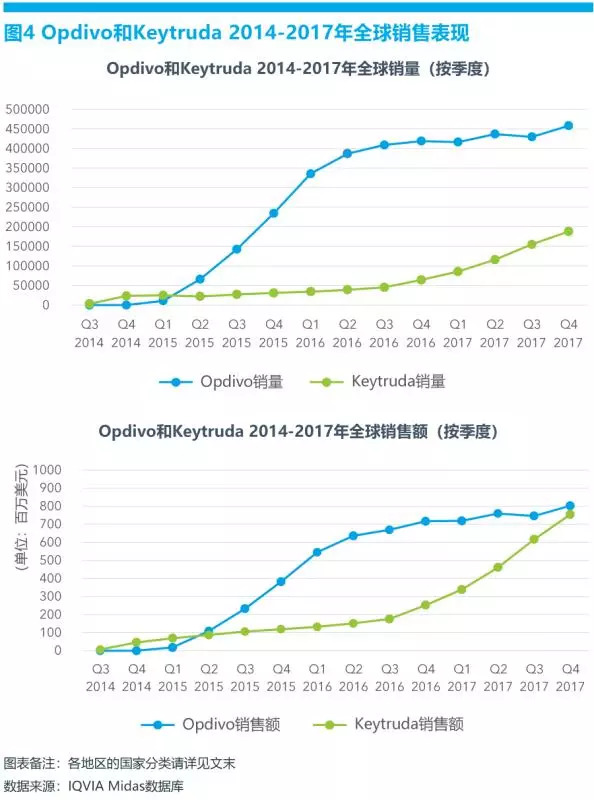
据IQVIA全球药品销售数据库(Midas)显示,2017年,Opdivo全球销售额超过53亿美元,Keytruda销售额超过35亿美元。Opdivo在美国和欧洲5国的市场份额最大,分别占到其总销售额的58.6%和19.5%,亚洲主要市场潜力巨大,市场份额占到13.4%;Keytruda在美国和欧洲5国的市场份额分别占到其总销售额的63.6%和16.1%。

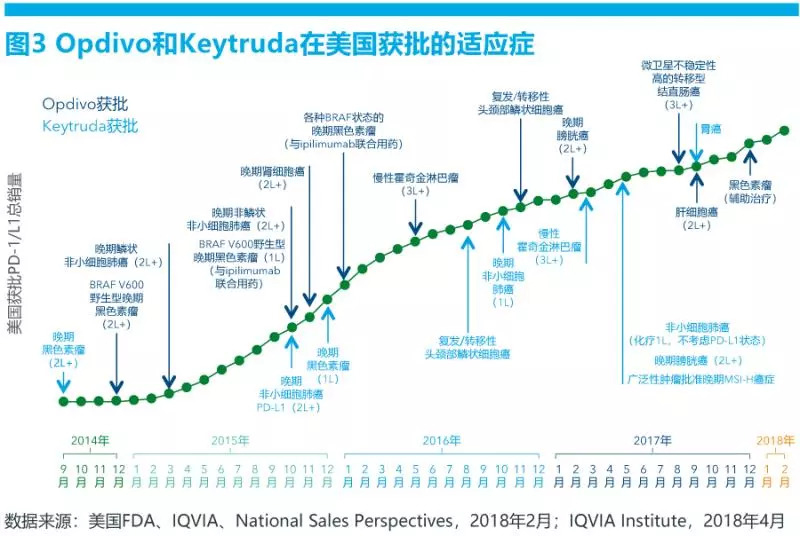
从2014年至今,Opdivo和Keytruda的多个适应症陆续获批(见图3)。随之开启的,是不同治疗领域带来的市场容量扩增。
根据IQVIA Midas数据库显示,从Opdivo和Keytruda的全球季度销售数据可以看出一些规律,新适应症的获批是药物销量和销售额增长的主要推力之一(见图4)。Opdivo于2015年3月获FDA批准用于晚期鳞状非小细胞肺癌二线治疗,当年二季度的销量较上一季度增速一度高达509%;2015年10月,Opdivo分别获FDA批准用于晚期非鳞状小细胞肺癌二线治疗和与ipilimumab的联合用药治疗晚期黑色素瘤,当年四季度和次年一季度的销量增长较前一季度分别达64%和43%;而Keytruda的销售额历史变化也显示了类似的规律,2016年三季度,Keytruda获批治疗复发/转移性头颈部鳞状细胞癌、晚期非小细胞肺癌一线治疗和慢性霍奇金淋巴瘤等,当年四季度销量比三季度增长42%。因此,新增适应症,从而迅速扩大药物市场规模,成为各大药企抢占市场和差异化竞争的重要策略之一。未来,Opdivo和Keytruda仍将以强劲的势头增长,更多的适应症将获批,预计到2025年,两者的全球销量均可能超过90亿美元。
除了多家药企都在致力于加速PD-1/L1在中国的上市,实力强劲的跨国企业和后发布局的国内企业均在加大力度开展联合用药试验,以破解单药治疗有效性和应答率有限的问题。如,BMS针对Opdivo的临床试验备案接近600项,其中有9项重点开发的联合用药临床试验已经达到Ⅲ期;默沙东针对Keytruda的600余项临床试验备案中,联合用药临床试验已超过400项。
本土药企怎么定价?
按照中国新药审批加速的情况预估, 2018-2019年将是国内市场PD-1/PD-L1单抗集中获批上市的关键时间节点。
恒瑞医药PD-1单抗产品,2017年4月进入III期临床,2018年4月,被纳入优先审评程序药品注册申请名单。信达生物去年12月作为国内首个提交PD-1单抗(IBI308/信迪利单抗)的企业,之后主动撤回申请,于2018年4月重新提交,与恒瑞、君实的PD-1抗体药物一同被列入优先审评名单。
跨国药企走在了研发的最前沿,那么国内药企如何获得差异化竞争?IQVIA认为应对之策有三。
其一,适应症是本土药企的王牌之一。通常跨国药企会在美国和欧洲率先获批不同的适应症,在地区本土化的过程中,跨国药企也会充分考虑当地的高发类型、环境条件、发病机理等多种复杂因素,例如,Opdivo在中国首个获批适应症即是中国发病率最高的非小细胞肺癌。后发的国内药企,在适应症申请上可以避开跨国药企已获批的适应症,规避与巨头正面交锋,抢夺市场的局面。
其二,本土药企的药物研发全然是针对中国患者“量身定制”的创新药。虽然跨国药企的药品在进入中国市场前,会进行桥接试验,以支持临床数据的有效性、安全性,同时调整用药剂量和给药方案,但是本土药企的各个试验阶段都采用了本土受试患者,在临床数据上相对更有说服力。这可以成为支持药物推广的有效观点。
其三,因为整体研发成本较跨国企业低一些,本土企业有条件在医保谈判以价换量的情况下,实现销量的快速增长。根据德意志银行的预测,中国患者能够承受的药费大概是25万元/年;20%的晚期癌症患者接受PD-1/L1药物治疗,其中60%的患者可以负担报销后的剩余自负费用。考虑到可负担性,癌症患者可能会更倾向于选择性价比更高的国产PD-1/L1药物。
结语
在今后十年,各大医药公司的PD-1/L1产品将陆续登陆中国市场,只有拿着多适应症的利剑,戴着价格优势的盔甲,才能笑傲江湖,不惧谁与争锋。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Opdivo#
32