FDA合作推动在印度进行临床试验的安全和质量
2017-07-14 By Leslie Ball, Letitia Robinson, and Elizabeth Wiley FDA Voice
经过16个多小时的飞行,我们深夜在孟买机场降落,当我们离开机场候机楼时,立刻被一阵热拉潮湿的空气包围。坐在机场去往酒店的车上,孟买庞大的天际线让人惊讶不已。这就是印度,拥有世界17%的人口,但却占据了约20%的全球传染性疾病和非传染性疾病总量。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




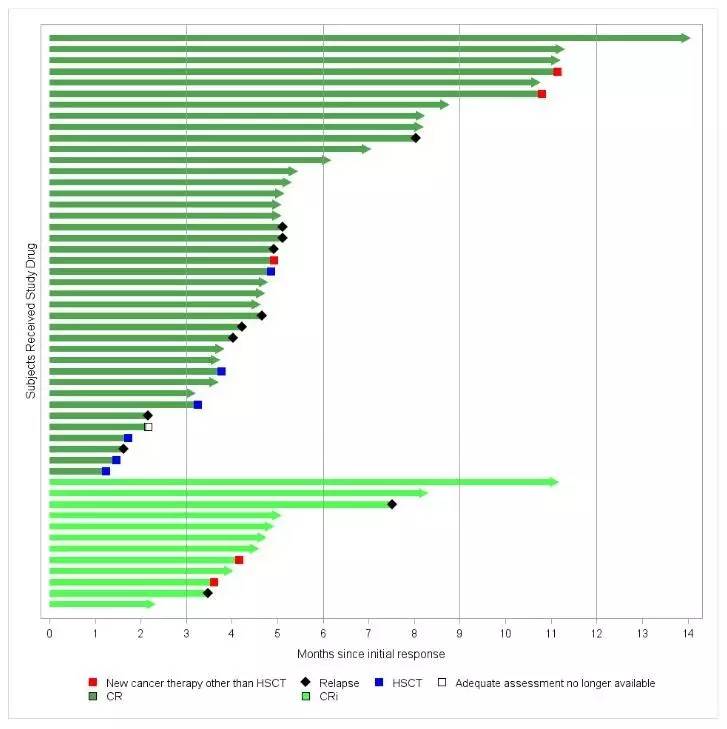







虽然科学无国界?
69