Circulation:SOX17增强子变异体破坏转录因子结合,增强子失活导致肺动脉高压
2023-04-25 刘少飞 MedSci原创 发表于德国
内皮转录因子SOX17上游的两个常见遗传变异如何增加易感性。
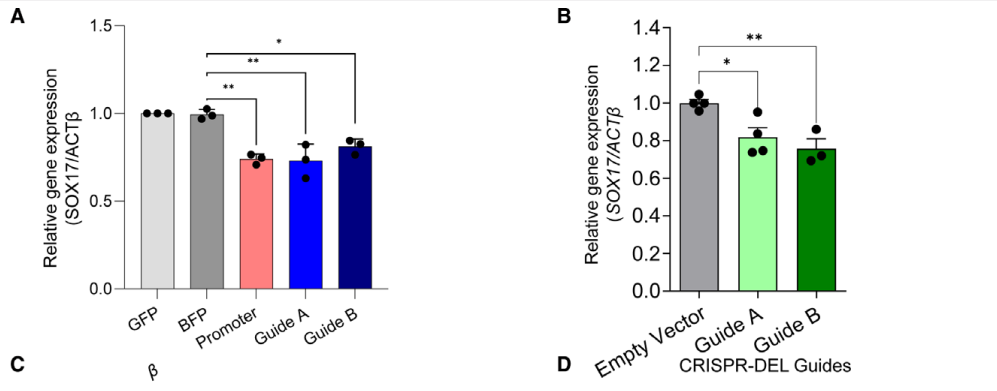
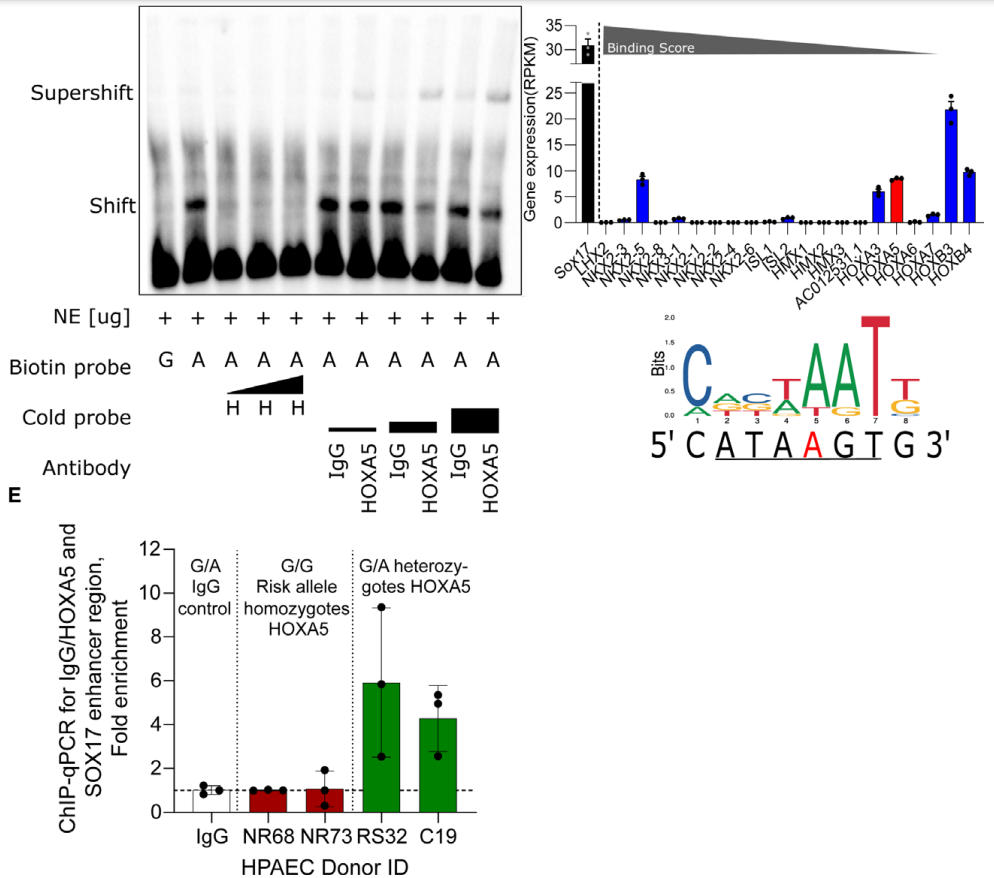
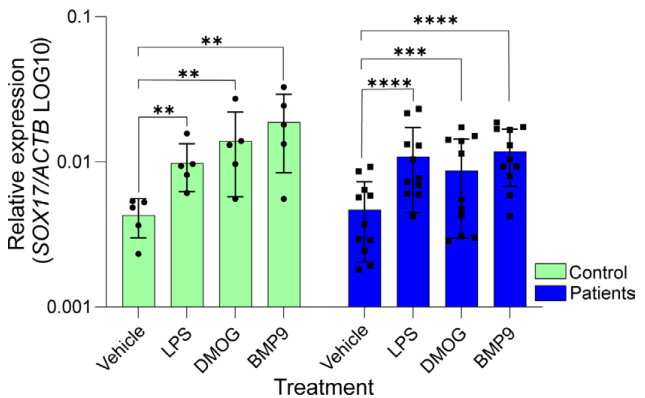
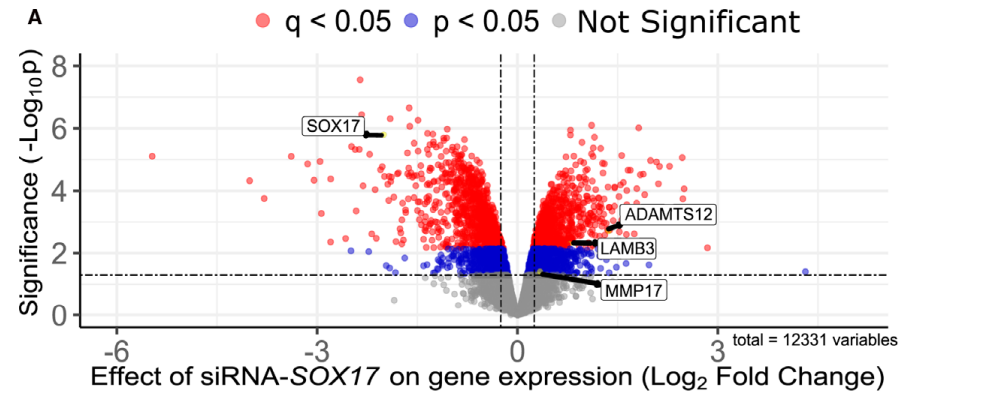
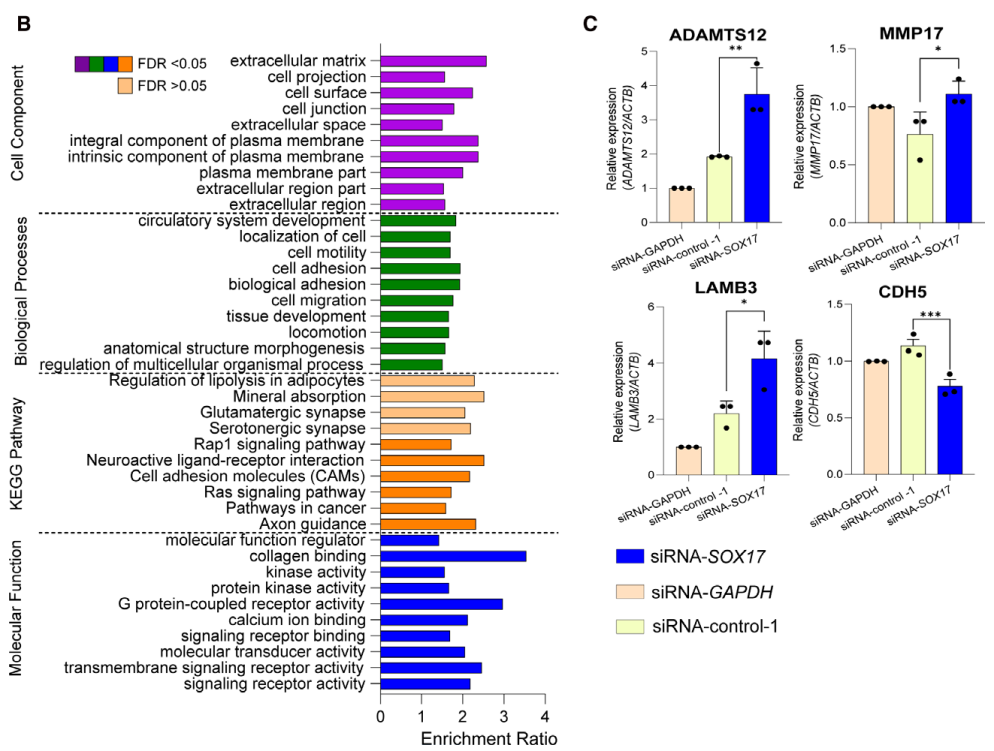
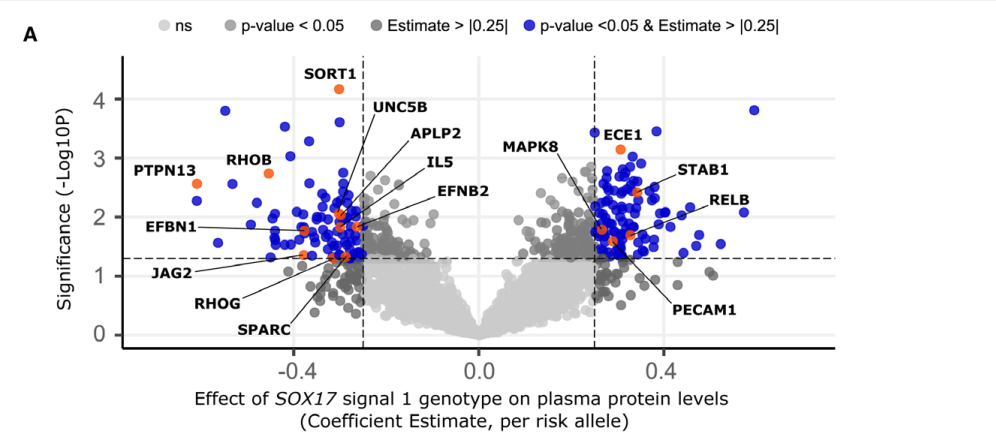
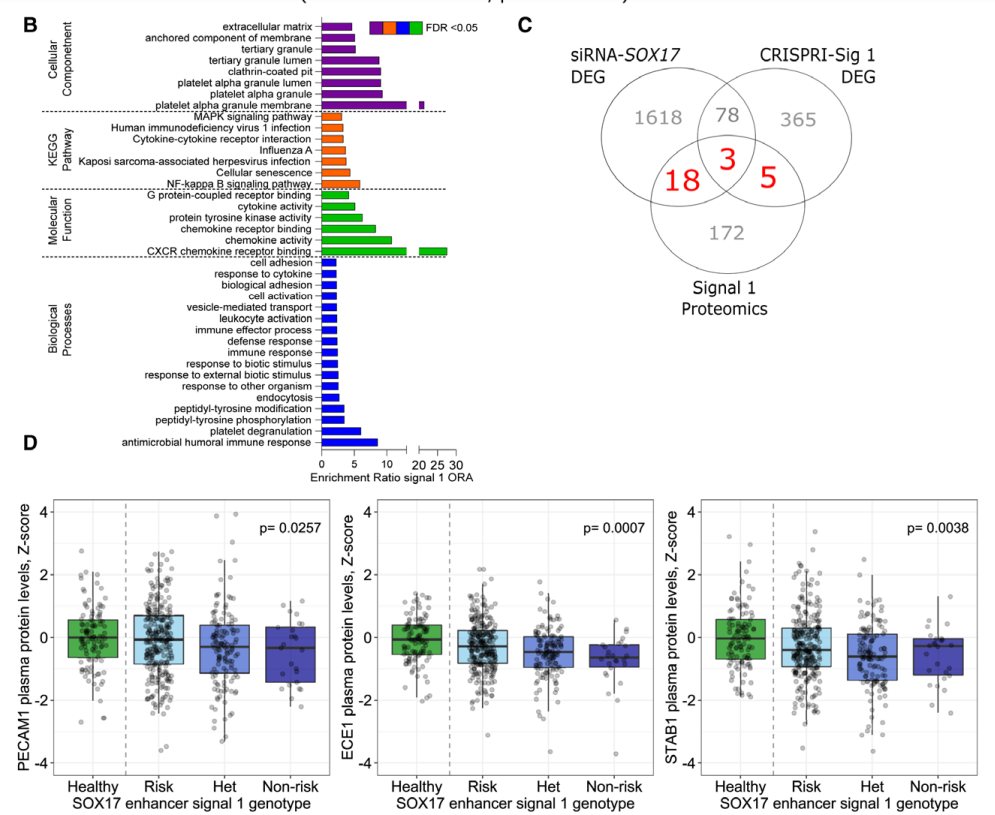
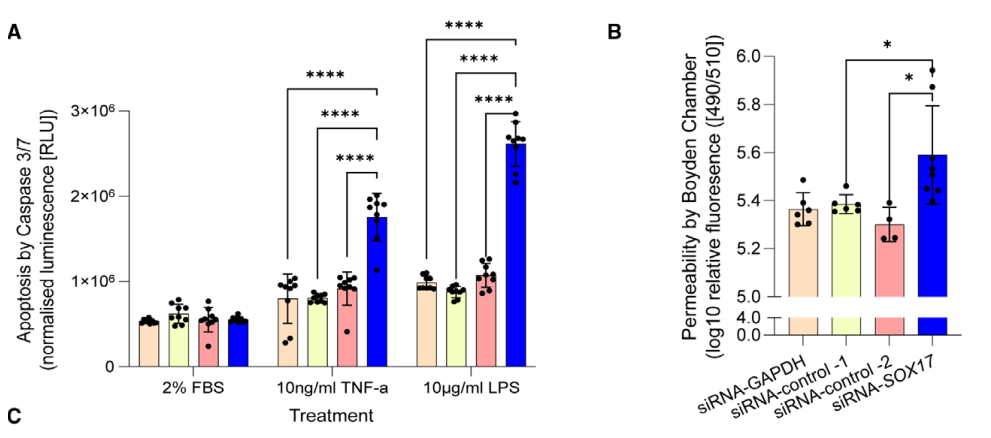
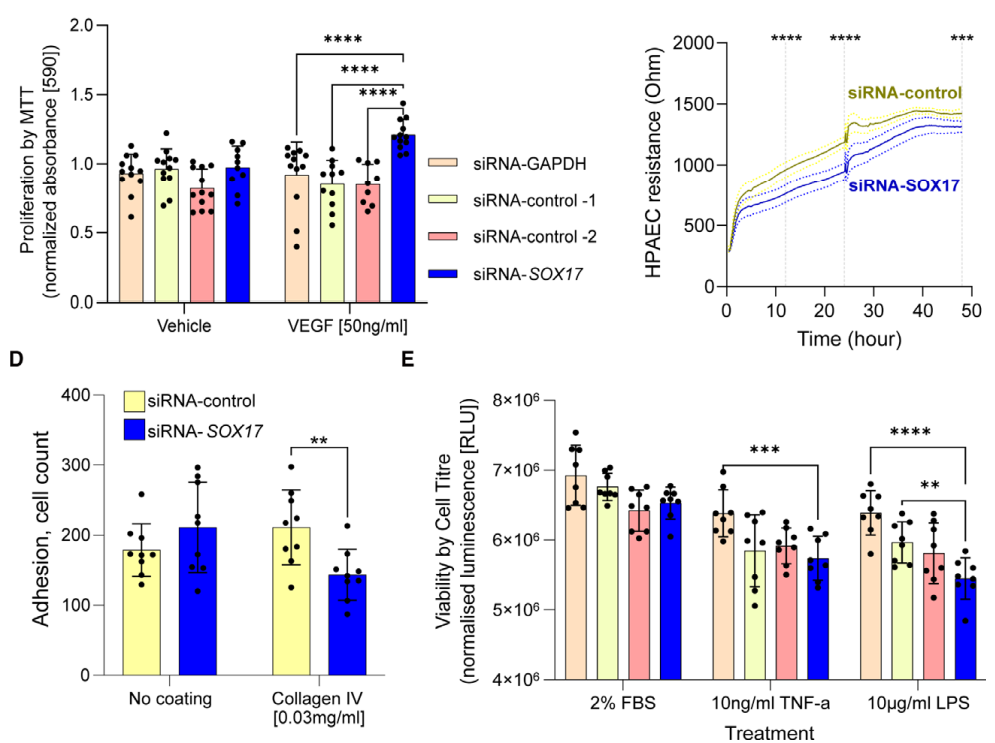
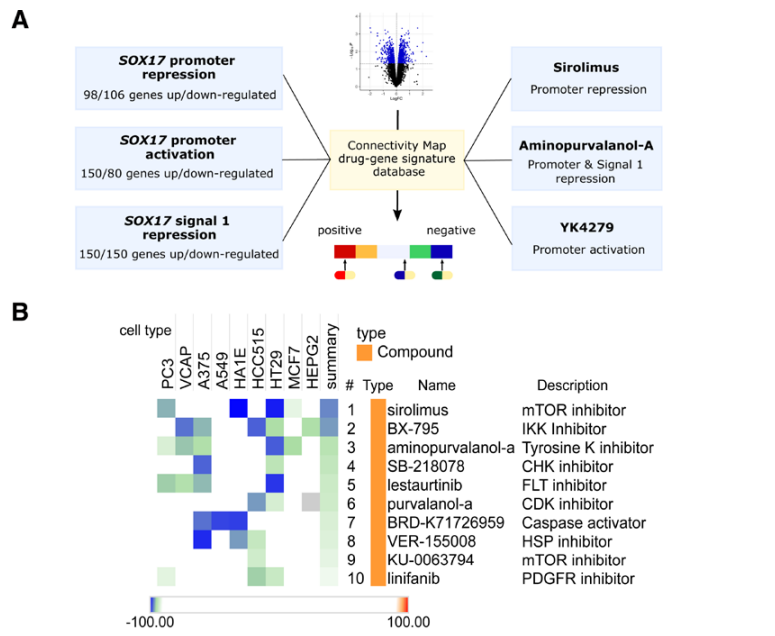
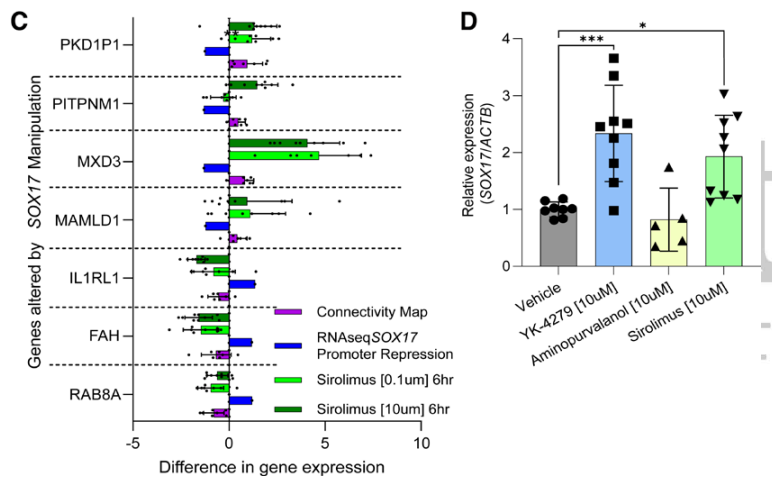
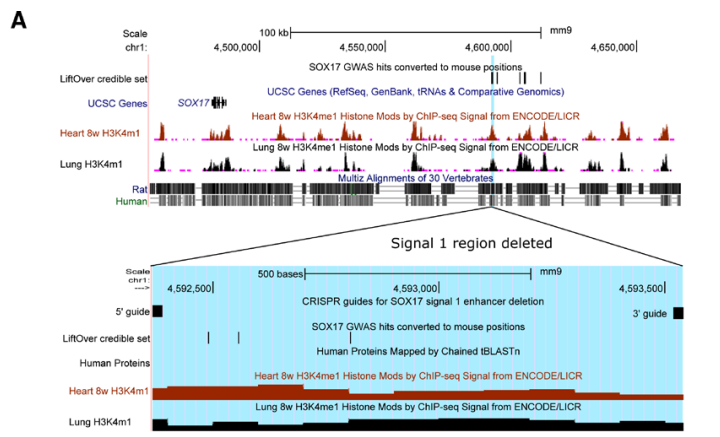
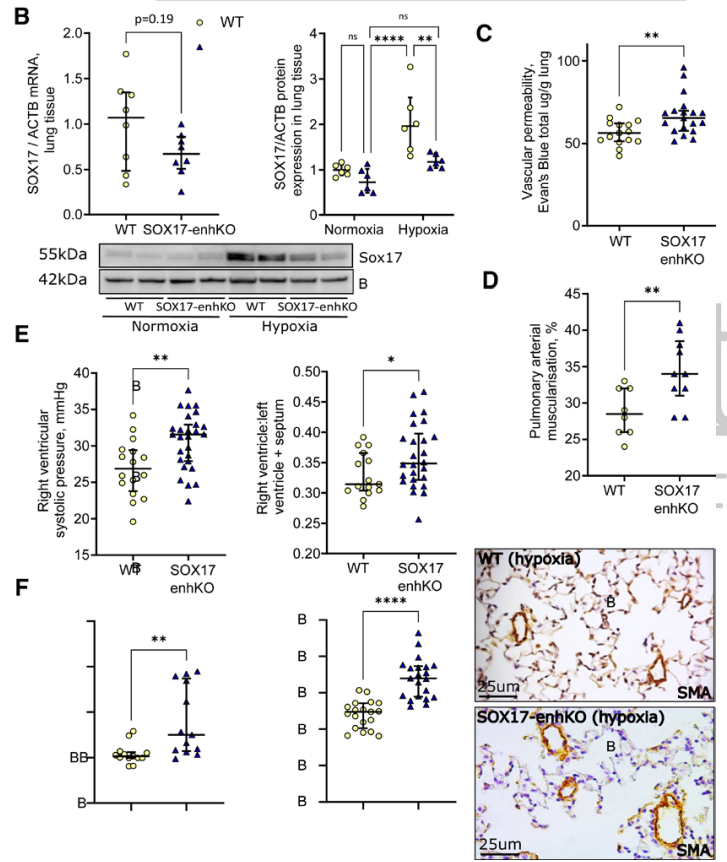
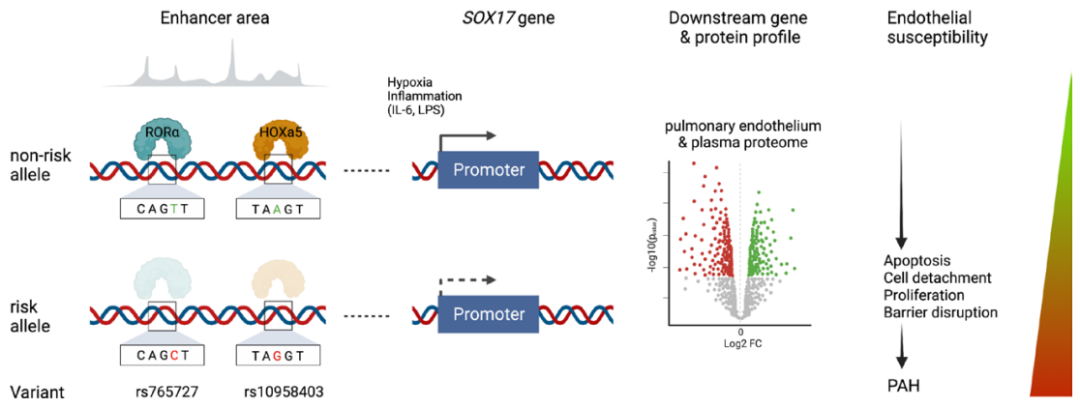
肺动脉高压(PAH)是一种罕见疾病,其特征为肺动脉重构、血管阻力增加和右心衰竭。研究表明,遗传因素在PAH的发病中起着重要作用,其中包括上游转录因子(TF)SOX17保守的增强子中发现了新的遗传风险变异体。SOX17是胚胎发育和成年后肺动脉内皮细胞(hPAEC)稳态中的重要转录因子。SOX17的罕见致病性突变会导致遗传性PAH。已知SOX17信号1的变异会影响SOX17的表达,但该元件在细胞和体内的功能仍不清楚;SOX17信号2区域的明确功能尚未定义。本研究假设增强子区域的PAH风险等位基因会影响SOX17上游的TF结合,从而降低SOX17表达并促进扰乱内皮细胞功能和PAH发展。 PAH常见的基因信号rs10958403(SOX17-信号1)和rs765727(SOX17-信号2)被发现可以识别SOX17增强子。 研究人员使用CRISPR-I技术在hPAECs细胞中发现,针对rs765727或SOX17启动子的引导RNA会导致SOX17表达显著下降,而不会影响附近的基因。实验结果表明,这些PAH信号识别到的增强子活跃在hPAECs细胞中,含有可能驱动转录因子结合差异的变异位点,如HOXa5和ROR-α。通过进一步的实验验证,证实HOXa5和ROR-α确实可以与这些变异位点特异性结合。 图1. 定义SOX17的上游调节器和SOX17基因座的共同变异对PAH的影响。 PAH相关刺激物质调节PAH患者细胞中内皮细胞SOX17表达。 通过测试健康对照组或PAH患者来源的内皮祖细胞(ECFCs)在模拟低氧的二甲基乙二酰基甘氨酸、炎症刺激因子脂多糖和骨形态发生蛋白9(BMP9)刺激下的SOX17表达,发现这些因素都能显著增加ECFCs中的SOX17表达。此外,患有特发性肺动脉高压(idiopathic PAH)的患者的ECFCs比对照组的ECFCs具有更弱的屏障功能,并且更容易受到脂多糖诱导的通透性增加的影响,而SOX17表达则具有保护作用并能恢复屏障功能。在患有致病性BMPR2变异的PAH患者中,ECFCs对脂多糖诱导通透性增加的敏感性更高,但同时也被BMP9抑制。 图2. 定义了上游调节器和PAH相关刺激对SOX17的影响。 SOX17调节hPAEC中的病理性下游分子通路和功能。 通过siRNA介导的沉默或CRISPR-I介导的SOX17信号1和信号2调控SOX17,进行了hPAEC的RNAseq分析。在siRNA-SOX17敲低后,有1717个基因在表达上有差异。基因本体论显示细胞粘附和细胞外基质(ECM)组织通路显著富集。在SOX17信号1的CRISPR-I后,有451个基因显著上调或下调;在SOX17信号2的CRISPR-I后,有786个基因显著上调或下调。有81个基因在siSOX17和SOX17-signal 1 CRISPR-I中有差异表达。与siRNA分析一致,这些差异表达基因的基因本体论分析显示富集于与ECM组织和细胞粘附相关的通路。qPCR用于验证SOX17-siRNA对富集于ECM和粘附通路的受影响基因的影响。相对于阴性对照siRNA,ECM和粘附基因ADAMTS12、MMP17和LAMB3明显增加,而CDH5通过SOX17沉默而下降。这些数据表明,hPAEC中SOX17的丢失会驱动与PAH病理相关的通路基因表达变化。 图3. 肺血管细胞中Sox17的操作分析。 不同 SOX17 变异基因型患者的血浆蛋白质组学差异 研究分析了431名PAH患者的血浆蛋白质组,并研究了SOX17基因不同变异型对其下游靶标的潜在影响。结果发现,SOX17信号1和SOX17信号2的单核苷酸多态性对198个和161个蛋白质的血浆水平产生显著影响。基因本体分析显示,这些蛋白质与调节粘附和细胞外基质、增殖、迁移和凋亡等生物学过程相关。同时,与转录组基因本体分析相似的过程和功能也出现在蛋白质组学分析中,这表明SOX17增强子活性的差异与PAH风险等位基因相关,并导致血浆蛋白质组发生病理相关功能的变化。 图4. SOX17增强子变体基因型对患者蛋白质组学的影响。 SOX17缺失对hPAECs的功能影响。 SOX17敲低会增加hPAEC对刺激的凋亡反应,降低对IV型胶原的粘附能力,同时增加细胞的渗透性和增殖能力。这些结果表明,SOX17的缺失从根本上改变了hPAECs的功能,与患者肺动脉内皮细胞中观察到的变化相似。 图5. Sox17丢失在肺动脉内皮细胞平衡中的功能分析。 用于药物再利用的救援化合物的 Cmap 预测。 基于Cmap数据库预测药物复用的方法,该方法旨在研究是否可以使用现有的药物分子逆转与SOX17功能障碍相关的基因变化。为了实现这一目标,作者使用了Cmap数据库,该数据库包含了数千种化合物在多个细胞系中的转录组标记,使用户可以比较用户生成的标记。作者通过对SOX17 hPAECs签名进行分析,发现Sirolimus、Aminopurvalanol-a和YK4279可以与SOX17 hPAECs匹配。接下来,作者通过实验验证了Cmap预测的这些化合物可以成功逆转与SOX17功能障碍相关的遗传变化。因此,本文的结果表明,Cmap预测的化合物可以作为药物复用的潜在候选者,用于治疗SOX17相关疾病。 图6. 重组化合物以挽救肺动脉高压中SOX17功能的丧失。 动物敲除SOX17增强子使PH恶化。 SOX17基因组范围关联研究信号1的747bp增强子区域,通过CRISPR/Cas9基因编辑技术在C57BL/6背景下成功制备了缺乏这个增强子区域的小鼠(称为SOX17-enhKO)。研究发现,当将SOX17-enhKO小鼠和野生型小鼠(WT)置于正常氧气条件下时,它们的右心室收缩压和右心室肥厚指数没有明显差异。然而,当暴露于低氧条件下时,SOX17-enhKO小鼠的肺血管通透性增加,肺血管周围肌肉化程度增加,右心室收缩压和右心室肥厚指数明显增加,表明SOX17增强子敲除会加剧肺动脉高压(PH)的严重程度,使小鼠更容易发生PH。在不同的PH模型中,两个独立实验室证实,SOX17增强子敲除会增加对PH的易感性和严重程度。 图 7. SOX17信号1增强子基因敲除小鼠在缺氧条件下会出现更严重的PH。 本研究提供了一种新的见解,解释了位于关键内皮转录因子SOX17上游的2个独立常见遗传变异如何增加罹患肺动脉高压的易感性(见图8)。简而言之,位于假定SOX17增强子信号1和2中的rs765727和rs10958403的变异决定了2个转录因子ROR-α和HOXA5的结合。任一因子的等位基因特异性结合减少导致SOX17表达降低。SOX17对于维持内皮细胞的稳态至关重要,其丧失会驱动异常增殖、凋亡和黏附,损害内皮屏障完整性。我们的预测是,这将增加对缺氧和Sugen暴露的SOX17-信号1增强子信号的小鼠易感性。解释复杂疾病基因组关联研究信号的重要性和生物学功能是一项挑战。其中许多位于基因组的非编码区域,这使解释变得更加复杂。已确认的通过增强子区域引起疾病的变异很少,包括镰状细胞贫血中的BCL11和肥胖症中的FTO。SOX17-信号1和信号2位于拓扑关联域内,其中SOX17是唯一的基因,因此是这两个增强子最可能的靶点。经过CRISPR-I处理SOX17-信号2和CRISPR删除SOX17-信号1后观察到SOX17表达的显著和特定减少,证明了这些基因组信号与SOX17表达调节相关。EMSA(和HOXa5的染色质免疫沉淀-qPCR)证明HOXa5或ROR-α结合到SOX17-信号1和信号2中存在的非风险等位基因。因此,一个纯合风险等位基因或两个风险等位基因的个体比寄宿非风险等位基因的个体更能抵抗HOXa5或ROR-α诱导的SOX17表达。虽然这些转录因子本身并非与肺动脉高压有关,但已经证明HOXa5转录因子在PAH肺组织中表达存在差异,这可能会进一步加剧由驱动疾病的变异引起的差异结合的效应。 图 8. 总结图。 这篇研究发现位于关键内皮转录因子SOX17上游的两个常见遗传变异如何增加易感性。具体而言,这些变异影响了转录因子ROR-α和HOXA5的结合,并降低了SOX17的表达,从而导致内皮细胞稳态的丧失。这项研究为肺动脉高压的发病机制提供了新的认识,并有望为疾病的预防和治疗提供新的目标。 在临床上,这项研究的结果可能有助于开发更准确的基因诊断和预测工具,以帮助识别具有潜在易感性基因变异的患者,并采取相应的预防措施。此外,这项研究的结果也有助于开发更具针对性的治疗策略,以减轻或预防肺动脉高压的发生和发展。总之,这项研究为肺动脉高压的研究和治疗提供了新的方向和启示。 Walters R, Vasilaki E, Aman J, Chen CN, Wu Y, Liang OD, Ashek A, Dubois O, Zhao L, Sabrin F, Cebola I, Ferrer J, Morrell NW, Klinger JR, Wilkins MR, Zhao L, Rhodes CJ. SOX17 Enhancer Variants Disrupt Transcription Factor Binding And Enhancer Inactivity Drives Pulmonary Hypertension. Circulation. 2023 Apr 17. doi: 10.1161/CIRCULATIONAHA.122.061940. Epub ahead of print. PMID: 37066790.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言