ACS Nano:仿生纳米粒子介导的ACE2缺氧反应质粒靶向递送逆转缺氧引起的肺动脉高压
2023-04-25 刘少飞 MedSci原创 发表于德国
ACE2-CS-PRT@PM 有效地将缺氧反应性 ACE2 质粒递送到肺血管内皮细胞中,并仅在缺氧环境中促进 ACE2 的过表达。

低氧性肺动脉高压(HPH)的特点是肺血管持续性收缩和逐渐的重构,这是由于低氧引起的一系列加成因素引起的,包括肺血管内皮损伤、肺内血管紧张素系统失衡和炎症。目前,HPH仍然是一种缺乏有效治疗的难治性疾病。基因治疗对于HPH具有巨大的潜力,但受到有效靶向递送和低氧响应调控系统的基因的限制。因此,我们构建了血管紧张素转换酶2(ACE2)的低氧响应质粒,其具有内皮细胞特异性启动子Tie2和低氧响应元素,然后用鱼精蛋白和软骨素硫酸盐作为核心,包装ACE2质粒,形成类生物的纳米粒子递送系统ACE2-CS-PRT@PM,并用血小板膜作为外壳以靶向受损肺血管内皮细胞。ACE2-CS-PRT@PM具有194.3nm的直径,带有血小板膜包覆的核壳结构和负电荷表面,它在低氧环境下表现出更高的递送效率,能够靶向肺血管内皮细胞,并低氧响应性地在内皮细胞中过度表达ACE2。在体外实验中,ACE2-CS-PRT@PM显著抑制了肺平滑肌细胞的低氧诱导增殖。在体内实验中,ACE2-CS-PRT@PM通过抑制低氧诱导的肺动脉平滑肌细胞增殖、减少肺血管重构、恢复肺内血管紧张素系统平衡和改善炎症微环境等方式,有效地改善了血流动力学功能障碍和形态异常,并基本逆转了HPH,而且没有检测到任何毒性反应。因此,ACE2-CS-PRT@PM对于HPH的靶向基因治疗具有很大的前景。
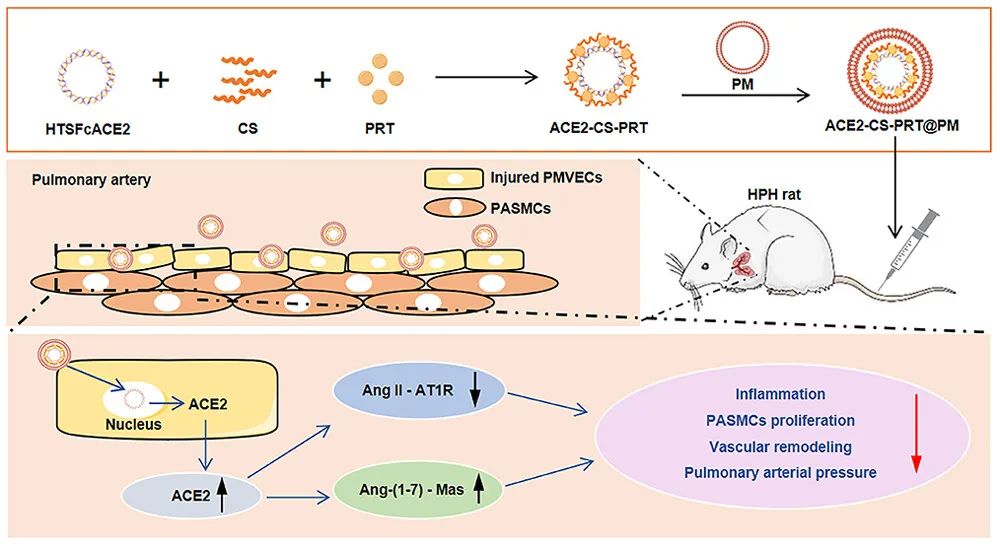
ACE2-CS-PRT@PM的表征
直接测序和限制性内切酶消化分析证明了携带ACE2基因的重组载体(HTSFcACE2)的构建和鉴定。在低氧条件下,ACE2质粒显著增加了肺微血管内皮细胞(PMVECs)中ACE2的蛋白表达,与常氧条件相比。以上数据表明,低氧应答型ACE2质粒成功构建。CE2-CS-PRT@PM纳米粒子是通过静电相互作用制备的。鱼精蛋白(PRT)是一种天然阳离子蛋白质,可以通过静电吸附与带负电DNA形成复合物,用于包装DNA并保护其免受核酸酶降解。PRT还具有核定位和膜转运能力,使形成的DNA-PRT凝聚物可以逃脱溶酶体并将包装的DNA输送到细胞核。然而,DNA-PRT复合物通常带有正电荷,因此在ACE2质粒包装过程中,还添加了带负电荷的硫酸软骨素(CS),最终形成的ACE2-CS-PRT纳米粒子呈电负性。当ACE2-CS-PRT纳米粒子被血小板膜(PM)包覆时,由于血小板膜具有负外膜和正内膜,通过静电排斥作用,ACE2-CS-PRT@PM会形成正确朝外结构。
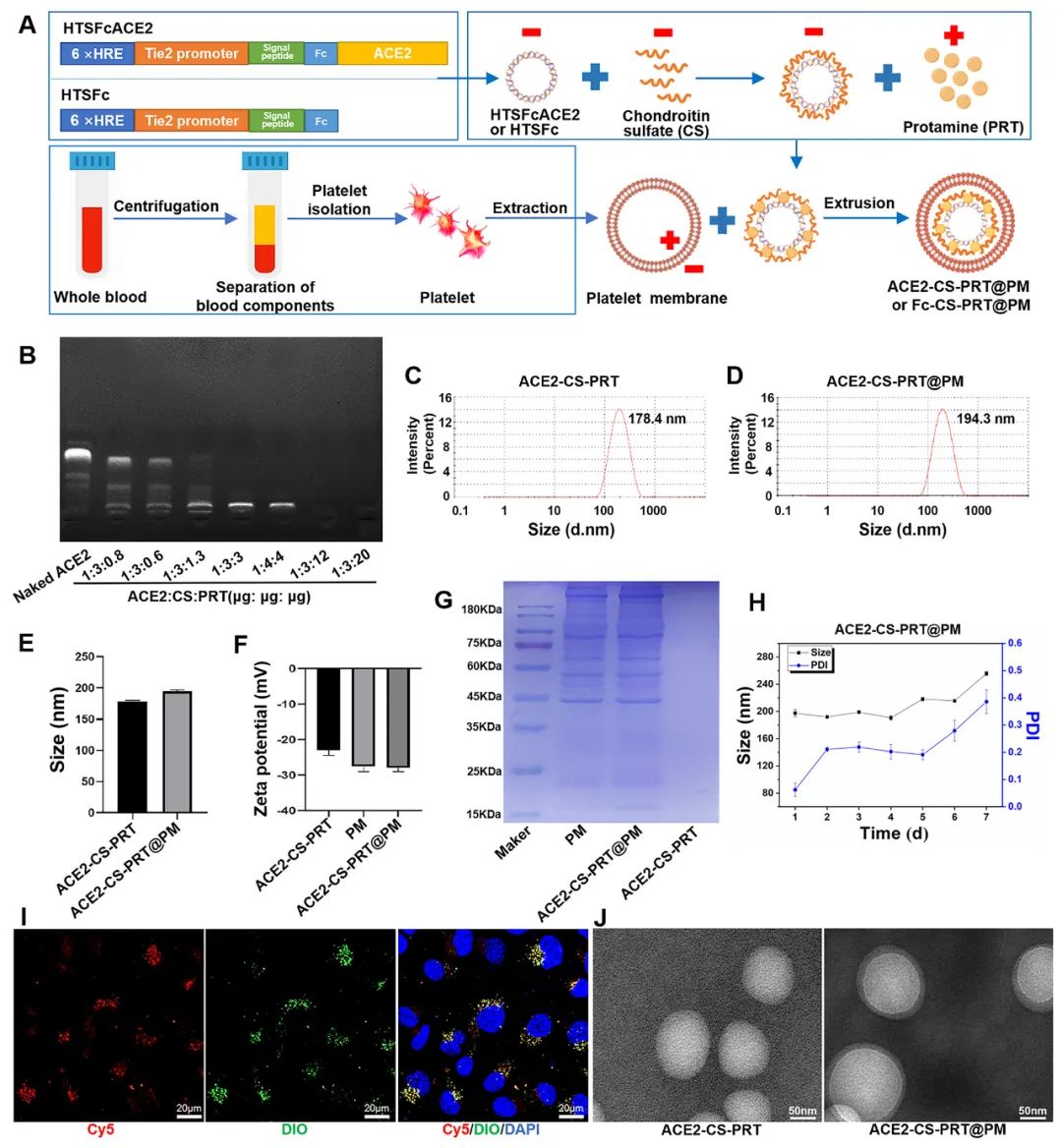
图 1. ACE2-CS-PRT@PM 的特征。
ACE2-CS-PRT@PM 的内皮摄取
通过流式技术和共聚焦显微镜对纳米粒子与初级PMVEC的亲和力进行定性和定量分析。PMVEC对ACE2-CS-PRT@PM和ACE2-CS-PRT的摄取在缺氧条件下表现出时间依赖性。PMVECs在缺氧条件下比常氧条件下吸收更多的纳米颗粒(图 2)。同时,在缺氧条件下,PMVECs比ACE2-CS-PRT吸收更多的ACE2-CS-PRT@PM。这些结果表明ACE2-CS-PRT@PM 对缺氧损伤的PMVEC表现出更好的靶向作用。
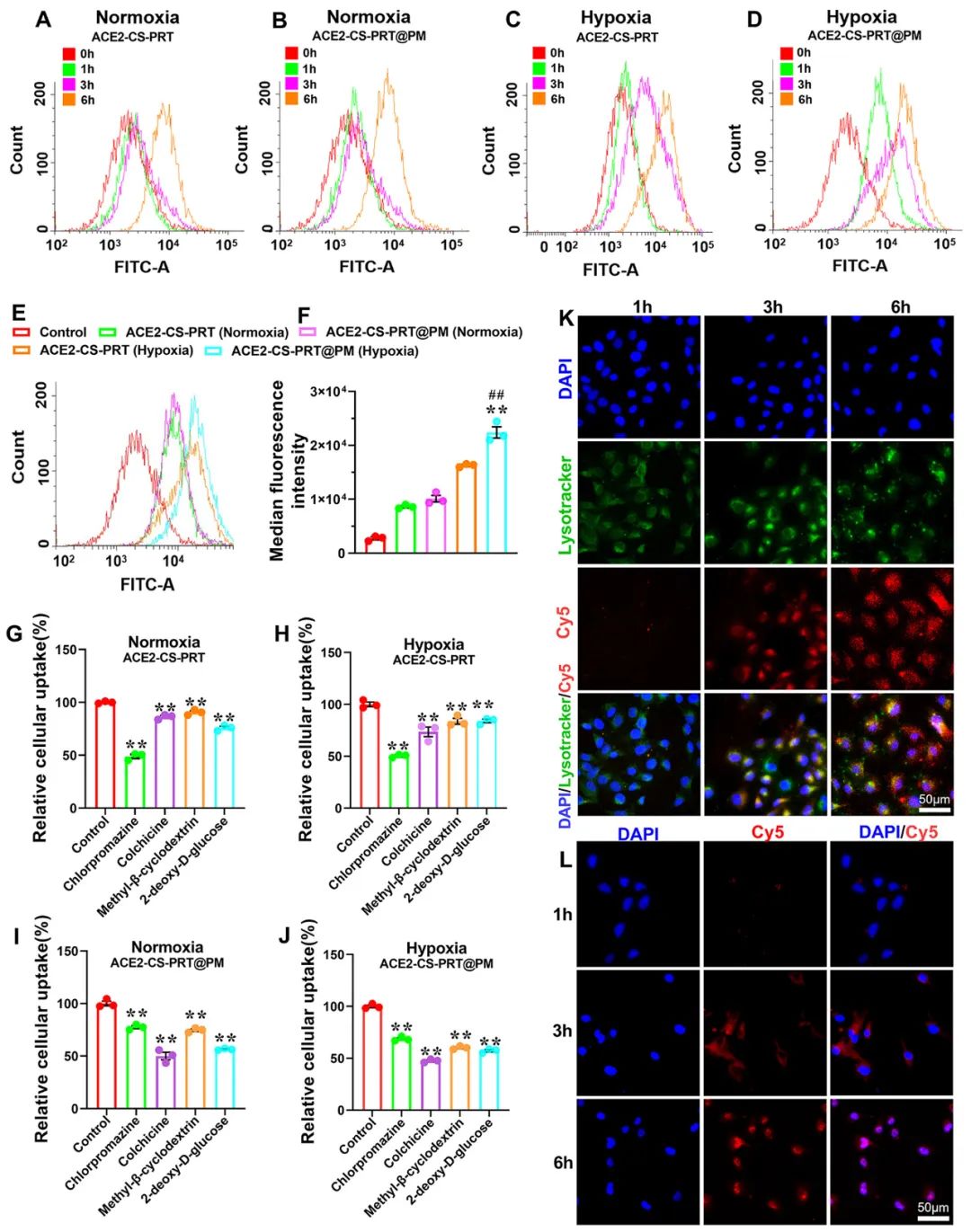
图 2. PMVEC对ACE2-CS-PRT@PM的摄取。
ACE2-CS-PRT@PM在体外的功能验证
在ACE2-CS-PRT@PM处理的PMVEC中评估缺氧条件下ACE2表达的时间依赖性。在缺氧条件下,ACE2在24小时开始表达,在48小时达到表达峰值,并在ACE2-CS-PRT@PM处理后的 PMVEC 中在 72 小时逐渐减少。ACE2@Lipo 2000、ACE2-CS-PRT和ACE2-CS-PRT@PM这三种纳米粒子在常氧条件下并没有增加PMVEC培养基中ACE2蛋白的含量,但它们在缺氧条件下增加了ACE2蛋白的含量,而ACE2-CS-PRT@PM的效果最强。这表明在ACE2-CS-PRT@PM处理的PMVECs中,大量的ACE2蛋白在缺氧条件下被分泌出来。此外,在缺氧条件下,供体腔中PASMC的增殖受到受体腔中ACE2-CS-PRT@PM处理的 PMVEC分泌的ACE2蛋白的抑制。ACE2-CS-PRT@PM被缺氧损伤的肺血管内皮细胞吸收后,PASMCs的异常增殖被阻断。
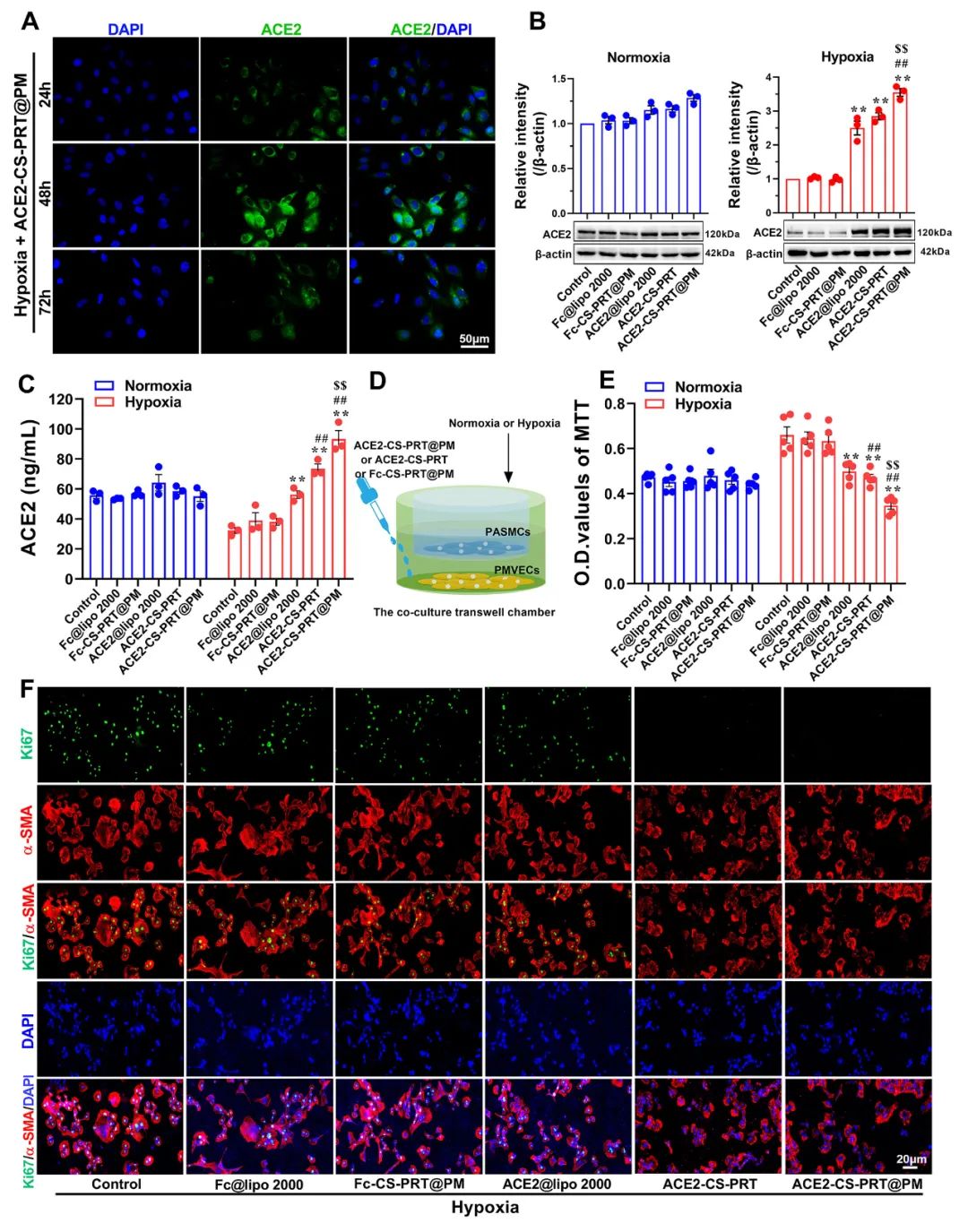
图 3. ACE2-CS-PRT@PM 的体外功能。
ACE2-CS-PRT@PM在体内的生物分布。
为了探索ACE2-CS-PRT@PM和ACE2-CS-PRT在体内的生物分布,对主要器官进行了实时成像。在HPH大鼠中,ACE2-CS-PRT@PM在静脉给药后3 h主要存在于肺和肝脏,12 h主要存在于肺、肝脏和肾脏,24 h仅存在于肺,而ACE2-CS-PRT 3 h主要存在于肝和肺,12 h仅存在于肾脏,24 h消失。在常氧大鼠中,ACE2-CS-PRT@PM在 3 h时主要存在于肝脏和肺部,在 12 h时在肝脏和肾脏中,并在 24 h消失。ACE2-CS-PRT@PM在常氧大鼠肺和肝脏的分布无显著差异;然而,肺部 ACE2-CS-PRT@PM 的分布明显高于缺氧损伤大鼠的肝脏。血小板膜涂层显著增加了纳米颗粒在HPH大鼠肺部的分布并减缓了其清除,与ACE2-CS-PRT相比,ACE2-CS-PRT@PM在HPH大鼠中表现出更好的肺靶向和更慢的清除。与常氧大鼠相比,ACE2-CS-PRT@PM在HPH大鼠肺部的清除速度更慢,蓄积量更大(图4)。因此,ACE2-CS-PRT@PM选择性分布于缺氧损伤的肺部,对HPH的治疗具有重要价值。
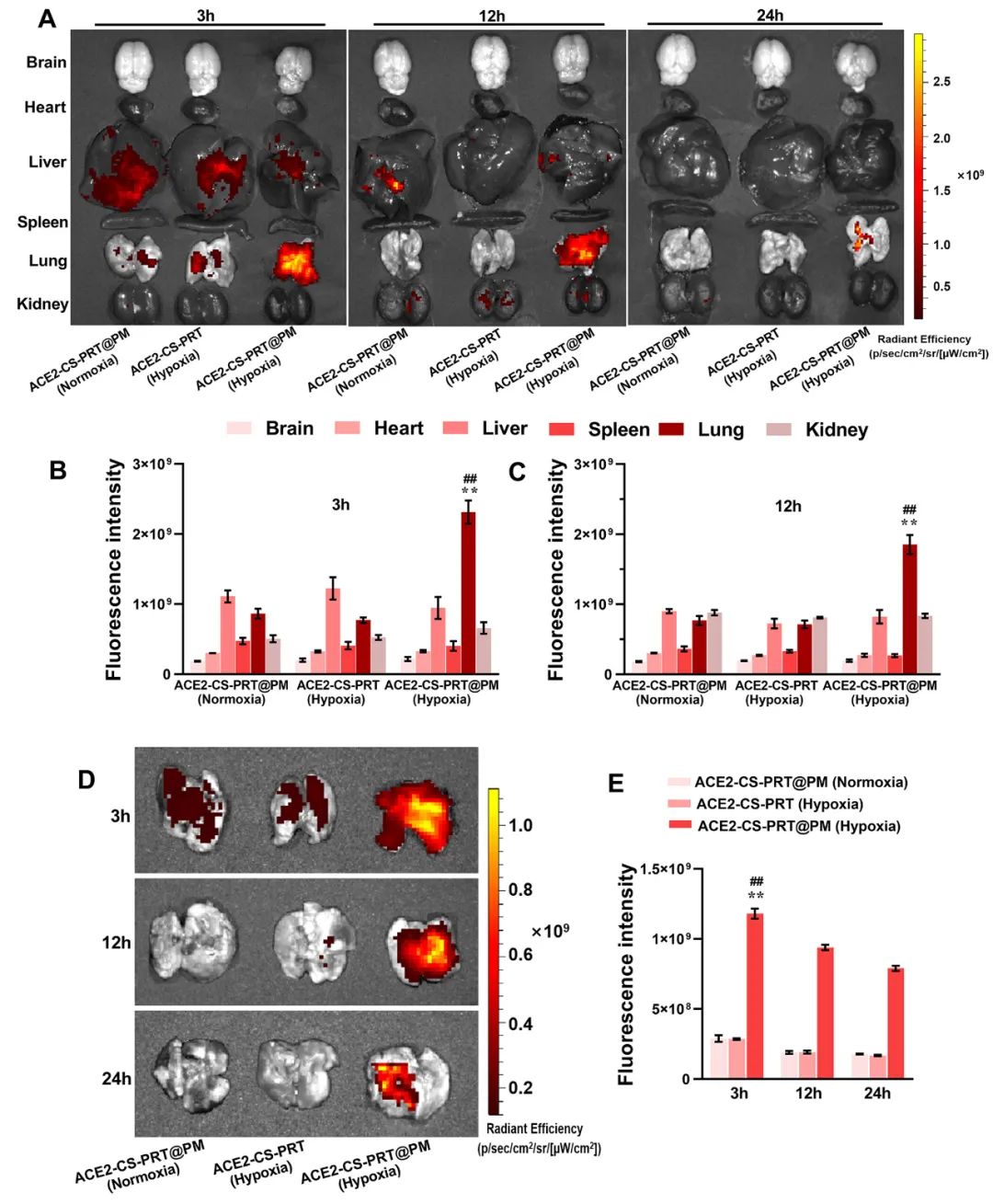
图 4. ACE2-CS-PRT@PM 在 HPH 大鼠主要器官中的生物分布。
此外,通过实时成像观察ACE2-CS-PRT@PM在主要血管中的分布。最强的Cy5荧光强度来自ACE2-CS-PRT@PM给药的 HPH大鼠的肺动脉;与其他动脉或正常动物相比,HPH大鼠肺动脉中ACE2-CS-PRT@PM的分布显著增加,这表明ACE2-CS-PRT@PM被主动递送至HPH大鼠肺动脉缺氧损伤的肺血管(图 5)。
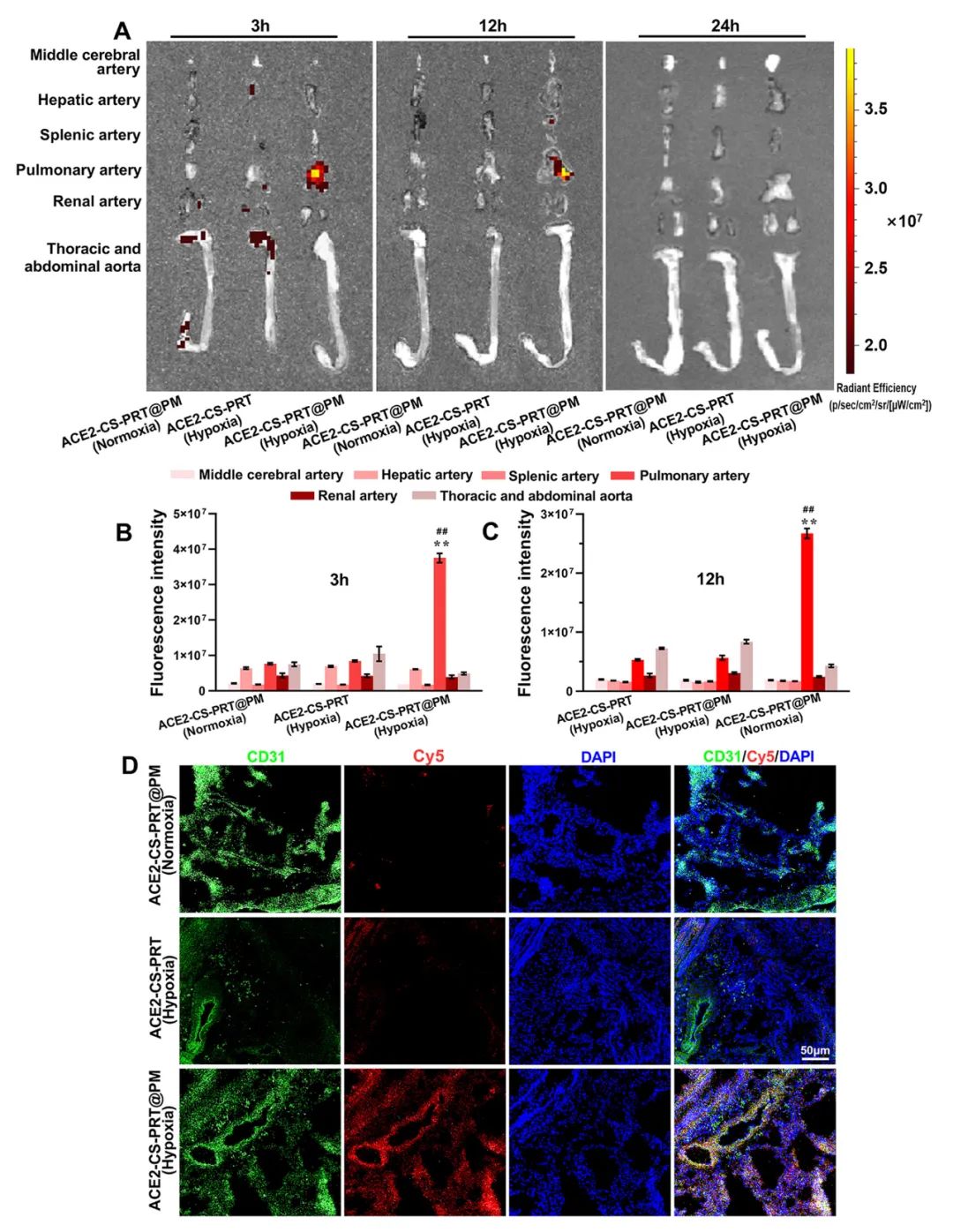
图 5. ACE2-CS-PRT@PM在HPH大鼠主要动脉血管中的生物分布及其肺血管定位。
ACE2-CS-PRT@PM 改善大鼠的HPH
导管法检测右心室收缩压(RVSP)和颈动脉压(mCAP)。与常氧大鼠相比,缺氧暴露 4 周显著增加大鼠的RVSP。ACE2-CS-PRT和ACE2-CS-PRT@PM均显著降低HPH大鼠的 RVSP,但ACE2-CS-PRT@PM显示出比ACE2-CS-PRT强得多的效果。ACE2-CS-PRT@PM对HPH大鼠的mCAP也没有影响,表明它在给药后不会引起全身血压下降。这些数据表明,ACE2-CS-PRT@PM可显著改善HPH大鼠的肺动脉高压,而不会导致全身血压下降。与缺氧对照组相比,ACE2-CS-PRT@PM或ACE2-CS-PRT处理的HPH大鼠的血管壁厚度显著降低。
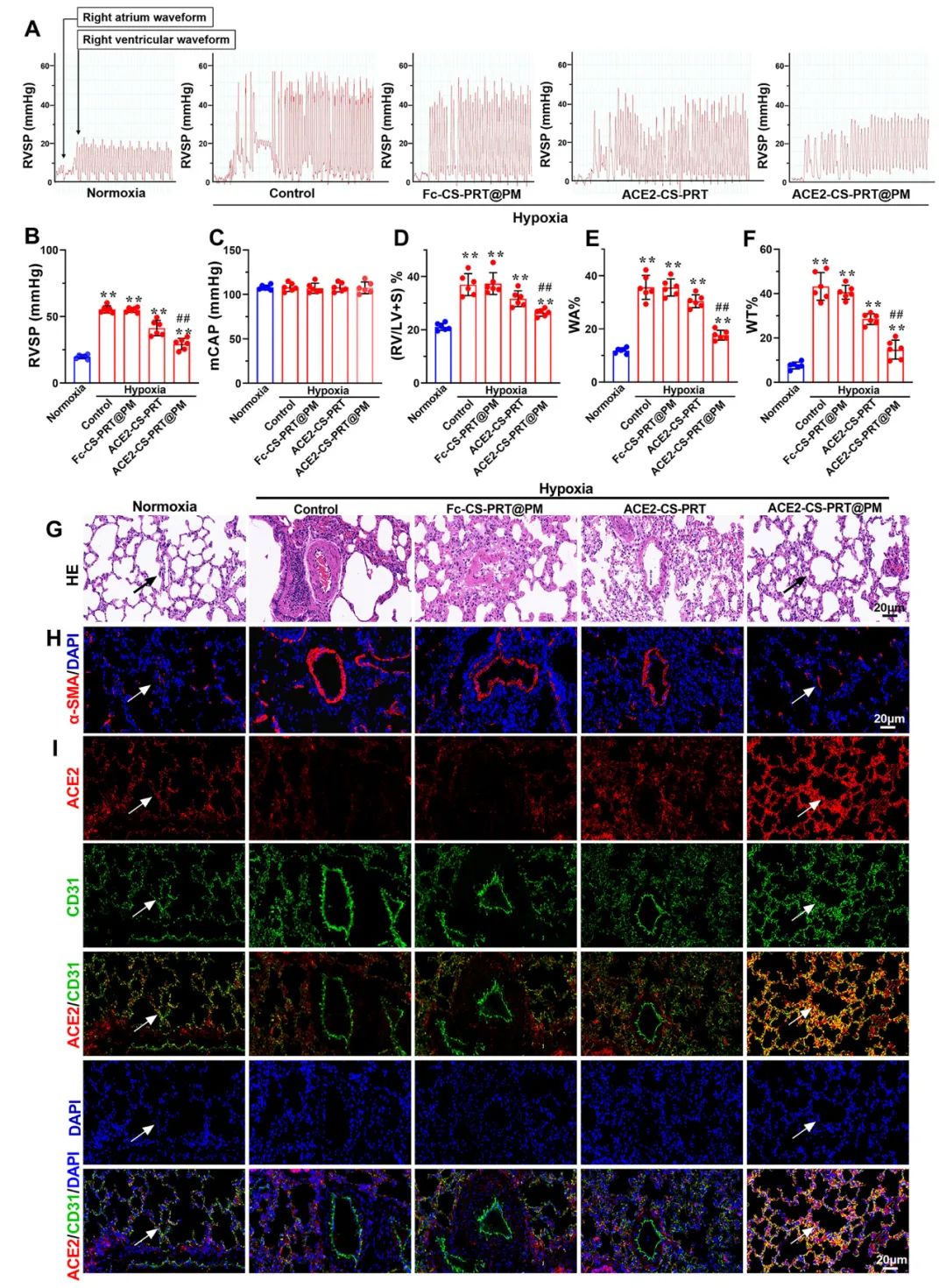
图 6. ACE2-CS-PRT@PM改善大鼠肺动脉高压。
ACE2-CS-PRT@PM恢复HPH肺内肾素-血管紧张素系统的平衡。
肾素-血管紧张素系统 (RAS) 在调节血压稳态中起着重要作用。经典的RAS系统由血浆和组织中的一系列酶和几种产物组成,包括肾素、血管紧张素原、Ang II、ACE等,Ang II起主要作用包括收缩血管、增加心肌收缩力 ,通过与其1型受体 (AT1R) 结合,诱导心室肥大,抑制肾素释放,促进前列腺素释放。RAS 的这些成员构成了经典通路 ACE/Ang II/AT1R 轴。作为RAS的主要效应蛋白,Ang II通过促进肺血管收缩、PASMCs增殖、炎症反应和纤维化参与肺动脉高压的发生发展。
HPH大鼠肺组织AngⅡ含量和AT1R蛋白表达显著升高,但ACE2蛋白表达降低。ACE2-CS-PRT@PM或ACE2-CS-PRT可以逆转HPH大鼠肺部Ang II、AT1R 和 ACE2 的这些变化,并且ACE2-CS-PRT@PM的作用比 ACE2-CS- PRT(图 7)。这表明 ACE2-CS-PRT@PM 通过在 HPH 大鼠肺中过表达 ACE2 阻断了 Ang II/AT1R 轴。
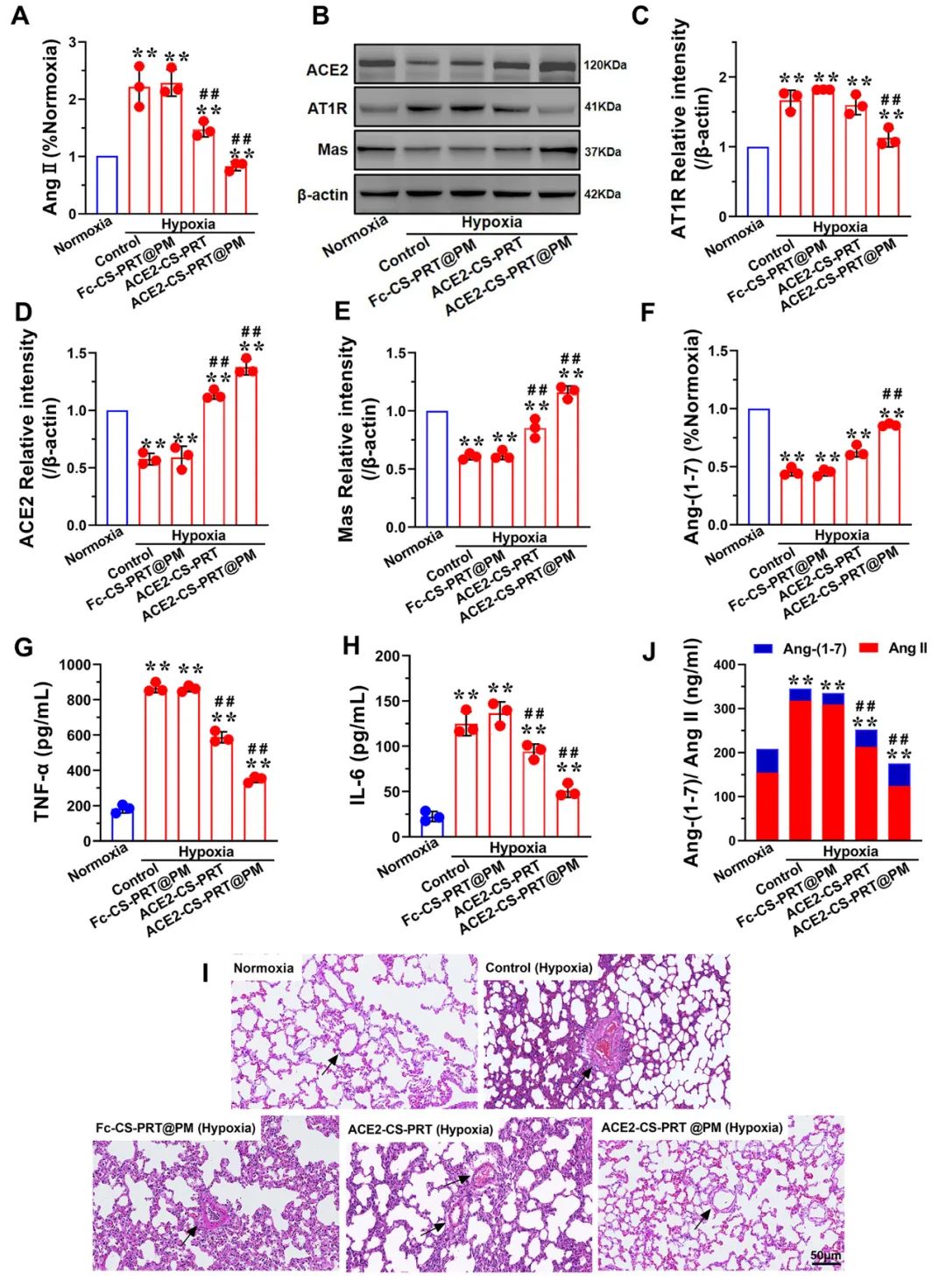
图 7. ACE2-CS-PRT@PM 恢复了肺内 RAS 系统的失衡并改善了 HPH 中的炎症微环境。
ACE2-CS-PRT@PM 在体内的初步安全性评估
在大鼠中评估了ACE2-CS-PRT@PM的初步安全性。苏木精和伊红染色表明ACE2-CS-PRT@PM(1 毫克/千克或 2 毫克/千克)没有在大鼠的主要器官中引起明显的炎症损伤。丙氨酸转氨酶 (ALT)、天冬氨酸转氨酶 (AST)、血尿素氮 (BUN) 和肌酐 (CREA) 的血浆水平均在正常范围。ACE2-CS-PRT@PM对凝血酶原时间、活化部分凝血活酶时间、凝血酶时间和纤维蛋白原水平等凝血指标也无影响(图 8)。血小板提取过程中加入前列腺素E1和EDTA以防止血小板活化;同时采用冻融法提取血小板膜,去除血小板中可能引起凝血级联反应的凝集颗粒。因此,静脉内注射ACE2-CS-PRT@PM不会发生聚集、导致血栓形成或诱导凝血级联反应。此外,ACE2-CS-PRT@PM不会在HPH或正常大鼠的肝脏和肾脏中诱导 ACE2 蛋白的过度表达。所有这些数据表明 ACE2-CS-PRT@PM 在目前的剂量下是相当安全的。
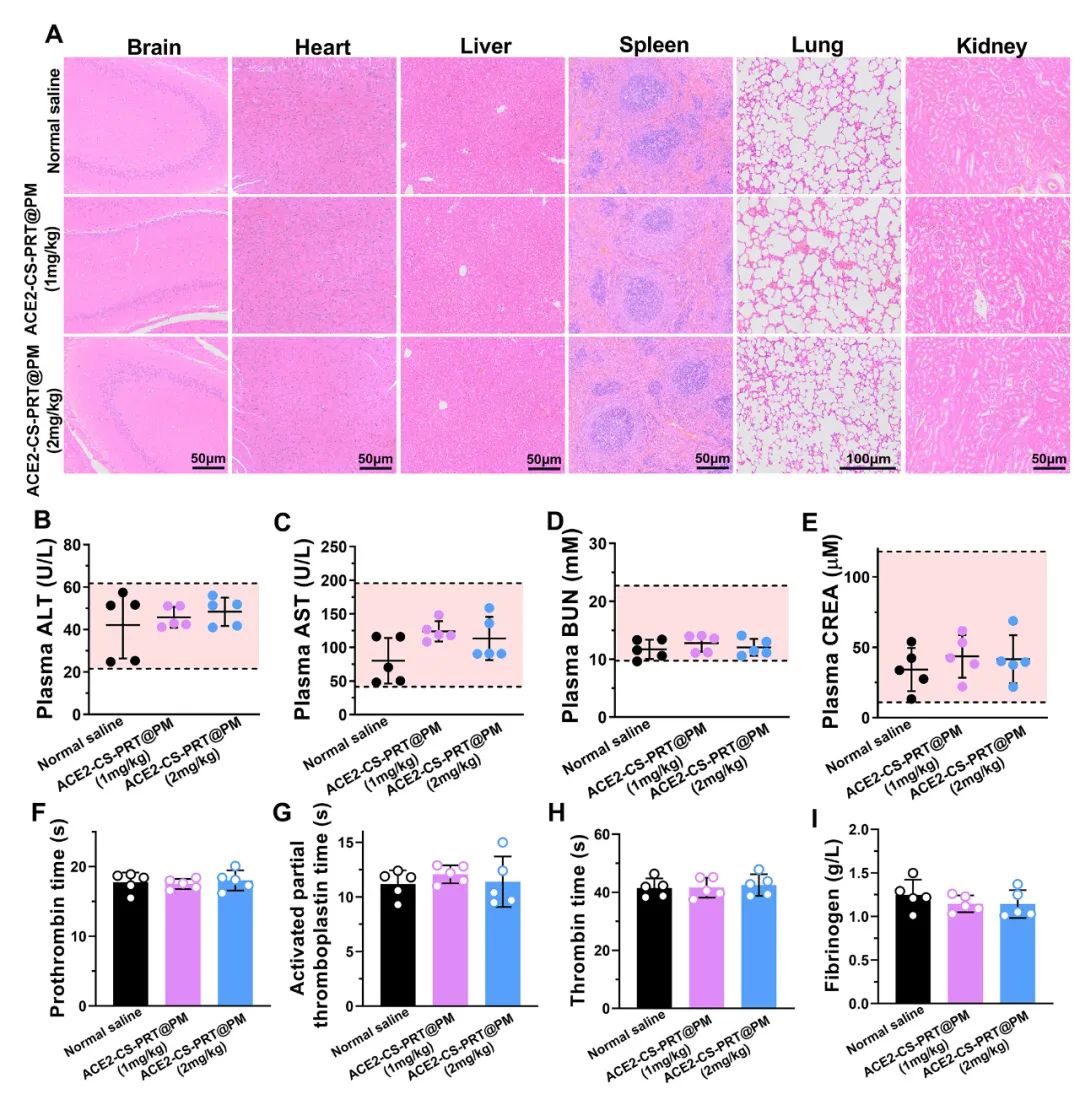
图 8. ACE2-CS-PRT@PM 在体内的安全性评估。
总之,该研究构建了具有内皮特异性启动子Tie2和缺氧反应元件的ACE2缺氧反应质粒,并通过包装以鱼精蛋白和硫酸软骨素为核心的质粒,然后包被,开发了仿生纳米颗粒递送系统ACE2-CS-PRT@PM 它以血小板膜为外壳,靶向受损的肺血管内皮。ACE2-CS-PRT@PM 有效地将缺氧反应性 ACE2 质粒递送到肺血管内皮细胞中,并仅在缺氧环境中促进 ACE2 的过表达。更重要的是,ACE2-CS-PRT@PM通过抑制PASMCs缺氧增殖、减少肺血管重塑和通过激活ACE2/Ang-(1-7)/Mas轴改善炎症微环境、抑制 Ang II逆转大鼠HPH /AT1R轴则恢复肺内血管紧张系统的平衡,没有任何明显的毒性作用。ACE2-CS-PRT@PM显示出靶向递送至受损内皮的突出特征和转基因 ACE2 在缺氧内皮细胞中的缺氧反应性过表达。因此,这将是一种非常有前途的治疗HPH的纳米药物。
构建的纳米颗粒ACE2-CS-PRT@PM显示ACE2质粒有效靶向递送至缺氧损伤的肺血管内皮细胞,以及转基因ACE2在体外和HPH大鼠肺血管内皮细胞中的缺氧反应性过表达。它展示了治疗HPH的潜在前景。然而,本研究存在一些局限性。首先,在 ACE2-CS-PRT@PM 中用小鼠 Tie2 启动子和大鼠 ACE2 cDNA 构建 ACE2 质粒,并将纳米颗粒涂上大鼠血小板膜。因此,在临床推广实验结果时应考虑物种差异。其次,肺动脉高压与多种危险因素相关,除HPH外还可分为多种表型。ACE2-CS-PRT@PM能否逆转或改善HPH以外的其他类型肺动脉高压尚不清楚,尽管缺氧是肺动脉高压发展过程中常见的病理生理变化。此外,ACE2-CS-PRT@PM 主要作用于肺部;因此,直接鼻内给药 ACE2-CS-PRT@PM 是否会表现出更好的靶向能力和更有效?
Yuan R, Liu M, Cheng Y, Yan F, Zhu X, Zhou S, Dong M. Biomimetic Nanoparticle-Mediated Target Delivery of Hypoxia-Responsive Plasmid of Angiotensin-Converting Enzyme 2 to Reverse Hypoxic Pulmonary Hypertension. ACS Nano. 2023 Apr 18. doi: 10.1021/acsnano.2c12190. Epub ahead of print. PMID: 37071566.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言