Nature综述:mRNA脂质纳米颗粒在靶向癌症:关键要点与将来发展
2023-10-17 RNAScript RNAScript 发表于上海
脂质纳米颗粒(LNP)是基于四种脂质成分:可电离脂质、胆固醇、辅助脂质和聚乙二醇(PEG)脂质构建的脂质递送载体,其具有1)保护核酸有效载荷不被降解或激活RNA传感机制,进而保护先天免疫反应;2)能够
脂质纳米颗粒(LNP)是基于四种脂质成分:可电离脂质、胆固醇、辅助脂质和聚乙二醇(PEG)脂质构建的脂质递送载体,其具有1)保护核酸有效载荷不被降解或激活RNA传感机制,进而保护先天免疫反应;2)能够将核酸有效载荷引入细胞质;3)用于疫苗接种时本身作为佐剂发挥作用等特性,因而被广泛应用于不同类型的核酸药物递送。
利用mRNA-LNP治疗癌症患者一直是十分火热的研究领域,该领域的发展甚至远早于将该技术应用于COVID-19或其他传染病疫苗的开发。据统计,目前该领域的研究主要集中于开发针对多种新抗原的癌症疫苗或直接在肿瘤内注射编码促炎细胞因子(例如IL-12)的mRNA-LNP。
目前LNP-mRNA的研究重点主要涉及开发靶向策略,选择性地将有效荷载递送到以前被认为无法达到的细胞类型中,避免在广泛组织中表达所产生的无效和毒性问题。
2023年8月16日,以色列特拉维夫大学的研究团队在 Nature 旗下综述期刊 Nature Reviews Clinical Oncology 上发表了题为:Targeting cancer with mRNA–lipid nanoparticles: key considerations and future prospects 的综述论文,概述了使用mRNA-LNP靶向不同癌细胞的各种方法,强调了每种方法在实现细胞选择性表达方面的优势和挑战,以及临床实践中所需要克服的问题和未来前景。

被动靶向
被动靶向方法是用于将mRNA-LNP递送到组织和细胞而不使用靶向修饰表面的方法。在肿瘤免疫治疗中,这种方法常用于靶向可触及的肿瘤以及非恶性组织,例如脾脏和淋巴结,以实现抗肿瘤免疫调节。
瘤内注射
mRNA-LNP的肿瘤内给药是递送纳米颗粒的最简单方法。大多数肿瘤的脉管系统组织差、缺乏淋巴引流和高细胞外基质(ECM)密度,会限制LNP从其他注射部位扩散到肿瘤甚至更深层的肿瘤内部。因此,已经有多项临床前研究通过瘤内直接注射的方式表达特定细胞因子和细胞毒素,或递送CRISPR-Cas9介导癌基因靶向
在临床实践中,研究人员发现肿瘤内注射的LNP不一定局限于肿瘤区域。影像学研究表明,肿瘤内注射后LNP同样会在肝脏和淋巴器官中蓄积。其细胞分布在肿瘤细胞群中也有所不同:注射到肿瘤肿块中并不能保证mRNA主要在癌细胞中表达,导致部分采用直接细胞毒性的疗法(例如细胞周期调节剂和毒素)出现安全性问题。
临床前研究表明,大部分mRNA有效载荷均由肿瘤区域的免疫细胞群表达,特别是巨噬细胞。肿瘤内注射的mRNA-LNP疗法仅用于表达的目标蛋白在周围非恶性组织中可耐受或期望的情况。因此,临床研究中最常通过编码各种细胞因子混合物的mRNA-LNP与免疫检查点抑制剂联合使用作为治疗方案。研究还发现,部分细胞因子(例如IL-12)的局部表达可以改善其全身给药引起的剂量限制性不良事件,因此目前临床阶段的mRNA-LNP瘤内注射候选药物多采用编码IL-12的策略。
无论mRNA有效载荷如何,LNP都具有先天佐剂效应,可促进CD4 T辅助因子1(T+H1)介导的细胞因子反应。TH1反应通常是肿瘤抑制性的,而TH2反应与细胞介导的免疫力降低和具有癌症促进表型的免疫群体的激活有关。研究人员在肿瘤内向小鼠施用编码细胞因子(包括但不限于IL-12IL-15和IL-36γ)的mRNA-LNP,改造肿瘤微环境(TME)。该表型支持CD8和T+H1细胞的活化,募集自然杀伤(NK)和自然杀伤T(NKT)细胞,以及激活CD103和CD8树突状细胞(DC),通过抗原交叉呈递和激活CD8 T细胞反应。
在小鼠中局部施用mRNA-LNP免疫疗法观察到的一个重要特征是,肿瘤内注射产生足以抑制转移瘤在注射区域外扩散的免疫反应,在肿瘤内注射编码IL-12或IL-15 mRNA-LNP的小鼠模型中还观察到未注射远端的病变消退。
肿瘤内注射的mRNA-LNP免疫疗法提供了一个操纵TME以促进抗肿瘤免疫应答的策略,并使具有过度毒性的细胞因子的局部表达成为可能。尽管如此,这种方法的使用仅限于可触及的实体肿瘤以及癌细胞外的非恶性组织具有耐受性的情况。
内源性靶向
为了到达肿瘤部位,静脉注射的mRNA-LNP必须安全地通过血管系统,避免全身循环清除,渗透到肿瘤组织内部并递送到癌细胞内。这些阶段中的每一个都包含多种屏障,这些屏障也取决于疾病状态和肿瘤结构。
PEG脂质能够赋予纳米颗粒逃避网状内皮系统的摄取的能力以及稳定性,延长循环时间。然而,高比例的PEG脂质可能会阻止细胞的摄取,此外,抗PEG抗体也会促进LNP的加速血液清除。因此研究人员也在PEG脂质的潜在替代方案上做出了努力,但目前PEG脂质仍是最有效的LNP稳定成分。
通常静脉注射LNP会迅速吸附血清蛋白,在全身给药后积聚在肝脏中。其中,载脂蛋白E(ApoE)包被的LNP通过与LDL受体结合能够进一步促进肝细胞摄取。准确预测血清蛋白吸附在LNP上形成的蛋白冠以及该过程如何影响LNP的生物分布被称为内源性定位。
一些研究报道,LNP改变需要限制在与尺寸,均匀分布和表面电荷有关的可接受的理化特性范围内,例如LNP表面的负电荷可以阻止其在肝脏的富集,而正电荷通过激活免疫细胞中TLR4介导的信号通路而具有全身毒性的风险。
不同配方的生物分布差异,以及脂质制剂、结构和活性之间的一般关系仍有待充分了解。优化不同组织内源性靶向配方的研究集中在体外和体内的筛选上,这些筛选通常使用报告基因观察LNP的生物分布。DNA条形码对LNP报告基因的组织分布进行逆向工程,以确定某些组织中mRNA-LNPs内源性被动摄取的机制。然而DNA条形码常用的DNA-LNP不一定具有与mRNA-LNP相同的分布。
使用配方优化设计的靶向策略通常能够被某些器官优先摄取,但很少能实现高水平的靶细胞特异性表达。
临床实践经验表明,根据肿瘤类型和患者个体的不同,LNP的摄取存在相当大的异质性。同时,这些纳米颗粒并不总是吸附蛋白质,因此它们的生物分布(主要由大小决定)可能无法反映治疗性mRNA-LNP的生物分布。不仅如此,静脉注射的mRNA-LNPs通常表现出在高细胞密度和组织液压力的冷肿瘤中渗透性不佳。
因此,全身给药的纳米载体药物其治疗潜力和机制仍有待更好地研究。已有研究依靠被动靶向将编码的抗原递送到DC,利用其强大抗原呈递功能激活机体的抗肿瘤免疫反应。后续的内源性靶向研究也很可能将集中在免疫细胞摄取,如淋巴器官或骨髓,通过激活抗原呈递、白细胞或抗肿瘤蛋白实现免疫治疗。
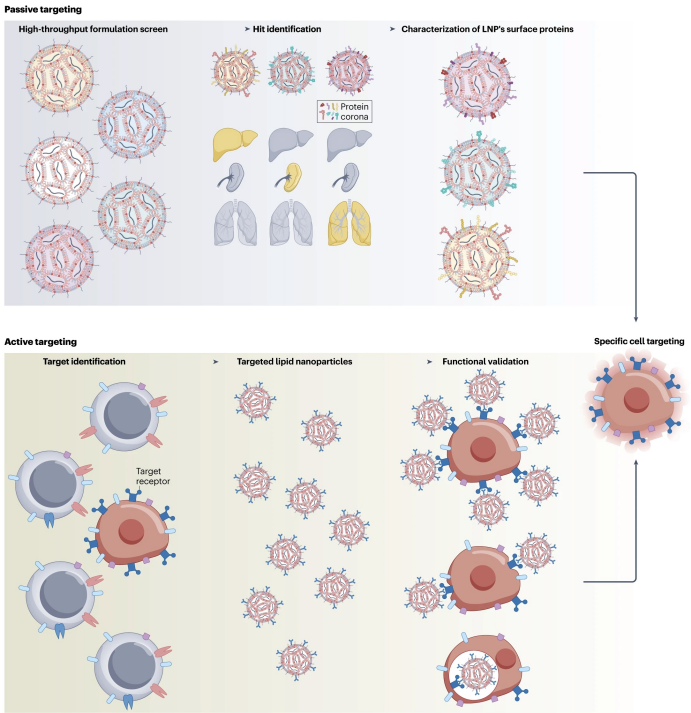
图1. mRNA-LNP肿瘤靶向策略
主动靶向
主动靶向被许多人认为是药物递送领域的圣杯。mRNA-LNPs的主动靶向涉及通过用从小分子配体到单克隆抗体的靶向部分修饰纳米颗粒的表面来递送到特定的细胞类型。当针对癌细胞时,主动靶向方法可以促进细胞对mRNA-LNP的摄取,这对于核酸有效载荷的表达至关重要。当针对非恶性细胞时,主动靶向方法可以将mRNA递送到原本不太可能摄取LNP的细胞中,例如淋巴细胞,激活机体抗肿瘤免疫。
靶点选择
癌细胞直接靶向的理想靶标是肿瘤特异性抗原(TSA),通过结合可激活迅速内化的分子使核酸有效荷载进入癌细胞内。然而,鉴于TSA很少见,研究中也会采用结合多个高表达的肿瘤相关抗原(TAA)作为备选方案。
在考虑可能的靶标时,应解决靶向配体的活性和相互作用的潜在生物学效应问题。例如,用于将mRNA递送到T细胞的CD3靶向mRNA-LNP已被证明具有不良反应,由于潜在的过度活化和T细胞耗竭,不受控制的T细胞活化可能是有害的。
解决肿瘤和患者的异质性也存在许多问题。例如,HER2是一种常见的乳腺癌生物标志物,但仅存在于15-20%的这类癌症患者中,其表达水平可能在同一肿瘤内的细胞之间都有所不同。此外,某一特定靶标的表达可以在不同的疾病阶段波动,例如某些靶标的细胞外结构域会在炎症期间从膜上裂解或脱落,或者在翻译后获得不同的修饰。据报道,MET(一种已知的癌症靶点)的结构域脱落增加与各种癌症类型的疾病进展相关。同样的,HER2表达水平随疾病进展和复发而变化,并且在复发性疾病中,HER2从阴性变为低表达。
肿瘤相关抗原(TAA)靶向策略可以通过调整抗原表位和抗体分子的亲和力改进。然而,高亲和力靶向相互作用可导致结合位点屏障现象,纳米颗粒倾向于粘附在靶标组织外表达抗原的第一层细胞上。
细胞内化
鉴于RNA疗法必须到达细胞质才能执行其功能,内化和内体逃逸对于mRNA-LNP的活性至关重要。大多数关于靶向和内化的数据来自抗体-药物偶联物(ADC)的研究。使用这些数据了解受体内化率是一个很好的开始起点,尽管适用于ADC的特征不一定适用于mRNA-LNP,后者通常比前者尺寸大。然而,对于ADC和mRNA-LNPs,内化速率似乎都与有效荷载释放呈正相关。
需要注意的是,目前对靶标、靶向配体及其相互作用的研究仍不足以预测内化机制。靶向抗体可以在与受体结合后内化,而受体不一定在与其天然配体相互作用时内化。根据抗体修饰和复合物大小的不同,蛋白介导的内化可能会转变为巨胞饮作用。此外,如果抗体未内化,它们还可能触发原本的功能效应,例如巨噬细胞中抗体依赖性细胞毒性和其他Fc区域触发的活动。由于所有这些考虑,除了筛选之外,对靶向相互作用、其在疾病中的机制以及经验证据的深刻生物学理解对于有效的靶向设计至关重要。
结合抗体的mRNA-LNP设计
目前有两种主要方法可用于LNP表面的靶向抗体修饰。
第一种方法在LNP制剂中加入“锚定”脂质,在颗粒制备后可以与功能配体缀合(图2a)。常用的锚定脂质包括磷脂酰乙醇胺、PEG-马来酰亚胺和磷脂酰肌醇,可与靶向抗体化学偶联。该方法能够通过调整锚定脂质的摩尔质量来控制LNP上存在的靶向部分的数量。然而,该方法也可能产生偶联不完整或靶向不正确的抗体,例如具有暴露于Fc区域的定向抗体,这可能导致不需要的免疫反应并影响药代动力学特征和分布。此外,这种策略效率低下,导致多清除途径对未结合部分的清除。
第二种策略涉及LNP制剂制备,然后通过优化共孵育将疏水性抗体衍生物(例如脂质-配体偶联物)插入到预成型的LNP中。这种方法不需要LNP配方中的反应性锚定脂质,并且可以更好地控制抗体-脂质偶联。已有研究报道,该方法可以更好地保留LNP的原始理化性质,并成功将mRNA有效载荷递送到小鼠中的特定免疫细胞群和癌细胞。
尽管主动靶向已经获得了广泛的研究,然而同被动靶向一样存在的类似问题,如实体瘤的渗透仍未得到妥善解决。
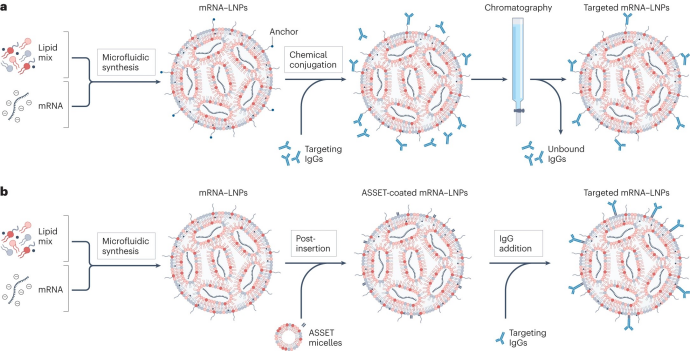
图2. LNP抗体修饰策略
临床实践与问题
开发癌症疫苗的研究项目正试图同时编码多种抗原,从而提供个性化疫苗。这种疫苗依赖于mRNA治疗平台的优势:其模块化、包封大量有效载荷的能力以及生产速度。Moderna适用LNP系统的mRNA-4157肿瘤疫苗可以在编码多表位的单个mRNA连接体中编码多达34个新抗原,通过编码切割敏感位点穿插的短表位连接体(short epitope concatemers)来实现。
个性化癌症疫苗需要高速的产品生产。据报道,从患者来源的肿瘤样本测序到个性化疫苗的生产和给药时间可以缩短至30-40天。与基于小分子或蛋白质的疗法不同,大多数mRNA有效载荷仅在核苷酸序列上有所不同,因此可以快速进行个性化生产。此外,mRNA-LNP可以通过传统方式以外的各种途径进行给药,例如通过超声成像引导的腹股沟淋巴注射。
临床中还普遍关注重复注射导致的LNP免疫原性和耐受性,以及组织中的脂质积累。从目前主要的几项肿瘤疫苗临床实验和FDA等监管的反应来看,在当前的开发阶段mRNA-LNP肿瘤免疫疗法对这些患者的益处被认为超过了潜在的缺陷。
除了免疫原性之外,其他研究还显示mRNA-LNP递送在小鼠,非人灵长类动物和人类中是不同的。研究表明,mRNA-LNP疫苗诱导人类分泌IL-1,而在小鼠中上调了IL-1受体拮抗剂蛋白,出现差异性激活。小鼠、非人灵长类和人类之间的这些差异可能反映了其他尚未揭示的机制作用,应该在未来的研究中进一步探索。
未来研究方向
mRNA–LNP除了改进靶向策略外,还面临着一些挑战。挑战之一是mRNA-LNP在冰箱温度或室温下的不稳定性,这被认为是由mRNA本身的不稳定性引起的,而不是LNP载体的不稳定性。其次,LNP不是惰性的,可能增加宿主中的细胞因子水平引起炎症。虽然这种类似佐剂效应的特性可能对免疫治疗有益,但存在mRNA–LNP给药后补体激活相关的假性过敏反应。此外,在接种过基于mRNA-LNP的COVID-19疫苗的个体中检测到抗PEG抗体。对于需要重复给药的方案,这些抗PEG抗体可能导致LNP的快速清除,从而阻碍治疗效果。
有意思的是,mRNA序列的可编程设计也被用于细胞特异性翻译,可以通过操纵mRNA分子的结构动力学激活特定细胞内的翻译。一些方法利用mRNA 5′非翻译区(UTR)中的反应性3D结构,可以在靶细胞中差异存在的分子和/或序列存在的情况下激活或阻止翻译起始,例如依靠IRES启动翻译。此外,细胞类型之间独特的tRNA表达模式可用于在不同细胞群和/或组织中以不同的速率翻译序列。最后,细胞特异性microRNA(miRNA)的结合序列可以掺入UTR中,以影响不同细胞群的降解速率(图3a)。
改善mRNA-LNP靶向的另一种方法将依赖于更好地了解影响不同LNP制剂生物分布的因素。具体而言,不同可电离脂质成分结构与某些器官和细胞分布趋势之间的构效关系需要更好的机理表征(图3b)。
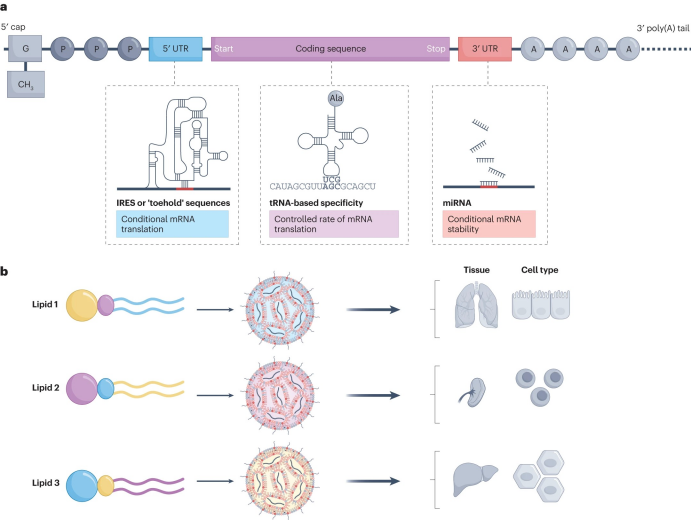
图3. 未来靶向设计的策略
总结
在过去的几年中,使用被动或主动方法将mRNA-LNP靶向肿瘤进行免疫治疗取得了有希望的进展。任何一种方法的选择通常取决于易于生产和特异性之间的折中。针对特定恶性肿瘤的靶向策略常涉及诸如是否已确定肿瘤可靶向特征、肿瘤内注射的可行性以及转移倾向等因素。该决定还应考虑到不同有效载荷、脱靶毒性以及特定表达对治疗效果的综合影响。
CMC工艺上的限制虽然有时在药物疗法设计过程中被忽视并推迟到药物开发过程的后期阶段,但理应尽早解决。事实上,CMC生产的考虑因素对于临床实施所需的大规模生产药物至关重要。
论文链接:
https://www.nature.com/articles/s41571-023-00811-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#mRNA-LNP#可通过#主动被动#方法#靶向#进行#免疫治疗#,#未来发展#需要对抗PEG抗体可能导致LNP的快速清除阻碍治疗效果方面进行研究。
54
不错,学习了。
46