Nat Med:胃肠道间质瘤二线治疗选瑞派替尼or舒尼替尼?血液ctDNA揭晓答案
2024-02-06 苏州绘真医学 苏州绘真医学 发表于陕西省
在这项预先设定的探索性分析中,研究者展示了伊马替尼治疗失败时的KIT突变情况,并根据ctDNA分析确定的基线KIT突变状态,评估了瑞派替尼和舒尼替尼在晚期GIST患者中的疗效。

INTRIGUE是一项开放标签、3期研究,纳入了伊马替尼治疗后疾病进展或不耐受,并被随机分配接受每日1次瑞派替尼(150mg)或舒尼替尼(50mg)治疗的成年晚期胃肠间质瘤患者。在初期分析中,瑞派替尼组的无进展生存期(PFS)未优于舒尼替尼组。在临床和非临床研究中,根据KIT突变的外显子位置,瑞派替尼和舒尼替尼表现出不同的活性。因此,研究者推测使用循环肿瘤DNA(ctDNA)进行突变分析可能提供进一步的见解。
在这项探索性分析中(N=362),基于74个基因的ctDNA二代测序对基线外周血全血进行分析。在280/362(77%)个样本中检测到ctDNA,在213/362(59%)例患者中检出KIT突变。伊马替尼耐药突变发生在KIT ATP-结合袋(外显子13/14)和激活环(外显子17/18)。突变亚组评估显示2个具有不同治疗效果的互斥人群。仅KIT外显子11+13/14突变患者接受舒尼替尼(n=20)治疗的PFS优于瑞派替尼(n=21)(中位数,15.0个月vs. 4.0个月)。仅KIT外显子11+17/18突变的患者接受瑞派替尼(n=27)治疗的PFS优于舒尼替尼(n=25)(中位数,14.2个月vs. 1.5个月)。这项探索性分析的结果提示,ctDNA测序可能改善对单药治疗疗效的预测,并支持在有KIT外显子11+17/18突变的患者中进一步评估瑞派替尼的疗效。
研究背景
胃肠间质瘤(GIST)是最常见的胃肠道肉瘤,约80%的病例由KIT突变驱动,多达10%由血小板源性生长因子受体α(PDGFRA)突变驱动。KIT/PDGFRA酪氨酸激酶抑制剂(TKI)伊马替尼是晚期GIST患者的有效一线治疗药物,然而,大多数患者最终因继发性耐药突变而发生疾病进展。在伊马替尼治疗后疾病进展的KIT突变GIST患者中,约90%携带新获得的继发性KIT突变,这些突变最常出现在ATP-结合袋(由外显子13/14编码)和/或激活环(由外显子17/18编码)。
舒尼替尼已被批准用于伊马替尼治疗进展或不耐受后的晚期GIST患者的二线治疗。在这项注册的3期试验中,接受舒尼替尼治疗的患者的总中位无进展生存期(PFS)为5.6个月。然而,该3期试验未分析继发性突变,而舒尼替尼的疗效已被证明取决于对伊马替尼耐药的KIT突变位点。在一项1/2期研究(NCT00457743)中,在携带KIT ATP-结合袋继发性耐药突变的患者中,舒尼替尼的中位PFS为7.8个月,而在携带激活环突变的患者中,舒尼替尼的中位PFS为2.3个月。
根据3期INVICTUS研究的结果,开关控制TKI瑞派替尼被批准用于既往接受过包括伊马替尼在内的≥3种TKI治疗的晚期GIST成人患者。在3期INTRIGUE试验中,与舒尼替尼相比,瑞派替尼在伊马替尼治疗进展或不耐受的KIT外显子11意向治疗(ITT;中位PFS分别为8.3个月和7.0个月;P=0.36)和总体ITT人群(中位PFS分别为8.0个月和8.3个月;名义P=0.72)显示出相似的疗效,这提示作为二线治疗,瑞派替尼显示出与舒尼替尼相当的疗效。瑞派替尼的安全性也优于舒尼替尼,发生3/4级治疗相关不良事件(TEAEs)的患者较少。根据INTRIGUE试验的这些初期结果,对于舒尼替尼不耐受的晚期GIST患者,瑞派替尼作为首选二线治疗方案最近被纳入美国国家综合癌症网络(NCCN)GIST肿瘤临床实践指南(2023.v1版)。在所有评估的突变亚组(KIT外显子9、11、13和17)中,作为四线或更晚的治疗,瑞派替尼的PFS均超过安慰剂,这提示无论基线突变状态如何,瑞派替尼在较晚线治疗中均具有广泛的活性。
通过活检获得的肿瘤组织是癌症突变分析的主要来源。然而,循环肿瘤DNA(ctDNA)分析正变得越来越常见。尽管使用ctDNA有局限性(例如样本处理问题、检测特异性、低脱落疾病),但这些分析可能提供反映全身肿瘤负荷的更全面信息,而不是反映组织活检采集的有限区域。鉴于不同KIT突变位点的TKIs活性不同,以及舒尼替尼在继发KIT外显子17/18突变患者中的活性较差,研究者假设使用ctDNA对突变亚组进行进一步研究可以进一步了解这些药物作为二线治疗的疗效。在这项预先设定的探索性分析中,研究者展示了伊马替尼治疗失败时的KIT突变情况,并根据ctDNA分析确定的基线KIT突变状态,评估了瑞派替尼和舒尼替尼在晚期GIST患者中的疗效。
研究方法
INTRIGUE(NCT03673501)是一项随机、开放标签、全球性、多中心、3期临床研究,在伊马替尼一线治疗期间发生疾病进展或不耐受的晚期GIST患者中比较了瑞派替尼和舒尼替尼的疗效和安全性。根据组织活检病理报告的突变状态(KIT外显子11、KIT外显子9、KIT/PDGFRA野生型和其他KIT突变(除外显子9或11外)/PDGFRA突变)和伊马替尼不耐受情况进行分层。患者性别由患者自我报告,研究设计中未考虑。患者被随机(1∶1)接受每日1次150 mg瑞派替尼(持续给药)或每日1次50 mg舒尼替尼(在6周的周期中,用药4周/停药2周)治疗。该试验不允许跨组。
患者纳入标准为年龄≥18岁,在接受研究药物治疗前21天内,经组织学证实为GIST,且符合改良实体肿瘤疗效评价标准1.1版(mRECIST v1.1)标准,有一个或多个可测量的病灶。符合纳入标准的患者需提供组织样本存档和病理报告,通过组织PCR或任何DNA测序分析详细描述KIT/PDGFRA突变状态,在伊马替尼治疗期间发生疾病进展或表现出伊马替尼不耐受,在首剂研究药物给药前10日停止伊马替尼治疗,美国东部肿瘤协作组体能状态评分≤2分,并且具备可接受的器官功能和骨髓储备。
在本次预设的探索性分析中,基线时(第一周期的第1日)外周血全血通过10ml的cfDNA采血管采集,并运至中央实验室进行血浆分离。采用基于NGS的74基因ctDNA检测对样本进行分析。
KIT外显子11+13/14的患者定义为携带KIT外显子11的原发性突变,且只在KIT ATP-结合袋有继发性耐药突变(不包括KIT外显子9、17和18突变的患者)。KIT外显子11+17/18的患者定义为携带KIT外显子11的原发性突变,且只在KIT激活环有继发性耐药突变(不包括有KIT外显子9、13和14突变的患者)。目前的探索性分析不包括通过肿瘤活检获得的突变信息,仅提供了典型继发性KIT突变(ATP-结合袋和激活环)患者的详细结局数据。
INTRIGUE试验的主要疗效终点是采用mRECIST v1.1进行独立影像学审核(IRR)的PFS;关键次要终点是使用mRECIST v1.1进行IRR的ORR和OS。在本次预设的探索性分析中,研究者根据位点和密码子分析了ATP-结合袋(外显子13/14)和激活环(外显子17/18)中伊马替尼耐药的继发性KIT突变频率,并确定了每例患者的突变数量,从而确定了基线突变谱。研究者通过PFS、ORR和OS评估了可能与治疗应答相关的突变生物标志物,PFS、ORR和OS是研究方案预先设定的终点。本文还报告了安全性数据。除OS(OS的数据更新截止日期为2022年9月1日)之外,所有结局的数据截止日期均为2021年9月1日。
研究结果

▲453例ITT人群的基线特征(图片来源于J. Clin. Oncol. 40, 3918–3928 (2022).)
ctDNA样本的可评估性和KIT突变情况:
在总ITT人群的453例患者中,对362例(80%;图1)患者进行了ctDNA分析。共有280/362例(77%)患者可检测到用于分析单核苷酸变异(SNVs)和/或插入/缺失(INDELs)的ctDNA,213/362例(59%)患者检测到KIT突变(图1)。观察到的KIT突变包括KIT外显子9(n=36/213(16.9%))、外显子11(n=157/213(73.7%))、外显子13/14(n=81/213(38.0%))和外显子17/18(n=89/213(41.8%)),如果患者携带多个突变,则属于多个组(图1)。36例患者检测到原发KIT外显子9突变,最常见的是密码子502-503的AY重复(n=33);157例患者存在原发KIT外显子11突变,其中最常见的突变发生在密码子557-558(n=82)。

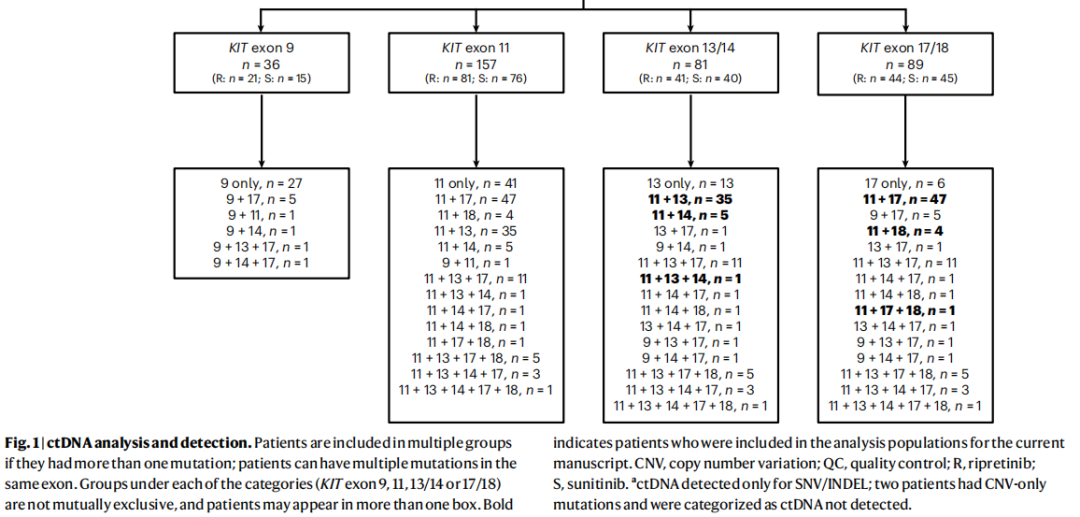
图1
大多数患者有KIT外显子13和/或外显子17的继发性耐药突变。总体而言,在KIT ATP-结合袋(外显子13/14)和激活环(外显子17/18)中观察到42个独特的继发性耐药突变。最常见的继发性耐药突变是外显子13的V654A(n=65),其次是外显子17的Y823D(n=37)和N822K突变(n=26)(图2)。
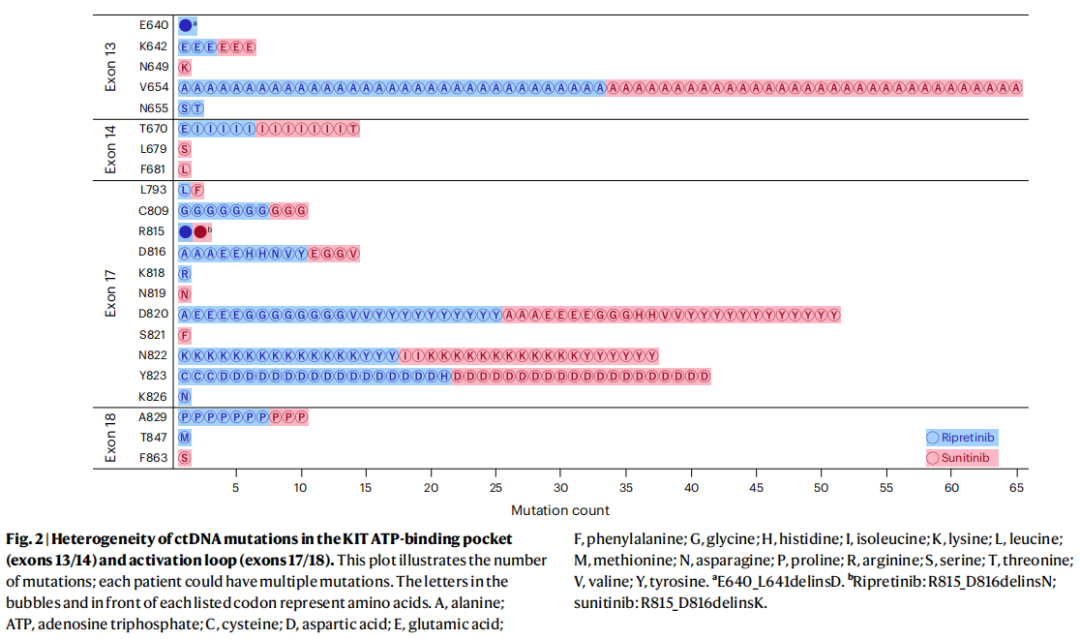
图2
根据突变亚组分析中位PFS时,观察到两个截然相反的人群(图3)。在携带原发KIT外显子11突变且伊马替尼耐药突变(仅外显子13/14(41/362(11%)))的患者中,和在携带原发KIT外显子11突变且伊马替尼耐药突变(仅外显子17/18(52/362(14%)))的患者中,观察到不同的疗效。基于这些发现,本文将介绍这两个相互排斥、截然相反的人群的结局。

图3
患者:
在KIT外显子11+13/14和KIT外显子11+17/18人群之间,以及两个治疗组之间,基线人口统计学和临床特征很平衡(表1)。KIT外显子11+13/14和KIT外显子11+17/18人群的中位年龄分别为59.0岁和60.0岁。患者的种族是自我报告的,大多数患者是来自北美或欧洲的白种人男性(表1)。
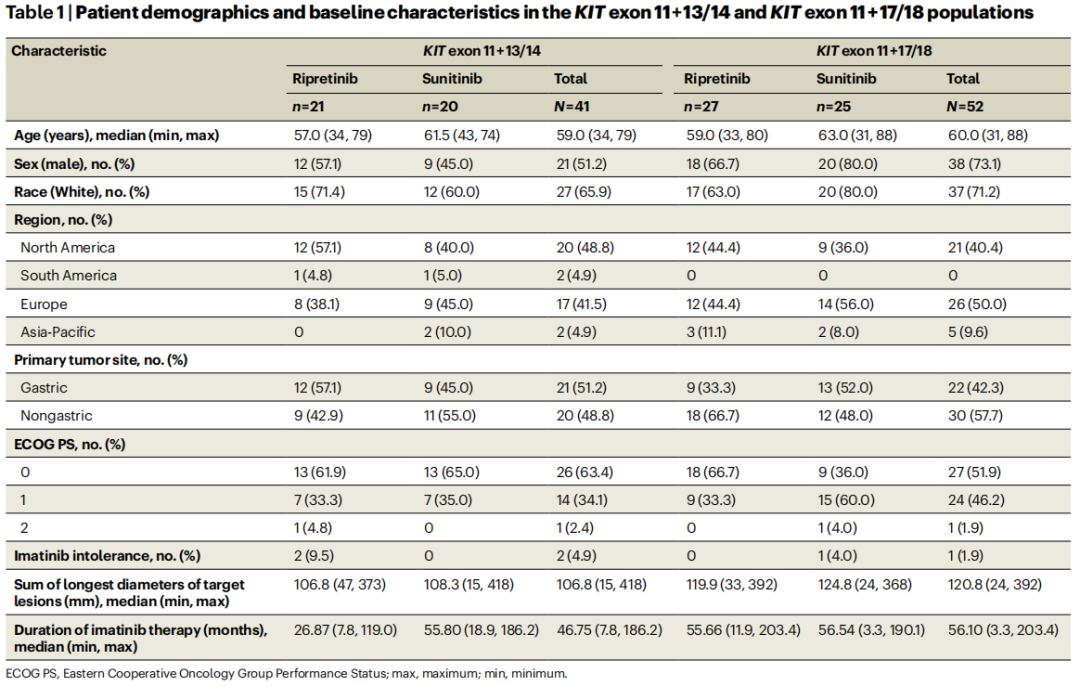
表1
疗效:
在KIT外显子11+13/14人群中,舒尼替尼的PFS优于瑞派替尼(中位PFS分别为15.0个月和4.0个月;HR,3.94;95%CI,1.71-9.11;名义P=0.0005;图3和4a)。相反,在有KIT外显子11+17/18突变的患者中,与舒尼替尼相比,瑞派替尼改善了PFS(中位PFS分别为14.2个月和1.5个月;HR,0.22;95%CI,0.11-0.44;名义P<0.0001;图3和4b)。当考虑到突变亚组之间的多重治疗比较时,这些结果仍然稳定,治疗和突变亚组之间存在显著交互作用(名义P<0.0001)。

图4
与初步分析中总体ITT和KIT外显子11 ITT人群的PFS相似,各治疗组之间总体(分析的所有样本)和任何KIT外显子11组的PFS率相似(图3)。对于只有基线KIT外显子11突变的患者,舒尼替尼组的PFS优于瑞派替尼组(中位数,16.3个月vs . 2.2个月;HR,2.24;95%CI,0.99-5.09;名义P=0.0460;图3);在KIT ATP-结合袋和激活环同时存在伊马替尼耐药继发性突变的患者中(n=22/362(6%)),舒尼替尼和瑞派替尼之间无差异(HR,1.07;95%CI,0.41-2.84;名义P=0.8843;图3)。
在KIT外显子11+13/14人群中,瑞派替尼组的客观缓解率(ORR)为9.5%,而舒尼替尼组为15.0%(缓解差异(RD),-5.5%;95%CI,- 27.6~16.2;名义P=0.5922;图5a, b)。在KIT外显子11+17/18人群中,瑞派替尼组的ORR高于舒尼替尼组(44.4% vs 0%;RD,44.4%;95%CI,23.0~62.7;名义P=0.0001;图5c, d)。在两个治疗组中,KIT外显子11+13/14和KIT外显子11+17/18人群的总生存(OS)率分别为51.2%和50.0%。在KIT外显子11+13/14人群中,接受舒尼替尼治疗的患者未达到中位OS,而接受瑞派替尼治疗的患者的中位OS为24.5个月(HR,1.75;95%CI,0.72~4.24;名义P=0.2085),舒尼替尼和瑞派替尼的中位随访时间分别为24.1个月和30.7个月。在KIT外显子11+17/18人群中,与舒尼替尼相比,瑞派替尼改善了OS(中位数,未达到 vs 17.5个月;HR,0.34;95%CI,0.15~0.76;名义P =0.0061),瑞派替尼组和舒尼替尼组的中位随访时间分别为29.7个月和31.4个月。考虑到突变亚组之间的多重治疗比较,这些结果仍然稳定,治疗和突变亚组之间存在显著交互作用(名义P=0.0179)。
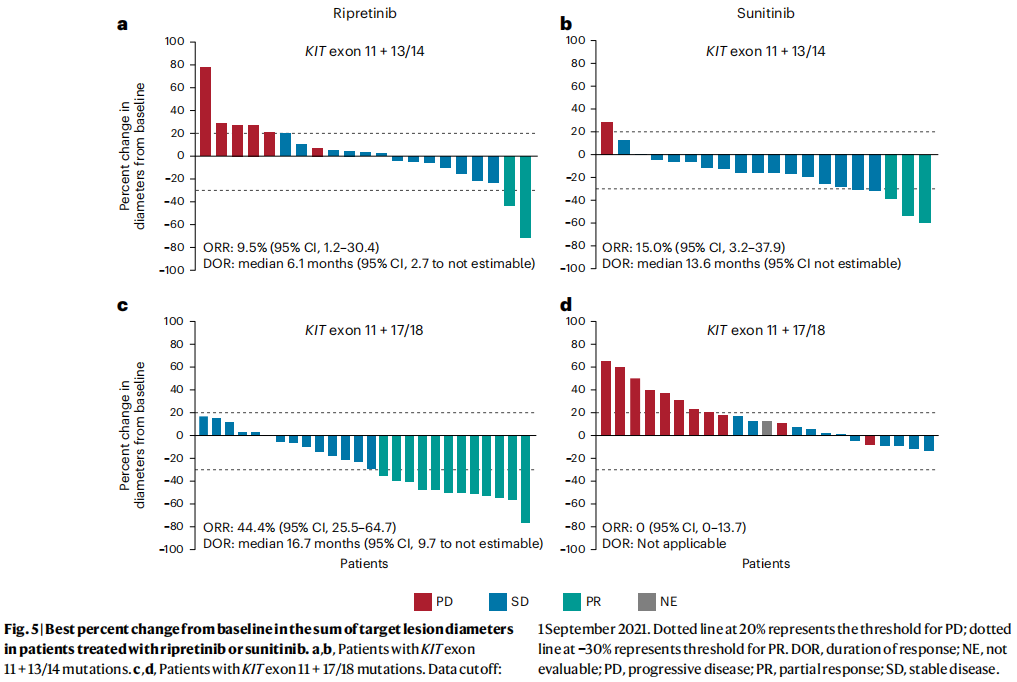
图5
安全性:
在KIT外显子11+13/14人群中,瑞派替尼和舒尼替尼的中位治疗持续时间分别为4.6个月和9.5个月。在KIT外显子11+17/18人群中,瑞派替尼和舒尼替尼的中位治疗持续时间分别为14.0个月和3.0个月。观察到的安全性似乎与初步分析一致。舒尼替尼组3/4级药物相关TEAE的发生率高于瑞派替尼组(KIT外显子11+13/14:50.0% vs 28.6%;KIT外显子11+17/18:50.0% vs 33.3%)。在KIT外显子11+13/14人群中,与接受瑞派替尼治疗的患者相比,接受舒尼替尼治疗的患者中有更多的患者因任何TEAE而中断给药和减量(分别为30.0% vs 23.8%和45.0% vs 4.8%)。相反,在KIT外显子11+17/18人群中,与舒尼替尼相比,接受瑞派替尼治疗的患者中有更多的患者因TEAE而中断给药和降低剂量(分别为59.3%对41.7%和37.0%对29.2%)。然而,当观察研究前12周内因任何TEAE而中断给药和减少次数时,舒尼替尼组的比例高于瑞派替尼组,或者两组之间的比例相当。在瑞派替尼组中,无论突变亚组如何,最常见的任何级别TEAE均为脱发(KIT外显子11+13/14:66.7%;KIT外显子11+17/18:77.8%);在舒尼替尼治疗的KIT外显子11+13/14和11+17/18人群中,最常见的TEAE分别为掌跖红肿感觉障碍综合征(60.0%)和高血压(50.0%)。
讨 论
此项对既往接受过治疗的晚期GIST进行的3期INTRIGUE试验的探索性分析表明,基于ctDNA二代测序(NGS)分析伊马替尼耐药的继发性KIT突变对于选择二线治疗具有潜在价值。在这项分析中,在KIT ATP-结合袋(外显子13/14)和激活环(外显子17/18)中有42个独特的突变。已知绝大多数这些变异会导致伊马替尼耐药,但一些意义不确定的新变异可能不会。在携带GIST最常见的原发性驱动突变(KIT外显子11突变)的患者中,KIT ATP-结合袋的继发性耐药突变患者接受舒尼替尼治疗的临床获益显著高于瑞派替尼(中位PFS,分别为15.0个月和4.0个月;P=0.0005),而KIT激活环的继发性耐药突变的患者对瑞派替尼显示临床获益,但舒尼替尼无临床获益(中位PFS,分别为14.2个月和1.5个月;P<0.0001)。虽然这些结果受到分析探索性的限制,但在考虑到针对不同基线特征进行或未进行校正的各突变亚组之间的多重治疗比较时,这些人群的差异是稳定的。
尽管强烈建议在开始TKIs治疗之前对初治晚期GIST患者进行突变检测以实现最佳治疗,但在美国只有少数患者进行突变检测。主要基因型决定了携带这些激酶激活突变患者对伊马替尼(KIT外显子11 vs KIT外显子9)、阿伐替尼(PDGFRA外显子18 D842V突变)以及NTRK和BRAF抑制剂的药物(和剂量)选择。然而,除了基线突变检测之外,支持对继发突变进行常规分析以优化下一线治疗决策的研究有限。在大多数GIST治疗中心,根据上一线治疗期间的进展或不耐受情况,KIT突变GIST患者依次将伊马替尼、舒尼替尼、瑞戈非尼和瑞派替尼作为一至四线治疗。在INTRIGUE研究的初步结果中,在未经过分子选择的人群中,就PFS而言,瑞派替尼作为二线治疗并不优于舒尼替尼。然而,目前的探索性分析提示,ctDNA可识别出可能优先从瑞派替尼二线治疗(而非推荐的舒尼替尼二线治疗)中获益的患者分子亚群。
迄今为止,突变分析主要在组织活检样本中进行。然而,组织活检是对单个肿瘤病变的一部分进行采样的侵入性操作,在常规临床实践中,病变内部和/或跨病变进行多次活检是不合理的。血浆ctDNA分析理论上可以克服这些局限性,因为血液易于获取,并且有可能反映多个转移部位的全部突变负荷,并确定可能从特定癌症治疗中获益的患者。一些报道表明GIST的ctDNA脱落率低,然而,在活动期、转移性疾病中ctDNA的检出率较高,并且本研究表明,在既往接受过伊马替尼治疗的晚期GIST患者中,ctDNA的检出率较高(280/362;77%)。之前的一项研究表明,在转移性GIST患者的一个小队列中,ctDNA与肿瘤组织的NGS检测结果具有良好的一致性。此外,在ctDNA样本中检出的伊马替尼耐药突变未在组织活检中观察到,这提示ctDNA检测可能使医师和研究人员能够有效监测晚期GIST的继发性耐药突变和治疗。因此,这些数据可能支持使用敏感且微创的ctDNA指导GIST的治疗方法,需要在前瞻性试验中进行进一步研究。
舒尼替尼对KIT ATP-结合袋和激活环中伊马替尼耐药突变的活性差异之前在临床和非临床研究中均有记录。在一项评估舒尼替尼治疗晚期GIST患者的非随机、单组试验中,KIT激活环内的伊马替尼耐药继发突变(在单个肿瘤活检中检出)与快速临床进展相关(中位PFS,2.3个月),而在KIT ATP-结合袋内存在继发突变的患者中,PFS显著较长(中位PFS,7.8个月;p=0.0157)。研究者推测ctDNA可能特别有助于确定有效的单药治疗方法,因为似乎有一部分晚期GIST患者可能无法从舒尼替尼二线治疗中获益。
临床前,瑞派替尼抑制了GIST和非GIST细胞系中的多种KIT突变,包括在晚期GIST患者中观察到的许多常见原发性和继发性耐药突变。然而,无论原发突变如何(KIT外显子11或9),瑞派替尼对KIT ATP-结合袋中的继发突变的疗效均低于对激活环的疗效。相反,与安慰剂相比,瑞派替尼在4线晚期GIST患者中显示出独立于基线突变状态的临床活性,包括携带KIT ATP-结合袋突变(KIT外显子13)的亚组。然而,该亚组包括携带KIT外显子13突变的任何患者,而不考虑其他激活环突变,并且该研究没有活性对照组。在本研究中,在ATP-结合袋和激活环(KIT外显子11+13/14+17/18)携带共突变的患者,无论分配何种治疗,其表现均相似。然而,由于患者数量少(每个治疗组11例患者),需要进一步研究。
基于目前的研究结果,一项3期、随机、多中心、开放标签研究评估瑞派替尼和舒尼替尼在既往接受过伊马替尼治疗且携带KIT外显子11+17和/或18突变(无KIT外显子9、13或14)患者中的疗效正在进行中(INSIGHT;NCT05734105)。在这项后续的3期研究中,美国食品药品监督管理局(FDA)授予瑞派替尼突破性治疗认定。INSIGHT的目的不仅是确认在这项探索性分析中,瑞派替尼治疗KIT外显子11+17/18突变(激活环)患者的PFS,而且还确认缓解率(ORR,44.4%),这几乎是舒尼替尼治疗KIT外显子11+13/14突变患者的ORR的3倍(ATP-结合袋;ORR,15.0%)。这一发现可以用以下观点来解释:舒尼替尼最初是作为血管内皮生长因子受体的强效抑制剂开发的,而瑞派替尼经过优化,目的是抑制活化的KIT(而不是与ATP与激酶的结合竞争),以减少不必要的毒性。应答的这一差异可能反映了针对药物敏感突变,瑞派替尼和舒尼替尼的激酶抑制水平不同。然而,未进行治疗中活检来证实这一假设。
本研究的局限性包括分析的探索性,因此,所有报告的P值都是名义值,在临床实践中不能声称或引用统计学显著性。此外,一些突变亚组的患者数量较少,因此难以解读一些结局。还有一部分患者未检出ctDNA,因此无法采用本文中提出的个体化治疗方法。此外,与技术相关的挑战,如影响ctDNA稳定性和样本处理的变量,可能导致检测灵敏度降低。最后,本研究仅评估了伊马替尼耐药的继发性KIT突变,需要进一步研究来确定任何不依赖于KIT的耐药机制。
总之,在这一队列中,ctDNA中包含原发KIT外显子11突变加上仅限于KIT外显子17/18的继发性突变的患者从瑞派替尼中获益超过从舒尼替尼,但存在探索性生物标志物分析的所有局限性。相比之下,具有相同原发突变(KIT外显子11)加上仅限于KIT外显子13/14的继发性突变的患者从舒尼替尼中获得的益处超过瑞派替尼。首先,本研究数据表明,ctDNA分析可能代表了一种强大的、无创的诊断工具,以识别在伊马替尼治疗期间发生疾病进展的晚期GIST患者亚组,这些患者可能从单一TKI治疗中获得长期的临床获益。为此,与仅提供单个病变信息的组织活检相比,ctDNA分析可以广泛地确定个体患者的耐药异质性。我们需要进一步研究瑞派替尼作为二线治疗的疗效,INSIGHT 3期试验(NCT05734105)正在进行中。
参考文献:
Heinrich, Michael C et al. “Ripretinib versus sunitinib in gastrointestinal stromal tumor: ctDNA biomarker analysis of the phase 3 INTRIGUE trial.” Nature medicine, 10.1038/s41591-023-02734-5. 5 Jan. 2024, doi:10.1038/s41591-023-02734-5

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#舒尼替尼# #胃肠道间质瘤# #二线治疗# #ctDNA# #瑞派替尼#
26