Basic Res Cardiol 同济大学魏珂团队发现TSP-1和Reelin通过Vldlr调控心脏的生长和修复
2023-12-29 论道心血管 论道心血管 发表于上海
该研究揭示了Vldlr通过整合细胞外信号Thrombospondin 1 (TSP-1)及Reelin,调控心肌细胞的细胞周期和细胞存活的新功能。
心肌梗死是全球死亡率最高的心血管疾病之一。心肌梗死是由于冠状动脉的血流急剧减少或中断,导致相应位置的心肌细胞缺血性坏死。而成年哺乳动物的心肌细胞几乎丧失增殖能力,致使心脏功能难以恢复。但在出生后的较短时间窗口内,哺乳动物的心肌细胞仍具有增殖能力。因此,了解出生后的心肌细胞是如何丧失增殖能力,以及找到激活成年心肌细胞重新进入细胞周期的方法是十分重要的。近年来,多项研究表明来自心脏中非心肌细胞的信号可以刺激心肌细胞的增殖。例如,来自心外膜的Fstl1、来自细胞外基质的Agrin和来自巨噬细胞的Oncostatin M均已被证明可促进新生小鼠心肌细胞的增殖[1-3]。然而,导致成年哺乳动物心肌细胞增殖能力丧失的胞外信号仍有待发现。
2023年12月26日,来自同济大学生命科学与技术学院和附属东方医院再生医学研究所的魏珂教授团队在Basic Research in Cardiology发表题为“Thrombospondin 1 and Reelin act through Vldlr to regulate cardiac growth and repair”的论文[4]。该研究揭示了Vldlr通过整合细胞外信号Thrombospondin 1 (TSP-1)及Reelin,调控心肌细胞的细胞周期和细胞存活的新功能。

首先,研究人员通过分析小鼠心肌细胞的转录组数据,鉴定出三种在小鼠出生后表达上调且在心肌细胞中表达较高的受体:Hjv、Itga7和Vldlr (图1b)。其中,Vldlr是一种在脑、骨骼肌和心脏中高表达的跨膜脂蛋白受体,可与Vldl结合并在Vldl-甘油三酯代谢中发挥重要作用。更重要的是,Vldlr已被证明可与多种细胞外配体相互作用,介导多种下游信号[5]。然而,Vldlr是否参与调控心肌细胞的增殖尚不清楚。在这项工作中,研究人员通过体外敲低及过表达实验发现Vldlr可抑制原代大鼠心肌细胞的增殖(图1d-i)。随后,研究人员通过免疫荧光染色发现,在Vldlr基因敲除小鼠中,新生小鼠心肌细胞的增殖增强(图1j-m)。
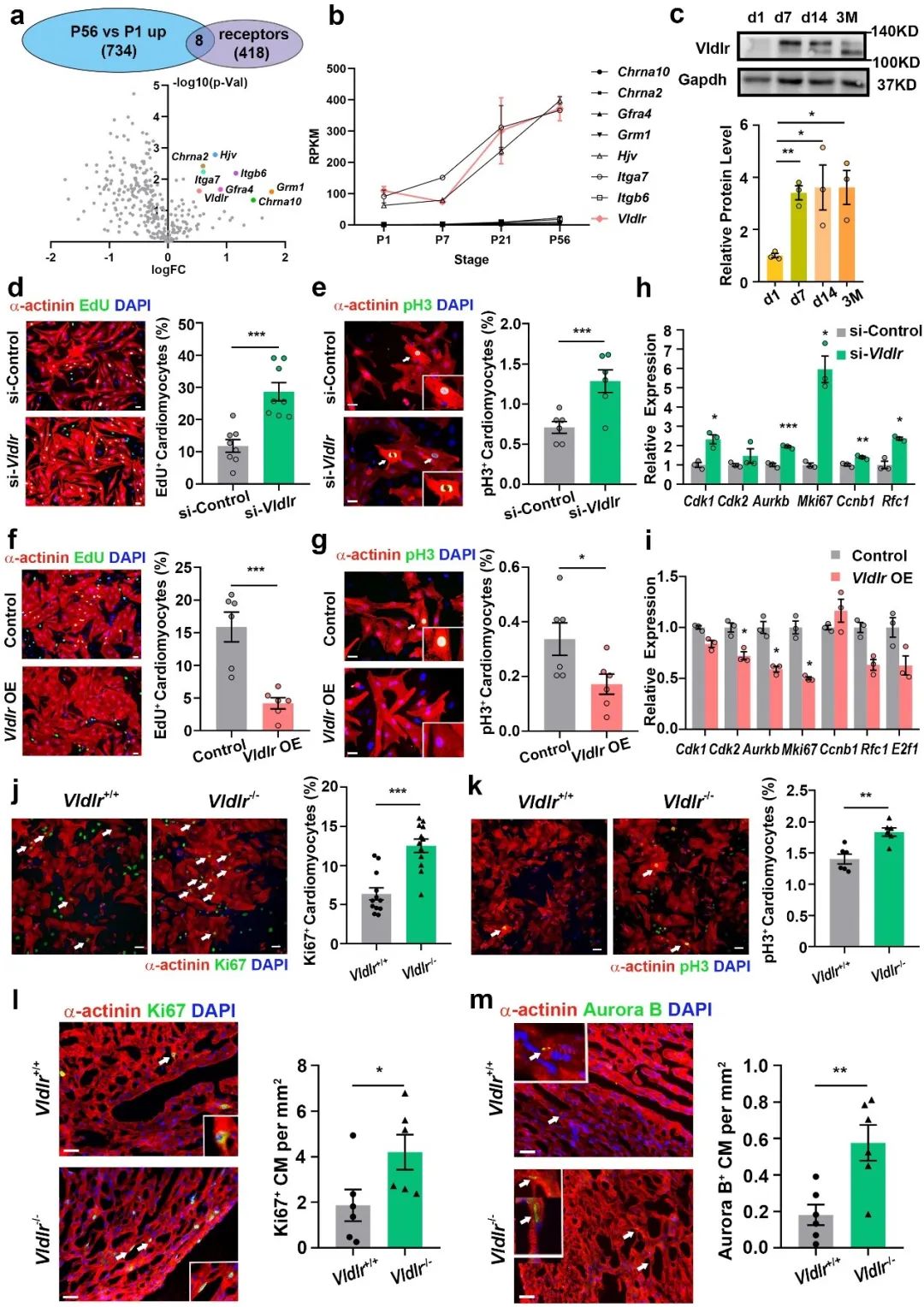
图1. Vldlr抑制新生小鼠心肌细胞的增殖
Vldlr作为心肌细胞上的膜受体可接受多种配体的信号。Reelin,一个众所周知的Vldlr配体,在心脏的施旺细胞和淋巴内皮细胞中表达,为了验证Reelin是否可参与调控心肌细胞增殖,研究人员在原代大鼠心肌细胞中加入Reelin重组蛋白,发现Reelin可有效地促进原代大鼠心肌细胞的增殖。而在小鼠体内敲除Reln,则可抑制新生小鼠心肌细胞的增殖。这一结果也与2020年Liu等人在Nature发表的结果相一致,即Reelin可促进心脏的生长和修复[6]。既往研究表明,敲除Reln及其受体Vldlr/Lrp8具有相似的神经发育缺陷。然而令人困惑的是,Reelin和Vldlr在心肌细胞的增殖上却具有完全相反的作用。鉴于Vldlr在出生后的心脏中的高度富集,而Reelin在出生后的心脏中表达的降低,研究人员推断小鼠心脏中还存在另一个在心脏中高表达的配体:可作用于Vldlr并抑制心肌细胞增殖。随后,研究人员确定了TSP-1—在成年小鼠心脏中高表达的Vldlr的另一个配体。体内外实验发现,TSP-1可抑制新生小鼠心肌细胞增殖。进一步研究发现,TSP-1和Reelin竞争性地结合Vldlr并且TSP-1在心肌细胞增殖中起主导作用(图2)。
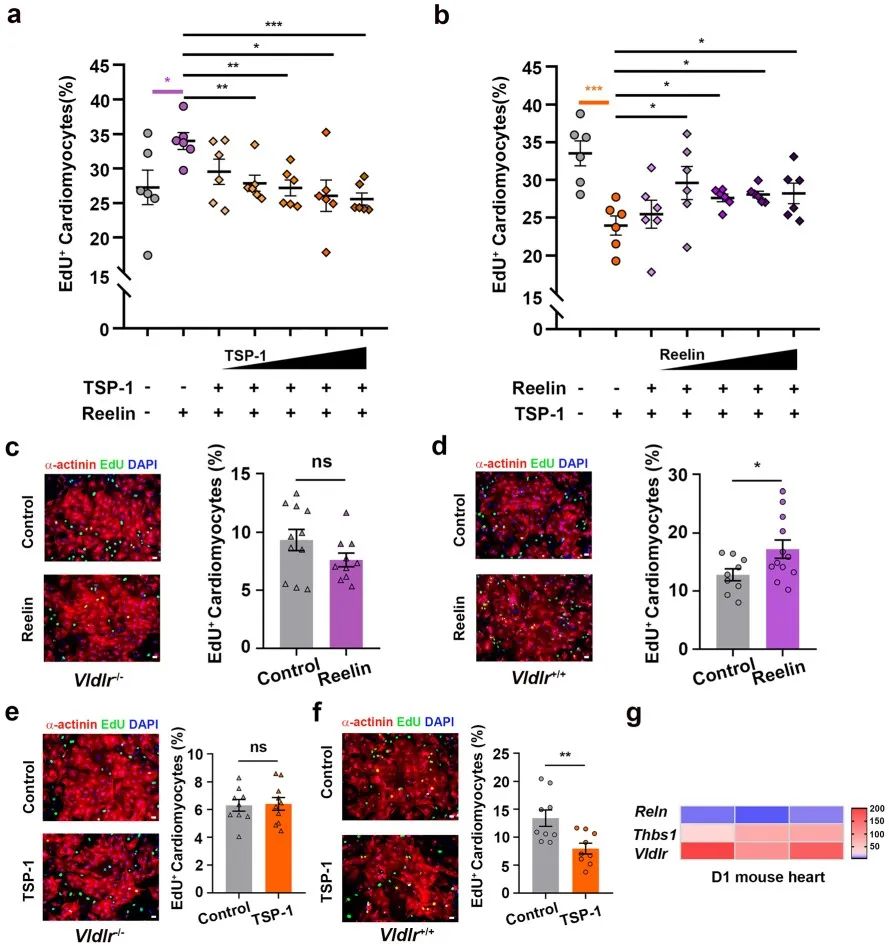
图2. TSP-1和Reelin竞争性地结合Vldlr并且TSP-1在心肌细胞增殖中起主导作用
为探寻Reelin、TSP-1和Vldlr调控心肌细胞增殖的下游机制,研究人员通过整合相关RNA-Seq数据并进行WGCNA分析,推测Reelin、TSP-1和Vldlr调控心肌细胞增殖的下游信号可能是由小GTPase来介导的。进一步的机制研究发现:TSP-1/Reelin-Vldlr信号通路可调控Rac1活性,进而调控Yap S127位点的磷酸化以及随后的YAP入核,最终起到调控心肌细胞增殖的作用。更重要的是,Reln敲除新生小鼠在心尖切除后表现出心肌细胞增殖和心脏再生受损,而心脏特异性Thbs1缺失和心肌细胞特异性Vldlr缺失则可促进小鼠心肌梗死后心肌细胞的增殖和心脏的保护作用(图3)。
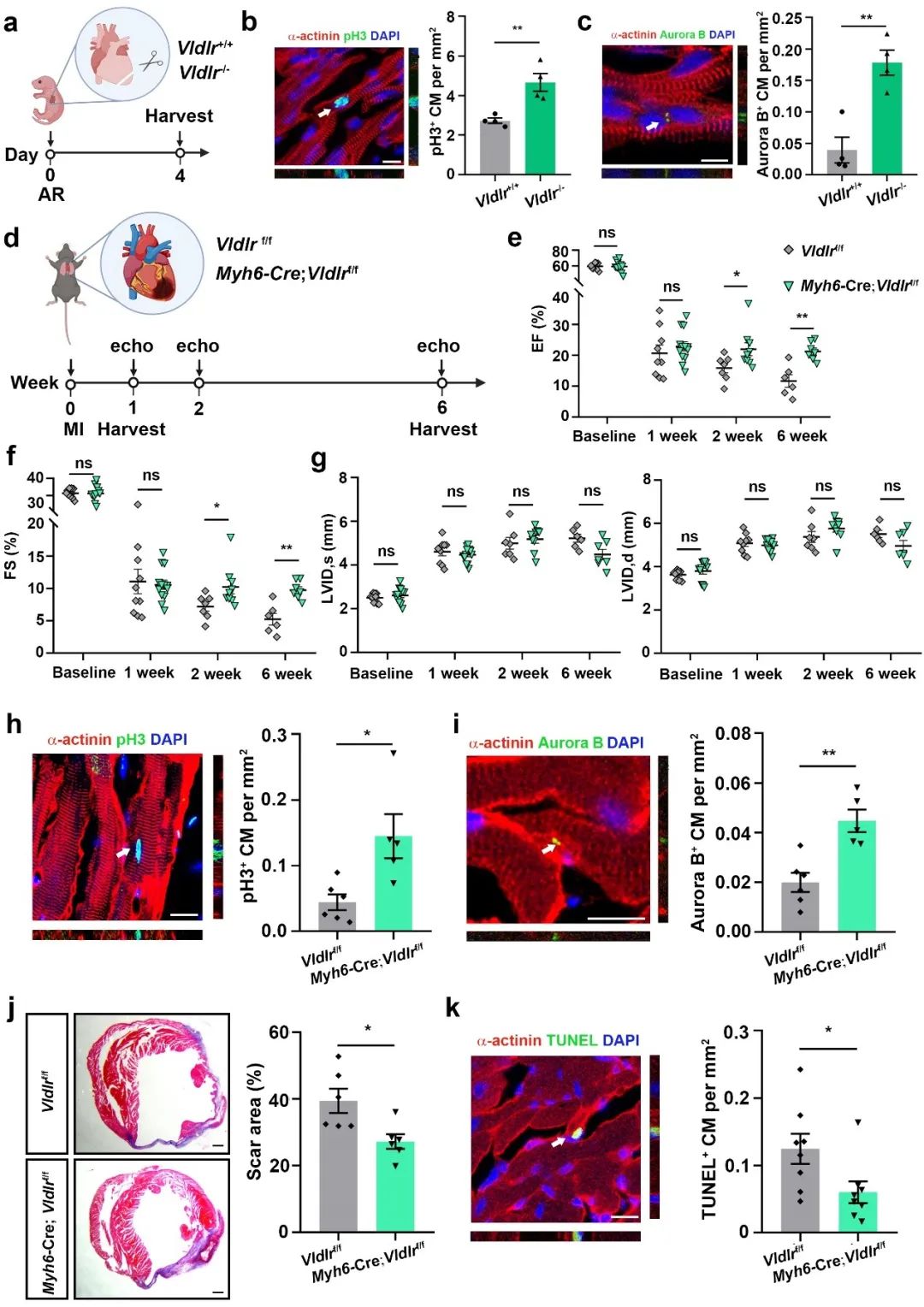
图3. 心肌细胞中特异性敲除Vldlr可以促进心脏损伤后小鼠心肌细胞增殖与心脏保护
综上所述,该研究发现心肌细胞上的受体Vldlr可同时介导抑制心肌细胞增殖的TSP-1的信号以及促进心肌细胞增殖的Reelin信号,并且在出生后的小鼠心肌细胞中,TSP-1-Vldlr信号始终起主导作用从而抑制心肌细胞增殖。同时,Rac1和Yap作为TSP-1/Reelin-Vldlr信号的下游分子介导其对心肌细胞增殖的调控作用(图4)。因此,该研究为哺乳动物出生后心肌细胞再生能力的丧失提供了合理的解释。同时,TSP-1-Vldlr信号也为寻找潜在的心脏再生的治疗靶点提供一个新的思路。
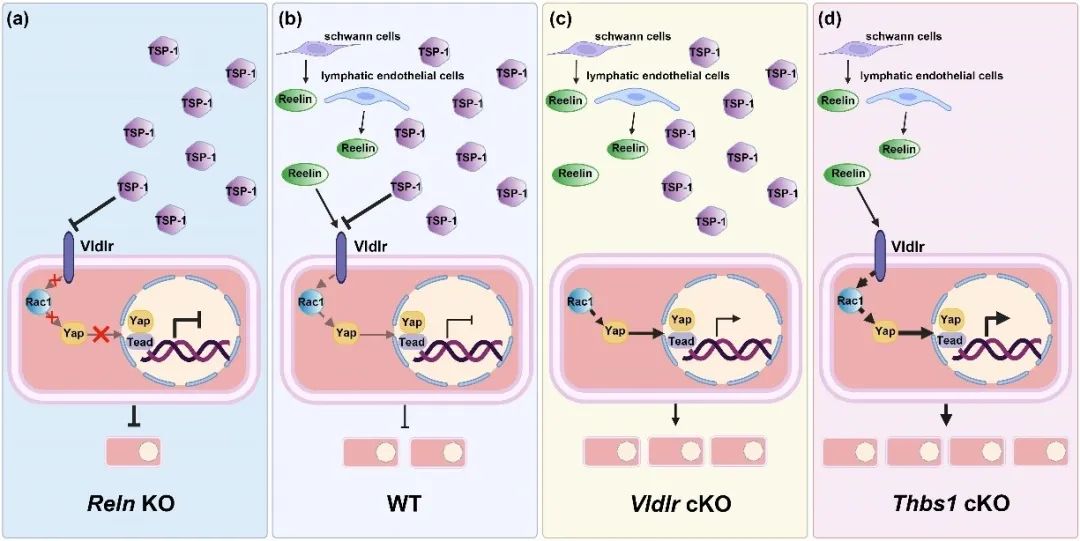
图4. TSP-1/Reelin-Vldlr调控心肌细胞增殖的模式图
同济大学生命科学与技术学院/附属东方医院魏珂教授为该论文的通讯作者。同济大学生命科学与技术学院裴丽娟博士及博士研究生欧阳兆惠为该论文的共同第一作者。参与此项研究工作的还有博士张红杰、唐岩松、冯梦颖,博士研究生黄诗琪、姜睿、刘碧林、袁旻、王皓存、姚素,硕士研究生师书玥、余朝。本工作还得到了同济大学附属第十人民医院徐大春教授和生命科学与技术学院龚国华教授的大力支持。该项工作得到了科技部重点研发计划、国家自然科学基金和中央高校基本科研业务费的资助。
参考文献:
1. Bassat,E., et al., The extracellular matrix protein agrin promotes heart regeneration in mice. Nature, 2017. 547(7662): p. 179-184.
2. Wei, K., et al., Epicardial FSTL1 reconstitution regenerates the adult mammalian heart. Nature, 2015. 525(7570): p. 479-85.
3. Li, Y., et al., gp130 Controls Cardiomyocyte Proliferation and Heart Regeneration. Circulation, 2020. 142(10): p. 967-982.
4. Pei, L., et al., Thrombospondin 1 and Reelin act through Vldlr to regulate cardiac growth and repair. Basic Res Cardiol, 2023.
5. Dlugosz, P. and J. Nimpf, The Reelin Receptors Apolipoprotein E receptor 2 (ApoER2) and VLDL Receptor. Int J Mol Sci, 2018. 19(10).
6. Liu, X., et al., Lymphoangiocrine signals promote cardiac growth and repair. Nature, 2020. 588(7839): p. 705-711.
原文链接:
https://link.springer.com/article/10.1007/s00395-023-01021-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
.jpg)












#心肌梗死# #心肌细胞# #VLDLR# #TSP-1# #Reelin#
28
不错,学习了。
21