JTO权威综述:可切除非小细胞肺癌新辅助靶向治疗的有效性及安全性
2023-11-18 苏州绘真医学 苏州绘真医学 发表于上海
本综述的目的是对现有文献和正在进行的临床试验进行全面总结,评估新辅助TT用于eNSCLC患者的可行性、有效性和安全性。
可手术早期(I-IIIB 期)NSCLC 患者的标准治疗(SoC)是手术联合(新)辅助全身治疗用于 II 至 IIIB 期患者和某些 IB 期患者,少数情况下采用放化疗(III 期疾病伴纵隔淋巴结转移)。尽管进行了这些治疗,但转移性复发很常见,与生存状况较差有关,凸显了需要比当前 SoC 更有效的全身疗法。在靶向疗法(TT)成功治疗携带致癌驱动基因突变的晚期 NSCLC 患者后,正在探索这些药物用于早期 NSCLC 患者的围手术期(新辅助和辅助)治疗。奥希替尼辅助治疗是获批用于早期患者的TT,目前尚无获批的新辅助TT。本文讨论了诊断时进行全面生物标志物检测来识别可能获益于新辅助靶向治疗的患者的重要性,并总结了新辅助TT试验的新数据。此外,讨论了在早期患者中将新辅助 TT 确立为 SoC 的潜在挑战,包括识别和验证早期反应标志物以指导治疗和加速药物开发,以及围手术期治疗的安全性考虑。初步数据表明,在 EGFR 或 ALK 阳性早期 NSCLC 患者中,新辅助 TT 有效且耐受性良好。正在进行的试验的数据将确定新辅助靶向疗法能否成为癌基因成瘾的可切除 NSCLC 患者的新 SoC。
研究背景
大约一半的NSCLC患者诊断时处于早期,随着高危人群筛查项目的扩大,这一数字将会增加。手术是可切除 NSCLC(I-IIIB 期)患者的主要治愈性治疗选择,推荐对 II 至 IIIB 期患者和选定的 IB 期患者进行新辅助或辅助全身治疗,或者在极少数情况下,对伴有纵隔淋巴结转移的 III 期患者进行放化疗。尽管有可及的治疗,但疾病复发在接受切除术的患者中很常见,与生存状况较差和社会经济负担有关。对5 项切除的 NSCLC 患者辅助化疗试验的汇总分析表明,与单独手术相比,5 年总生存率(OS)提高了5.4%。同样,在一项针对可切除 NSCLC 患者的荟萃分析中,与单独手术相比,新辅助化疗将 5 年 OS 提高了 5%。因此,需要额外的治疗来减少疾病复发, 延长早期NSCLC(eNSCLC)患者的生存期,提高治愈率。eNSCLC治疗的最新进展包括批准了多种辅助治疗方案,包括:奥希替尼用于肿瘤携带经典EGFR突变的手术切除的NSCLC(IB-III期)患者;阿替利珠单抗用于手术切除和铂类化疗后的 NSCLC(II-III 期)患者,其肿瘤程序性死亡配体-1(PD-L1)表达(根据国家特定阈值);以及帕博利珠单抗用于手术切除±铂类化疗后的 NSCLC 患者(IB 期 [T2a ≥ 4 cm]、II 期或 IIIA 期;TNM 癌症分期系统第七版)。正在进行的研究可能导致其他辅助靶向疗法(TT)获批,包括探索阿来替尼辅助治疗用于 ALK 阳性手术切除的 NSCLC 患者的 ALINA 试验。随着最近批准新辅助纳武利尤单抗联合含铂双药化疗用于可切除的NSCLC患者,新辅助治疗领域快速发展。目前,尚无新辅助TT获批用于可切除NSCLC。
对于晚期 NSCLC(aNSCLC)患者,标准治疗(SoC)包括进行全面的生物标志物检测,评估 PD-L1 状态以及是否存在致癌驱动突变(包括各种 EGFR 突变、ALK、RET、NTRK、ROS1、KRAS G12C、BRAF V600E、METex14 跳跃、ERBB2)。癌基因成瘾aNSCLC的推荐一线治疗是TT,除了 KRAS G12C 突变、ERBB2 突变或 EGFR 外显子 20 插入突变的患者,推荐将 TT 作为二线治疗。临床证据表明,EGFR 突变或 ALK 阳性晚期 NSCLC 患者从癌症免疫疗法(CIT)中获益甚少或没有获益,并且将 CIT 与 TT 联合使用没有额外的益处。重要的是,在晚期疾病患者中,TT联合CIT,以及序贯疗法与毒性增加有关。在早期患者中,尚不清楚CIT在EGFR或ALK改变患者中的疗效是否也较低;各项正在进行的围手术期试验对是否允许已知 EGFR 或 ALK 改变的患者入组以及是否需要在入组前进行基因检测有不同的标准。辅助 CIT 试验的初步亚组分析表明对一小部分 EGFR 激活突变的患者有效;然而,应谨慎解释这些结果,结合奥希替尼辅助治疗的显著OS获益进行考虑。
出于这些疗效和安全性考虑,以及最近获批用于早期患者的疗法排除EGFR和ALK突变肿瘤,对患者进行致癌驱动基因突变检测,指导围手术期治疗决策非常重要。本文讨论了生物标志物检测对于识别可能从新辅助靶向治疗中获益的患者的重要性,以及将围手术期 TT 确立为标准治疗的潜在挑战。本综述的目的是对现有文献和正在进行的临床试验进行全面总结,评估新辅助TT用于eNSCLC患者的可行性、有效性和安全性。
材料与方法
表1是根据已发表结果的已知新辅助治疗临床试验编制的。鉴于已发表结果的新辅助靶向治疗试验数量有限,系统检索是不合适的。为了识别所有正在进行的eNSCLC患者新辅助TT临床试验,我们使用检索词“新辅助”和“肺癌”对 clinicaltrials.gov 进行了系统检索。排除了处于终止和已完成状态的试验。然后按治疗对研究进行分类,排除探索仅CIT和仅化疗或放疗或其他治疗的临床试验。由此产生的试验进一步按单药治疗(表2)和TT加化疗(表3)进行分类。对研究进行最终筛选,排除被认为不合适的研究。系统检索和排除研究的完整细节见图1。系统检索于2022年6月14日首次完成。于2022年10月19日进行了额外的检索,识别自第一次检索以来已注册的任何其他研究。
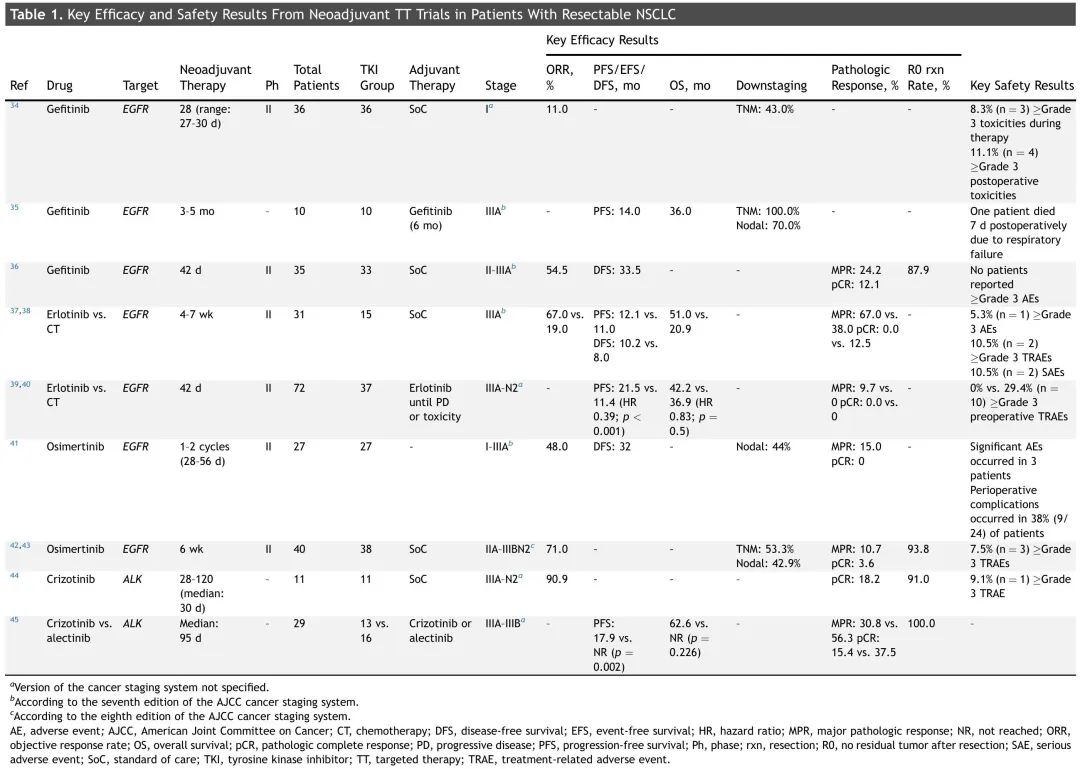
表1. 可切除NSCLC患者新辅助TT试验的关键疗效和安全性结果
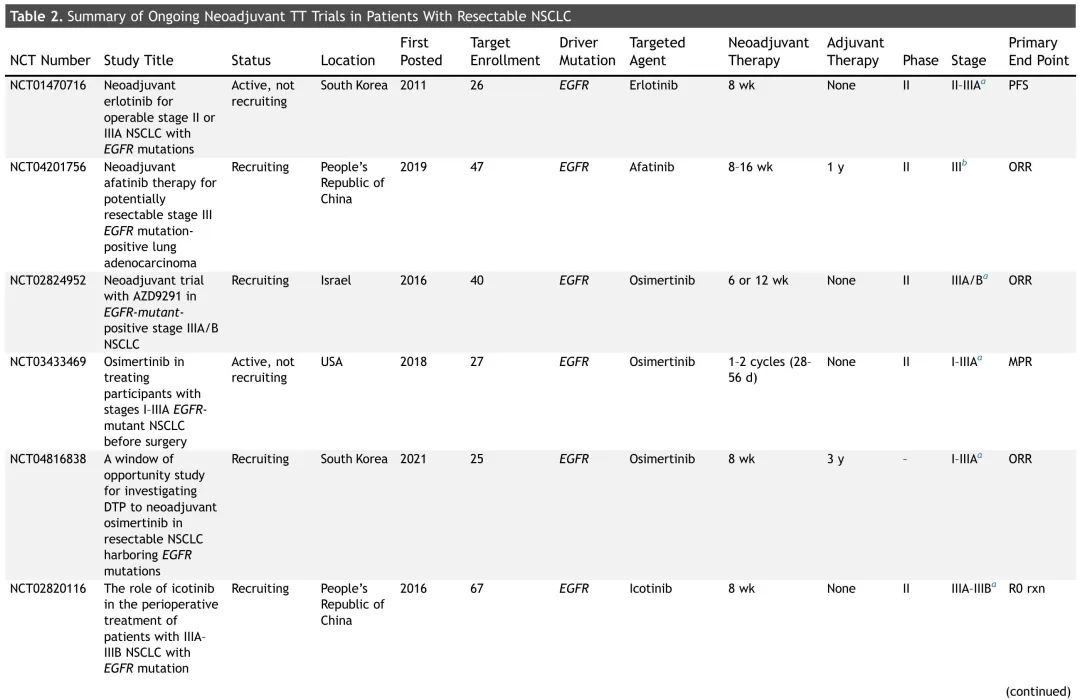
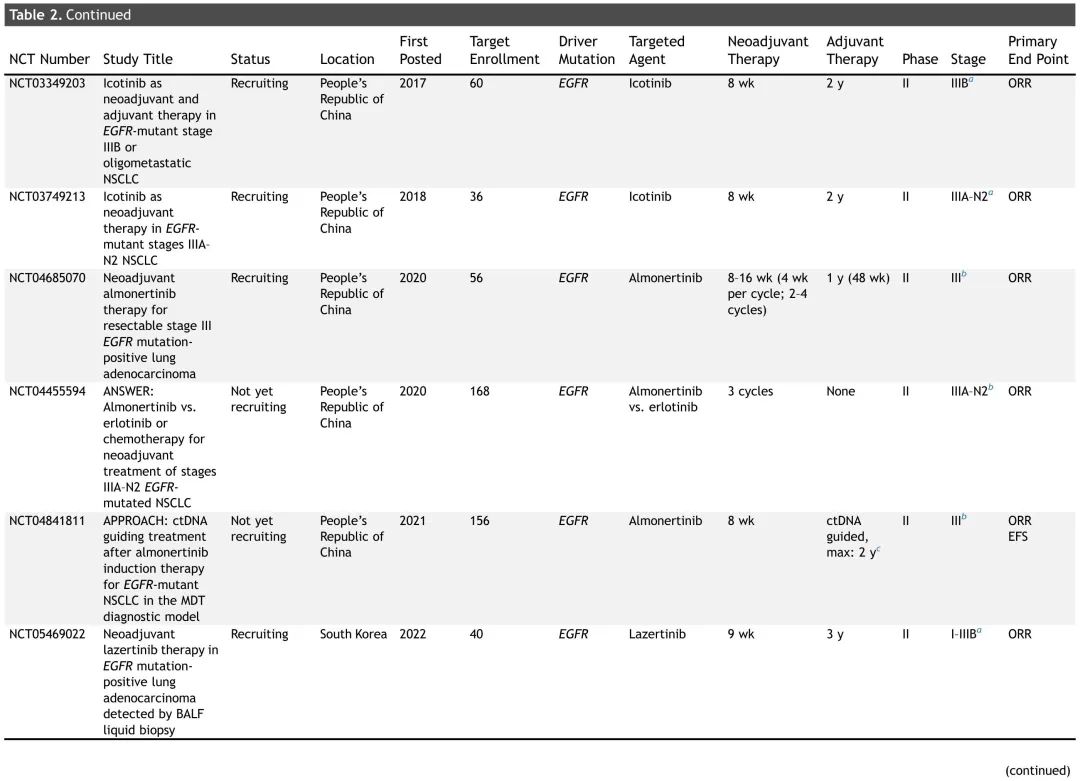
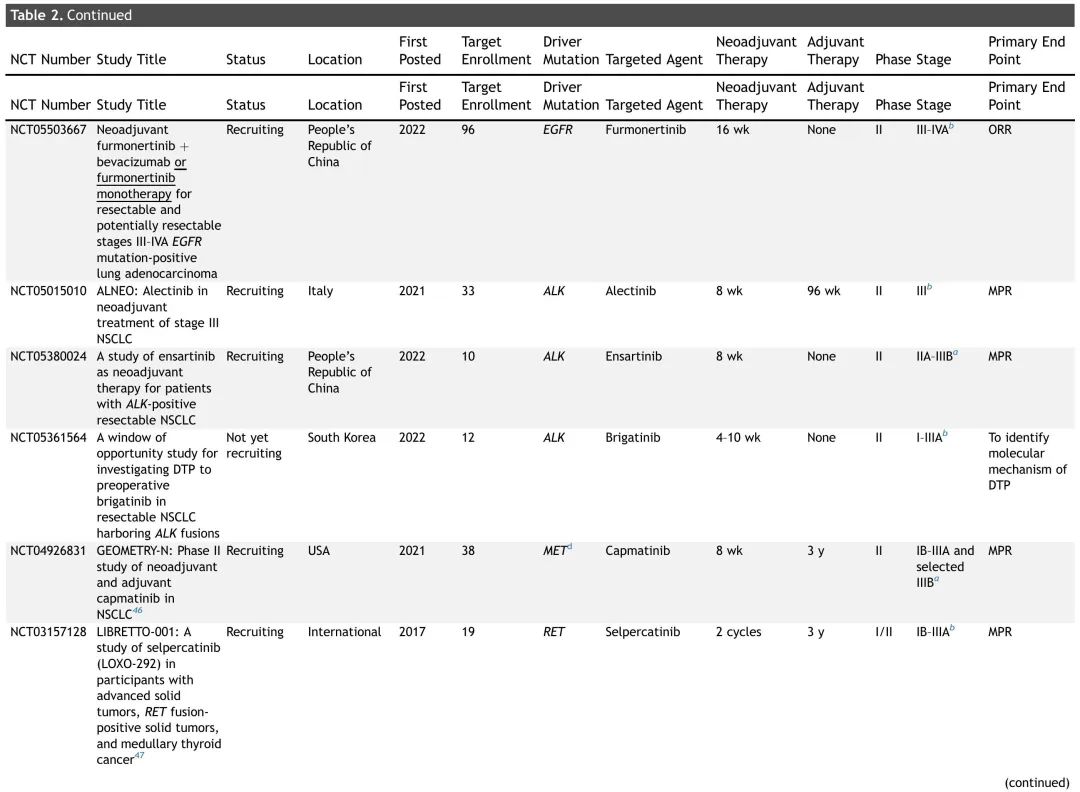
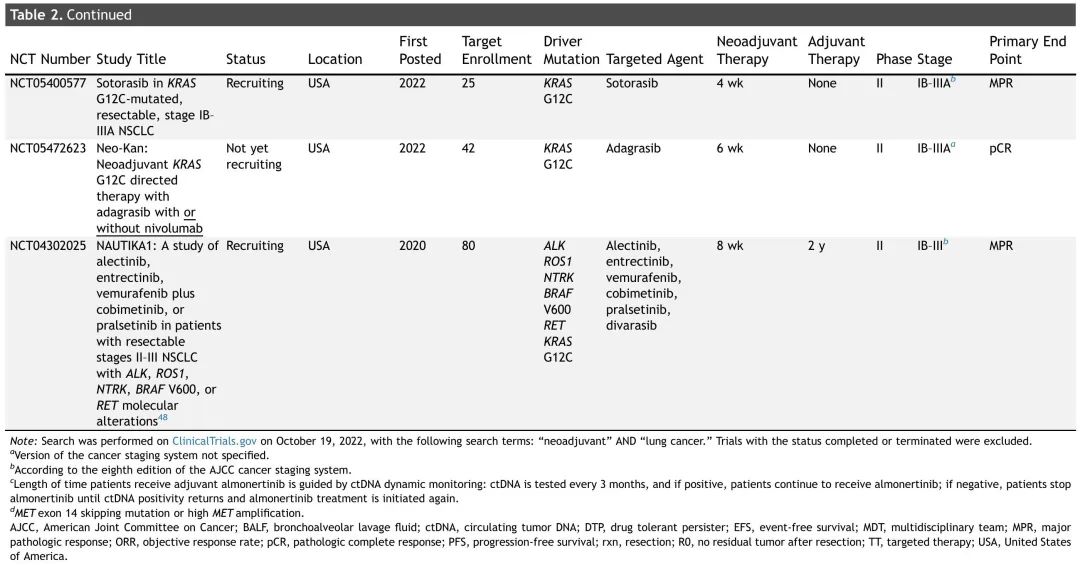
表2. 正在进行的可切除NSCLC患者新辅助TT试验总结
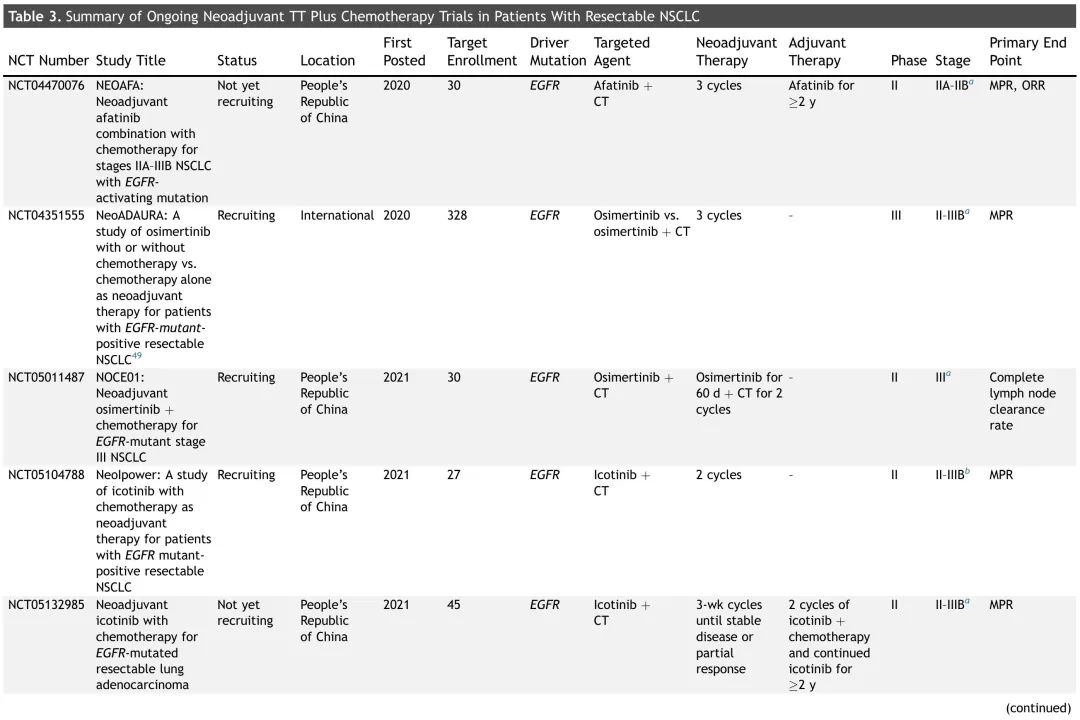
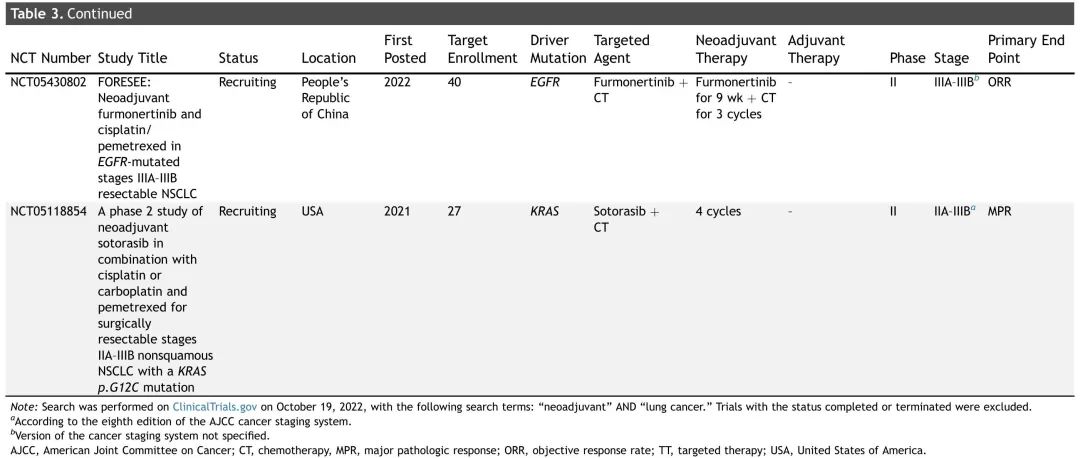
表3. 正在进行的可切除NSCLC患者新辅助TT加化疗试验总结
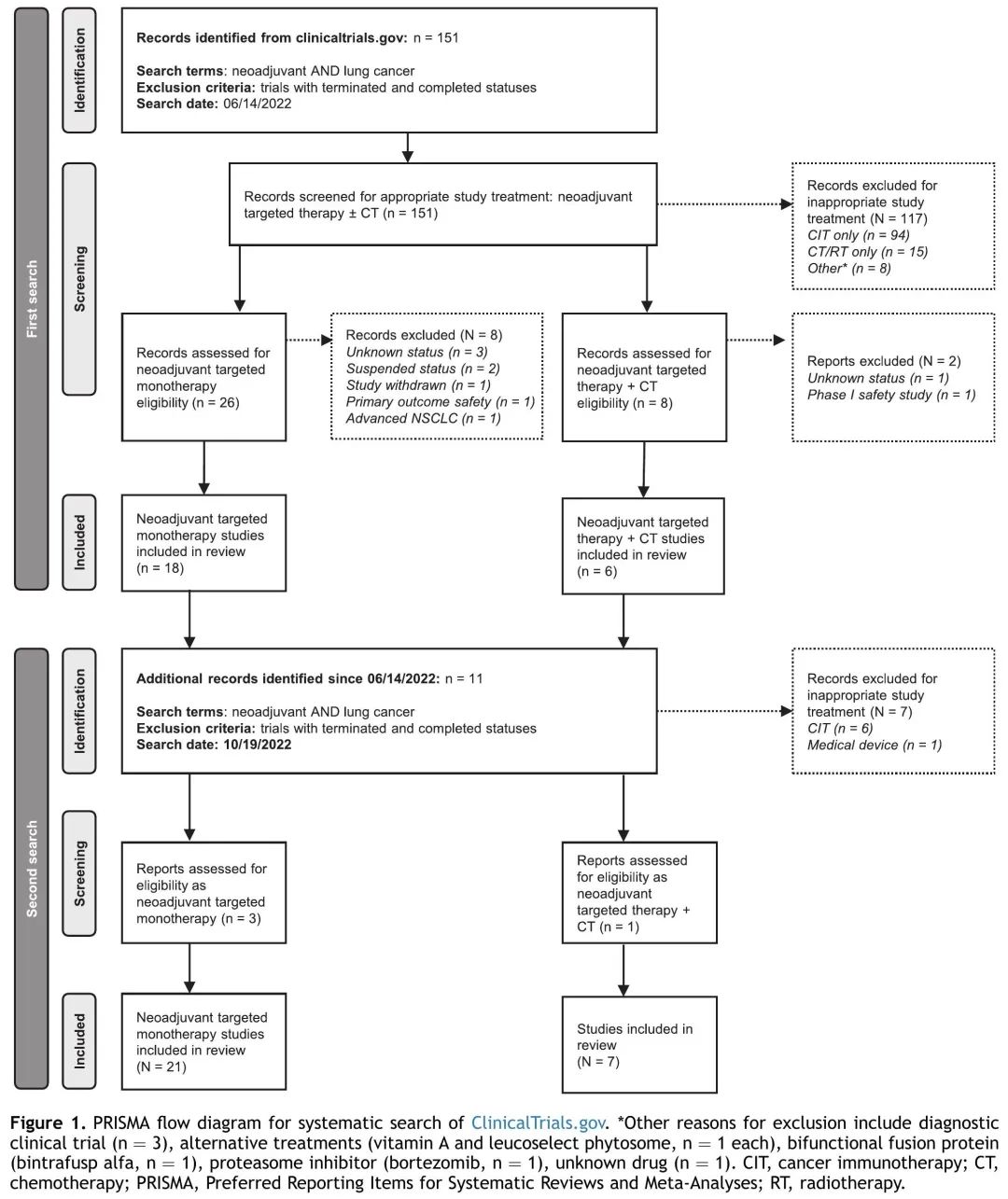
图1. 研究筛选流程
eNSCLC新辅助治疗的依据
可切除 NSCLC 进行新辅助治疗具有多种潜在益处,包括:新辅助治疗比辅助治疗耐受性更好;早期全身治疗可控制微转移性疾病;患者需要的手术切除范围可能较小(保肺手术),完全切除(R0)率较高。新辅助治疗允许对生存估计(OS、无病生存期 [DFS])进行替代终点评估,如治疗反应的临床、病理或相关生物标志物评估。术前疗法也有助于评估体内治疗效果,并可能指导辅助治疗。另一个预计的优势是新辅助治疗的依从性高于辅助治疗。反对新辅助治疗的一个常见观点是,尽管治疗持续时间较短(三到四个周期),但可能会延长从诊断到治愈性手术的时间,在此期间患者可能出现疾病进展。然而,来自新辅助 CIT 试验的证据提供了信心,不会影响患者的预后。
诊断时进行生物标志物检测的依据以及诊断时收集足够活检样本的必要性
随着研究探索 TT 在 eNSCLC 中的作用,生物标志物检测对于指导治疗选择和优化临床结果至关重要。在最近批准围手术期全身治疗用于 eNSCLC 患者后,NCCN 肿瘤学临床实践指南(NCCN 指南)推荐使用FDA批准的检测,来检测 IB 至 IIIA 期和 IIIB 期(T3,N2)NSCLC 患者的 EGFR 突变、ALK 重排和 PD-L1 状态,为(新)辅助治疗决策提供信息。对于转移性NSCLC,NCCN指南建议在临床上可行时,在开始一线治疗之前进行分子检测。尽管如此,一项真实世界研究显示,只有 46% 的转移性 NSCLC 患者接受了推荐检测的五种生物标志物的评估。这突出,在晚期疾病中进行分子检测的障碍也可能限制早期疾病中的检测,预计治疗格局会发生变化,需要 EGFR 突变、ALK 重排和 PD-L1 状态之外的检测。
关于在诊断时纳入术前生物标志物检测作为常规临床实践的一部分,用于指导新辅助治疗决策,存在一些考虑因素。最大限度地减少获得检测结果的周转时间对于确保尽快开始正确的全身治疗非常重要。收集足够的活检样本对于生物标志物检测(PD-L1 表达和致癌驱动突变)是必不可少的,低产量可能使检测不可行。在新辅助治疗中,治疗可能导致病理完全缓解(pCR),使用切除的组织标本进行生物标志物检测也许不可行,强调了在诊断时收集足够活检组织的重要性。
使用下一代测序(NGS)进行全面基因组分析的可及性越来越高,并广泛用于组织和血浆样本,为NSCLC的治疗决策提供信息。然而,NGS在eNSCLC中的常规应用将取决于获批TT的可及性,在CIT治疗前排除致癌驱动突变患者的需要,以及探索TT用于早期疾病的临床研究的可及性。在术前治疗中,对致癌驱动因素进行基于血液的生物标志物检测或能克服组织取样的固有局限性:方便且微创,周转时间更短。BFAST 研究(NCT03178552)报告了仅根据血液 NGS 结果接受 TT 的 aNSCLC 患者的临床获益。然而,由于 eNSCLC 的疾病负荷低于 aNSCLC,血浆样本可能没有足够的循环肿瘤 DNA(ctDNA)进行分析。eNSCLC患者血液样本基因检测高度依赖于所使用的检测方法,需要灵敏度更高的技术来避免假阴性结果。此外,在专业癌症中心的临床试验之外,基于血液的 NGS 并不常规进行。最后,仅使用液体活检而不进行组织分析的方法无法评估 PD-L1 表达。
LEADER试验(NCT04712877)是一项诊断性研究,其主要目的是确定肿瘤携带致癌驱动突变的早期(IA2-III)NSCLC患者的比例(图2)。如果在超过35%的入组患者中发现致癌驱动突变,则该试验中采取的筛查方法被认为是可行的。肿瘤突变负荷的评估是次要终点。将招募大约 1000 名患者使用组织和血浆样本进行 NGS(FoundationOne)。结果将与主治医师共享,来指导治疗或允许转诊到新辅助临床试验,并可能成为评估新辅助治疗中可操作生物标志物的理想框架。将在新辅助治疗前后和手术后收集血浆样本,以进行相关研究。来自 CIT 试验 CheckMate 816 和 IMpower010 的证据表明,并非所有患者都对新辅助或辅助 CIT 有反应,需要检测患者的 PD-L1 表达和致癌驱动突变,以及其他预后因素,如共突变,以识别最有可能从 CIT 或 TT 中获益的患者。这强调了使用 NGS 进行全面分子检测的必要性,能够指导可切除 NSCLC 的治疗选择。
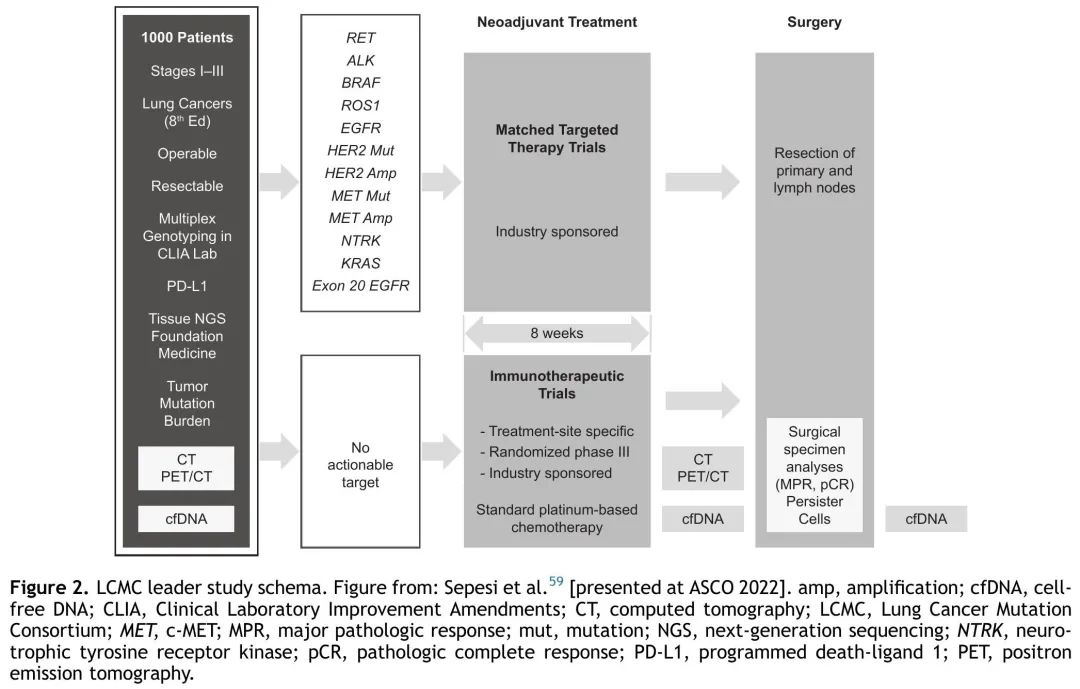
图2. LEADER试验
新辅助TT临床试验数据
鉴于 TT 在晚期疾病中的成功,以及奥希替尼辅助治疗令人印象深刻的生存获益,新辅助 TT 越来越多地被探索用于癌基因成瘾的可切除肺癌。大多数新辅助TT试验使用EGFR和ALK酪氨酸激酶抑制剂(TKI),这些是该领域最成熟的TT(表1)。需要注意的是,EGFR突变和ALK重排NSCLC患者在肿瘤生物学方面具有固有的差异,并且不同的TKIs(其中有多代)与不同的耐药机制有关。因此,EGFR和ALK TKIs及其相关靶点具有独特的区别。
目前,已探索了EGFR TKI吉非替尼、厄洛替尼和奥希替尼用于新辅助治疗(表 1)。一项开放标签、单臂 2 期研究(NCT00188617)报告,吉非替尼在未经选择的 I 期 NSCLC 患者中通常是一种安全可行的方案,客观缓解率(ORR)为 11%,治疗反应的最强预测因子是EGFR突变的存在。另一项单臂 2 期研究(NCT01833572)表明,吉非替尼新辅助治疗是 EGFR 突变 II 至 IIIA 期 NSCLC 患者的可行治疗选择,ORR 为 54.5%,主要病理缓解(MPR)为 24.2%,中位 DFS 为 33.5 个月。在一项回顾性研究中,10 例临界可切除 NSCLC 在吉非替尼新辅助治疗后进行了挽救性手术,中位无进展生存期(PFS)为 14 个月,OS ≥ 36 个月。厄洛替尼在一项中国 IIIA 期 NSCLC 患者的研究中也被报道为一种有效的新辅助治疗(NCT01217619):厄洛替尼的ORR(67% vs 19%)、病理缓解率(67% vs 38%)和OS(51.0 vs 20.9 mo)高于含顺铂的双药化疗。EMERGING-CTONG 1103研究是一项随机2期试验,比较了新辅助化疗与厄洛替尼在EGFR突变IIIA至N2期NSCLC患者中的疗效。主要终点ORR未达到(厄洛替尼54.1%,化疗34.3%),但中位PFS有所改善(分别为21.5个月和11.4个月),尽管并未转化为OS获益。正在进行的奥希替尼临床试验的初步结果表明,这种第三代EGFR TKI通常是安全的,可能是一种有效的新辅助治疗。在一项纳入了 27 例 EGFR 突变 I 至 IIIA 期 NSCLC 患者的小型 2 期研究中(NCT03433469),奥希替尼新辅助治疗诱导病理缓解(MPR:15%)和术前疾病降期;然而,该研究未达到其主要终点。NEOS 研究纳入了 38 名 EGFR 突变可切除 II 至 IIIB 期NSCLC 患者,最终结果显示,ORR 为 71.1%,R0 切除率为 93.8%,MPR 为 10.7%。
在ALK阳性可切除局部晚期NSCLC患者中,Zhang等人报道,克唑替尼新辅助治疗是可行的,耐受性良好(表1)。总体而言,11 例患者中,10 例部分缓解,1 例疾病稳定。其中 10 例患者接受了 R0 切除术,2 例获得 pCR。一项回顾性研究纳入了阿来替尼(n=16)或克唑替尼(n=13)诱导治疗后接受手术的ALK阳性III期NSCLC患者,发现阿来替尼的疗效优于克唑替尼(pCR:37.5% vs 15.4%)。多项临床试验正在探索新一代ALK抑制剂作为新辅助治疗的疗效和安全性(表2)。
新辅助TT的探索仍处于早期阶段,最佳治疗持续时间尚不清楚。在ADAURA研究中,在奥希替尼辅助治疗至少3年后复发时,41%的患者接受了奥希替尼治疗,提示一些患者可能需要3年以上的奥替尼辅助治疗。新辅助治疗的持续时间受到接受切除术的需要(限制 TT 周期数)和疗效评估相关挑战的限制。来自正在进行的临床试验的额外数据对于确定新辅助 TT 的最佳持续时间很重要。
与新辅助CIT试验相比,初步数据表明,新辅助TT试验的MPR或pCR率可能较低,而其他疗效终点(R0切除率、降期、无事件生存期[EFS]、DFS、PFS)相似(表1)。这可能是由于作用机制的固有差异。化疗的抗肿瘤作用由细胞毒性作用驱动,CIT 由增强免疫监视驱动,而 TT 是细胞抑制性的,这可能会影响围手术期 TT 的必要持续时间。在更好地了解新辅助 TT 后的病理缓解之前,早期患者仍应进行手术切除,生存评估仍是必不可少的终点。
正在进行的新辅助TT试验
大多数正在进行的新辅助(或围手术期)试验正在研究 TT 用于 EGFR 突变 NSCLC,尽管也有探索靶向药物用于其他致癌驱动突变的试验正在招募患者(表 2)。非EGFR试验的临床试验设计相似,新辅助治疗时间为两个周期(6-8周),大多数试验还包括辅助治疗(1-3 年)。这些试验的主要终点多样,包括病理缓解(MPR、完全缓解)、ORR、DFS、EFS 和 PFS。NAUTIKA1是一项正在进行的 2 期伞式试验,评估多种疗法作为(新)辅助治疗在具有特定生物标志物的可切除 NSCLC 患者中的疗效和安全性(图 3)。该临床试验描述了一种潜在的未来管理范式,携带致癌驱动突变的肿瘤患者接受围手术期 TT,非携带者接受 CIT。
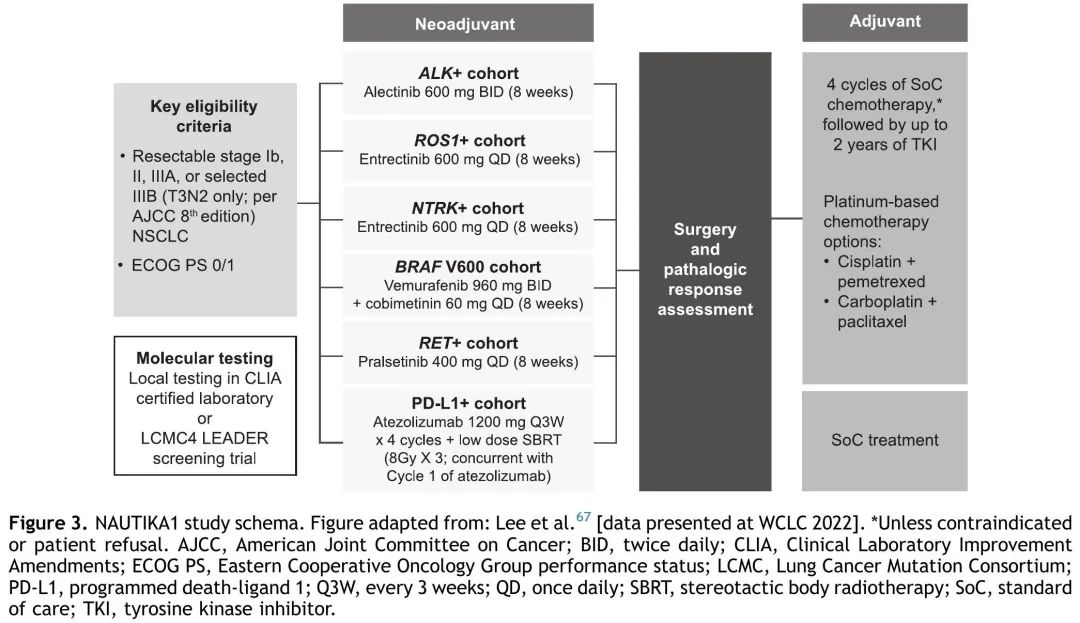
图3. NAUTIKA1研究
鉴于TT通常耐受性良好,多项正在进行的新辅助试验正在评估TT联合化疗(表3)。大多数正在评估EGFR抑制剂,一项2期研究(NCT05118854)正在探索新辅助KRAS G12C抑制剂索托雷塞联合化疗在KRAS G12C突变可切除(IIA-IIIB期)NSCLC患者中的疗效。这些试验的结果备受期待,将进一步说明新辅助TTs(单独或联合化疗)是否是NSCLC患者可行和有效的治疗策略。在未来的围手术期 TT 试验中,探索 KRAS G12C 与共突变的相互作用以及 TT 组合的有效性和安全性将很有趣。
新辅助TT试验的终点
一系列临床终点可用于评估新辅助治疗对 eNSCLC 患者的疗效。OS是肿瘤学临床试验的主要终点,但新辅助试验从入组到OS数据发表需要10到13年的时间,提示在早期疾病中需要强劲的替代标志物来加速新疗法的开发和批准。药物反应的替代标志物通常用于肿瘤学的其他领域,并已被证明与OS相关。一项关于早期乳腺癌新辅助治疗的荟萃分析显示,pCR 与长期生存(EFS 和 OS)密切相关。同样,在标志性可切除肺癌新辅助化疗试验中,报告了 DFS 和 OS 的强相关性。CheckMate 816 试验纳入了可切除 NSCLC 患者接受新辅助纳武利尤单抗联合化疗, 达到 pCR 的患者的 EFS 似乎长于未达到的患者(中位 EFS:未达到 vs 26.6 个月)。此外,最近一项研究探索了新辅助 NSCLC 试验的反应评估,发现与 ORR 相比,MPR 是长期 OS 的更好预测指标。有趣的是,数字病理缓解评估已在正在进行的新辅助 CIT 试验中显示出效用,也可能对评估 TT 试验类似终点有用。
辅助 TT 用于可切除 NSCLC 的试验结果表明,替代标志物(pCR、MPR、EFS 和 DFS)可能与生存相关;然而,这些研究并非旨在评估OS,需要更多的数据来确定明确的相关性。研究厄洛替尼辅助治疗用于EGFR突变eNSCLC患者的单臂2期SELECT试验显示出较高的DFS和OS率:2年和5年DFS分别为88%和56%,5 年OS为86%。2 期 EVAN 试验评估了辅助厄洛替尼vs化疗在 EGFR 突变 III 期 NSCLC 患者中的疗效,发现厄洛替尼相比化疗改善了生存结局,并且 DFS 与 OS 相关:厄洛替尼组的 5 年 DFS 率和 OS 率分别为 48.2% 和 84.8%。随机 3 期 IMPACT 研究结果显示,与化疗相比,吉非替尼辅助治疗的 2 年 DFS 率较高,但这种优势在 5 年时丧失,且没有转化为 OS 获益。同样,在吉非替尼vs化疗用于EGFR 突变手术切除的 I 至 IIIA 期 NSCLC 患者的 3 期ADJUVANT-CTONG1104试验的最终分析中,DFS 的显著改善并未转化为 OS 获益。3 期 ADAURA 研究表明,在 II 至 IIIA 期 NSCLC 患者中,奥希替尼辅助治疗的 DFS 显著优于安慰剂:3 年 DFS 率分别为 84% 和 34%。奥希替尼还导致总体人群(IB-IIIA 期)的 DFS 改善,以及局部区域复发、远处复发和中枢神经系统(CNS)复发减少。FDA基于该研究的 DFS 数据批准奥希替尼辅助治疗用于手术切除的 NSCLC 患者,尽管在批准时 OS 不成熟。该试验的最新数据显示,奥希替尼带来了显著、具有临床意义的OS改善。这是首个在这种情况下,DFS 获益转化为 OS 改善的 TT,验证了 DFS 作为 OS 的替代标志物。
在新辅助治疗中,尚不清楚在可切除 NSCLC TT 试验中,替代标志物是否与生存相关。一项吉非替尼2期研究表明,MPR与DFS相关,与OS无关。一项比较厄洛替尼与化疗的小型研究显示厄洛替尼的 ORR 和 MPR 略微较优,这些与DFS或PFS改善无关,但OS有改善的趋势。比较厄洛替尼与化疗的EMERGING-CTONG 1103研究结果表明,ORR与PFS相关,但病理缓解与PFS无关,PFS优势未转化为OS获益。然而,需要注意的是,这些研究的OS分析没有功效。
新辅助 CIT 试验的初步结果表明,ctDNA 评估作为反应和生存的早期替代标志物具有价值,但还需要更多的数据。LCMC3 研究表明,阿替利珠单抗新辅助治疗后 ctDNA 减少与病理缓解和影像学肿瘤缩小相关。对 2 期 NADIM 研究的探索性分析显示,在接受新辅助纳武利尤单抗和化疗的可切除 IIIA 期 NSCLC 患者中,治疗前 ctDNA 水平与长期生存的相关性相比影响学评估更准确。在 CheckMate 816 研究中,ctDNA清除患者的EFS长于未清除患者,在纳武利尤单抗联合化疗组和单独化疗组均是如此。然而,目前没有数据证明在新辅助TT中,ctDNA作为反应或生存的替代标志物的效用。ctDNA也可作为指导(新)辅助治疗持续时间和降级的有用工具。支持这种方法可行性的证据有限,并且取决于检测灵敏度,而技术正在迅速发展。一项正在进行的相关研究是APPROACH研究(NCT04841811),将评估使用ctDNA指导不可切除的III期NSCLC患者EGFR TKI阿美替尼(新)辅助治疗持续时间的有效性和安全性(表2)。
新辅助TT的安全性考虑
TT 具有独特的安全性,考虑在新辅助治疗期间是否可能发生毒性很重要,这可能延迟或阻止治愈性手术。例如,RET抑制剂普拉替尼和塞普替尼与伤口愈合受损有关,这可能会影响手术恢复。有少数关于一些ALK,EGFR和MET抑制剂的严重呼吸系统不良事件(AEs)(包括肺炎和间质性肺病)的报道,可能会限制这些疗法在手术切除前的使用。其他可能影响手术的罕见毒性包括:心脏毒性(奥希替尼)、心动过缓(阿来替尼和克唑替尼)、血小板减少症(奥希替尼)、发热(达拉非尼加曲美替尼)、肝毒性(索托雷塞)和中枢神经系统毒性(洛拉替尼)。NAUTIKA1研究中 ALK 阳性队列的初步结果表明,阿来替尼新辅助治疗在可切除 NSCLC 患者中耐受性良好,目前,所有患者都接受了手术,没有延迟或严重并发症。除手术外,还需要考虑TT与放疗相关的安全性。BRIGHTSTAR研究表明,在ALK重排的aNSCLC患者中,布格替尼治疗后进行局部巩固治疗(手术或放疗或两者联合)是可行且安全的;但是,在早期患者中需要额外的数据。
在选择治愈性治疗时,考虑治疗的顺序很重要,在晚期疾病中,先 CIT 后 TT 与毒性增加有关。在先接受 CIT(帕博利珠单抗,纳武利尤单抗或阿替利珠单抗) 后接受克唑替尼治疗的患者中,肝毒性风险增加。CIT(纳武利尤单抗,帕博利珠单抗或伊匹木单抗 + 纳武利尤单抗)后奥希替尼也与严重的免疫相关 AEs 有关。在帕博利珠单抗随后奥希替尼的 2 期临床试验中,发生了一起治疗相关死亡,归因于肺炎。这些数据揭示了eNSCLC检测致癌驱动突变的重要性,确保患者接受适当的一线新辅助治疗,避免后续治疗的毒性。
总体而言,预计新辅助靶向治疗耐受性良好,与根治性手术相容。奥希替尼的安全性和耐受性在晚期和早期患者(辅助治疗)中是一致的,这为不会出现与奥希替尼新辅助治疗相关的新安全性问题提供了信心。此外,NAUTIKA1研究的初步数据表明,阿来替尼新辅助治疗没有新的安全问题。正在进行的临床试验将提供更多新辅助TT用于eNSCLC的安全性和耐受性的进一步信息。
总 结
对于可切除的早期 NSCLC 患者,手术加(新)辅助化疗或少数情况下新辅助放化疗与不可接受的复发率和低生存率相关。鉴于TT用于晚期疾病的生存获益,目前正在探索这些药物用于eNSCLC患者。正在进行的临床试验的结果表明,在EGFR 和 ALK 阳性 eNSCLC 患者中,新辅助 TT 可能有效,可能改善预后。来自正在进行的试验的其他数据备受期待,将表明新辅助靶向治疗对于具有不同致癌驱动突变的 eNSCLC 患者是否可行。
随着该领域朝着 TT 用于 eNSCLC 的方向发展,诊断时将分子检测和生物标志物筛查纳入临床实践,优化治疗方案和临床结局很重要。需要统一和强劲的替代标志物来加快TT的批准,这仍然是一个挑战。基于TT在aNSCLC中的疗效数据和有希望的临床试验初步结果,新辅助TT有望改善具有致癌驱动突变的eNSCLC患者的预后,改变早期患者治疗格局。
参考文献:
Lee JM, McNamee CJ, Toloza E, Negrao MV, Lin J, Shum E, Cummings AL, Kris MG, Sepesi B, Bara I, Kurtsikidze N, Schulze K, Ngiam C, Chaft JE. Neoadjuvant Targeted Therapy in Resectable NSCLC: Current and Future Perspectives. J Thorac Oncol. 2023 Nov;18(11):1458-1477. doi: 10.1016/j.jtho.2023.07.006. Epub 2023 Jul 13. PMID: 37451404.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#非小细胞肺癌# #靶向疗法# #新辅助TT#
36