HER2低表达乳腺癌新辅助化疗效果及其预后特征:一项单中心回顾性研究
2023-08-28 中国癌症杂志 中国癌症杂志 发表于上海
本研究通过回顾性分析于复旦大学附属肿瘤医院接受乳腺癌新辅助化疗的HER2阴性患者的临床资料,探索HER2蛋白表达高低对化疗的敏感性差异及患者的预后特征。
[摘要] 背景与目的:人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是影响乳腺癌患者预后的主要标志物之一,也是乳腺癌病理学分型最主要的参考因素。本研究旨在探讨HER2低表达(HER2-low)乳腺癌患者的临床病理学特征,以及其在新辅助化疗中与疗效及预后的相关性。方法:回顾性纳入2009—2018年于复旦大学附属肿瘤医院接受新辅助化疗的HER2阴性乳腺癌患者的临床病理学相关信息,并将患者区分为HER2-low及无表达(HER2-0)组,分析其特征差异,采用单因素和多因素分析评估新辅助化疗后达病理学完全缓解(pathological complete response,pCR)的独立影响因素,采用Kaplan-Meier曲线评估不同HER2表达组的预后差异。结果:入组的772例患者中激素受体(hormonal receptor,HR)阳性患者的HER2-low比例显著高于HR阴性患者。Logistic回归模型多因素分析结果显示,肿瘤大小(P<0.001)、HR(P=0.026)及HER2表达(P=0.018)是pCR的独立预测因素。亚组分析提示,在三阴性乳腺癌(triple-negative breast cancer,TNBC)中,HER2-0与HER2-low的pCR率差异无统计学意义(P=0.598);而在Luminal型乳腺癌中,HER2-low患者pCR率为9.4%,显著低于HER2-0的19.3%(P=0.003)。在非pCR(non-pCR)患者的生存分析中,HER2-low患者的预后显著优于HER2-0患者(P<0.001),其5年生存率达72.2%,而HER2-0仅为56.0%。结论:HER2蛋白表达不同的HER2阴性患者具有不同的临床病理学特征,并与患者的化疗敏感性及预后有关。
[关键词] 人表皮生长因子受体2;乳腺癌;新辅助治疗;病理学完全缓解;预后
[Abstract] Background and purpose: Human epidermal growth factor receptor 2 (HER2) is one of the main markers affecting the prognosis of breast cancer patients and the most important reference factor for the pathological classification of breast cancer. This study aimed to investigate the clinicopathological features of breast cancer with low expression of HER2 and its correlation with therapeutic effect and prognosis in neoadjuvant chemotherapy. Methods: The patients with HER2-negative breast cancer who received neoadjuvant chemotherapy in Fudan University Shanghai Cancer Center from 2009 to 2018 were retrospectively included. Clinicopathological information was collected, and the patients were divided into groups with low expression of HER2 (HER2-low) and no expression of HER2 (HER2-0), and their characteristic differences were analyzed. The independent influencing factors of pathological complete response (pCR) after neoadjuvant chemotherapy were evaluated by univariate and multifactorial methods, and the prognostic differences among different HER2 expression groups were evaluated by Kaplan-Meier curve. Results: In the 772 patients enrolled in this study, the proportion of HER2-low was significantly higher in hormonal receptor (HR) positive patients than in HR negative patients. Multivariate analysis of logistic regression model showed that tumor size (P<0.001), HR (P=0.026) and HER2 expression (P=0.018) were independent predictors of pCR. Subgroup analysis indicated that there was no significant difference in pCR rates between HER2-0 and HER2-low triple-negative breast cancer (TNBC) (P=0.598). In Luminal breast cancer, the pCR rate of HER2-low patients was 9.4%, which was significantly lower compared with HER2-0 patients (19.3%, P=0.003). In the survival analysis of non-pCR patients, the prognosis of HER2-low patients was significantly better compared with HER2-0 patients (P<0.001), and the 5-year survival rate was 72.2%, while the 5-year survival rate of HER2-0 patients was only 56.0%. Conclusion: HER2-negative patients with different expressions of HER2 protein have different clinicopathological characteristics, which are related to the chemotherapy sensitivity and prognosis of patients.
[Key word] Human epidermal growth factor receptor 2; Breast cancer; Neoadjuvant chemotherapy; Pathological complete response; Prognosis
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是影响乳腺癌患者预后的主要标志物之一,也是乳腺癌病理学分型最主要的参考因素[1]。目前,较为公认的HER2阳性标准是指免疫组织化学检测(immunohistochemistry,IHC)结果为3+、2+且原位杂交(in situ hybridization,ISH)阳性[2]。近年来,随着靶向治疗(抗HER2治疗)研究的不断发展,HER2阳性乳腺癌的疗效已得到显著提升。
对于IHC 2+、1+且ISH阴性的患者,既往认为属于HER2阴性。这部分患者与HER2无表达(HER2-0)患者类似,均不能从抗HER2治疗中获益[3-6]。因此在乳腺癌的分型中,这部分患者主要基于激素受体(hormonal receptor,HR)[雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)]的表达被纳入Luminal型乳腺癌或三阴性乳腺癌(triple-negative breast cancer,TNBC),在治疗策略上与HER2-0的同类型乳腺癌并无不同。然而,近年来随着新型抗HER药物的出现,HER2低表达(HER2-low)概念再次受到广泛关注。这主要是基于DESTINY-Breast04研究[7]的结果,该研究是第一项评价T-DXd对比医师选择化疗方案用于HER2-low晚期乳腺癌的疗效和安全性的随机Ⅲ期临床试验。结果显示,T-DXd治疗组的无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)均获得显著改善。该研究也进一步提示以抗体药物偶联物(antibody-drug conjugate,ADC)为基础的抗HER2治疗对于HER2-low患者具有一定疗效,也从侧面印证了该部分患者并不完全等同于 HER2-0,可能具有其独特的生物学行为及治疗策略。
乳腺癌的新辅助化疗又称术前化疗,通过化疗使肿瘤降期从而为根治性手术带来更大的便利[8-9]。不同于传统先手术再化疗的模式,临床和科研工作者可以通过新辅助化疗后手术病理学检查结果的分析,获得更完善的药敏信息。新辅助化疗作为理想的临床模型,也被广泛用于肿瘤的耐药研究和分型研究。因此,为探索HER-low患者的临床病理学特征,以及其对药物治疗的敏感性差异的影响因素,本研究通过回顾性分析于复旦大学附属肿瘤医院接受乳腺癌新辅助化疗的HER2阴性患者的临床资料,探索HER2蛋白表达高低对化疗的敏感性差异及患者的预后特征。
1 资料和方法
1.1 病例收集和治疗
收集772例在复旦大学附属肿瘤医院被诊断为Ⅱ~Ⅲ期乳腺癌患者的临床资料。所有患者于2009—2018年在复旦大学附属肿瘤医院接受了新辅助化疗,并行根治性乳腺切除术及腋窝淋巴结清扫术。所有患者在新辅助化疗前均行空芯针穿刺活组织病理学检查,并在诊断时对可触及或超声检测到的淋巴结进行细针抽吸细胞学检查。本研究仅纳入了HER2阴性患者,其定义为IHC 0、1+、2+且ISH阴性。在新辅助化疗前接受过任何治疗的患者均不符合本研究的入组条件。其他排除标准包括术前转移性疾病、双侧乳腺癌、男性乳腺癌和炎性乳腺癌。
所有患者均进行了4个疗程的新辅助化疗,方案为紫杉醇联合卡铂(紫杉醇80 mg/m2,卡铂曲线下面积为2 mg·min/mL,第1、8、15天,每28 d为1个周期),此后进行根治性手术并评估疗效。对于病理学完全缓解(pathological complete response,pCR)的患者继续2个疗程紫杉醇联合卡铂方案化疗,对于非pCR(non-pCR)的患者则补充4个疗程的以蒽环类药物为主的化疗。后续的放疗和内分泌治疗基于临床指南[10-11]和治疗医师的指导进行。所有纳入本研究的患者均已签署同意使用其临床资料和生物样本的知情同意书。
1.2 疗效和生存分析
pCR的定义为乳房和腋窝淋巴结内均无浸润性癌残留。仅有原位癌残留属于pCR。无病生存期(disease-free survival,DFS)定义为从手术至各类疾病进展(包括局部复发、远处转移、新发肿瘤或因肿瘤死亡等)的时间。所有患者均进行每3个月的随访,直至死亡或失访。
1.3 IHC分析
IHC分析主要包括HER2、ER、PR的表达和Ki-67增殖指数。所有IHC分析均基于石蜡包埋组织切片,并根据规范的病理学操作流程完成。ER阳性及PR阳性的标准为≥1%的阳性染色。HR阳性指ER或PR阳性。HER2通过IHC分析被分为0、1+和2+。
1.4 统计学处理
采用SPSS 19.0软件对所有数据进行统计学分析。pCR的预测指标主要通过单因素分析(Pearson χ2检验)和多因素分析(logistic回归模型)实现。绘制Kaplan-Meier曲线,并通过log-rank检验判断生存差异。所有P值均为双侧,P <0.05为差异有统计学意义。
2 结 果
2.1 患者基本特征
本研究共入选772例患者,其中年龄<40岁的患者占18.4%,40~59岁的患者占68.9%,≥60岁的患者占12.7%。61.1%的患者为绝经前。基于化疗前肿瘤大小,T2、T3及T4期患者分别占36.5%、47.7%及15.8%。共588例(76.2%)患者在化疗前确诊有淋巴结转移。根据HR状态,患者可分为Luminal型(HR阳性)及TNBC(HR阴性)两种亚型,其中Luminal型共492例患者,占63.7%;TNBC共280例患者,占36.3%。Ki-67增殖指数高(≥20%)的患者占66.6%,Ki-67增殖指数低(<20%)的患者占33.4%。
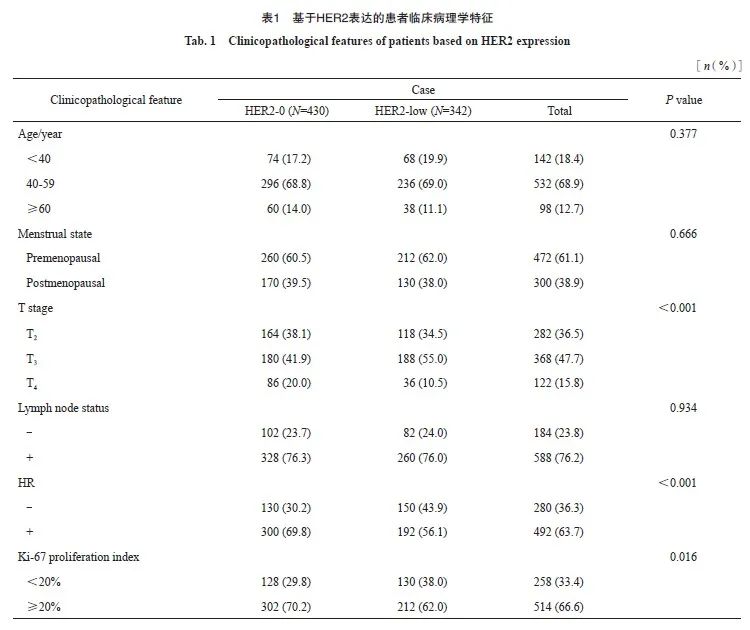
基于HER2的IHC表达(0、1+、2+),将患者分为HER2-0及HER-low亚组。通过χ2检验判断不同临床病理学特征在两亚组之间的差异。其中,相比HER2-low患者,HER2-0患者具有相对较高的T分期(P<0.001)及较高的Ki-67增殖指数(P=0.016)。HR阳性患者的HER2-low比例显著高于HR阴性患者。而不同分子分型亦在两个亚组中有不同的分布,与HER2-low相比,HER2-0中Luminal型相对更多见(69.8% vs 56.1%),而HER2-low中TNBC相对更多见(43.9% vs 30.2%),差异有统计学意义(P <0.001,表1)。
2.2 pCR的预测因素
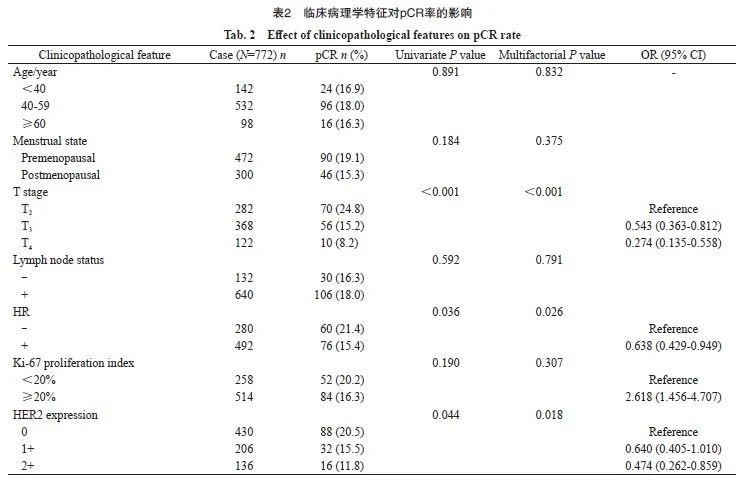
772例患者中共136例获得pCR,总pCR率为17.6%。通过单因素和多因素分析确定影响pCR率的临床病理学因素,发现肿瘤大小、HR及HER2表达是pCR的独立预测因素。其中,更高的T分级患者更不易获得pCR(T4期患者pCR率仅为8.2%),多因素分析显示,以T2期为参照,T3及T4期患者的比值比(odds ratio,OR)(95% CI)分别为0.543 (0.363~0.812)和0.274(0.135~0.558),差异有统计学意义(P <0.001)。HR(肿瘤分型)亦对pCR有显著影响,HR阴性(TNBC)患者的pCR率达21.4%,而HR阳性(Luminal型)患者仅为15.4%。多因素分析显示,以HR阴性为参照,HR阳性患者的OR(95% CI)为0.638(0.429~0.949),差异有统计学意义(P=0.026)。HER2表达同样体现了pCR的预测价值,HER2表达水平越高的患者越难获得pCR,HER2-0、1+和2+患者的pCR率分别为20.5%、15.5%和11.8%。多因素分析显示,以HER2-0为参照,HER2-1+及2+患者的OR(95% CI)分别为0.640(0.405~1.010)和0.474(0.262~0.859),差异有统计学意义(P=0.018,表2)。
此外,本研究还分析了HER2表达在不同HR亚组中的意义。在TNBC中,HER2-0、1+和2+患者的pCR率分别为23.1%、22.5%和17.1%,差异无统计学意义(P=0.598)。而在Luminal型乳腺癌中,HER2-0、1+和2+患者的pCR率分别为19.3%、11.1%和6.1%,pCR率与HER2表达存在显著相关性(P=0.008)。如将HER2-1+与HER2-2+合并为HER2-low,则pCR率为9.4%,显著低于HER2-0的19.3%(P=0.003)。
2.3 HER2表达与患者预后
本研究进一步分析了HER2表达与患者预后的相关性。772例患者的中位随访时间为66个月,随访期间共出现223个复发、转移或死亡事件。128例pCR患者中,共出现5例复发转移或死亡事件,患者的5年OS率达96.1%。基于其较好的预后,本研究重点对644例non-pCR患者进行了预后分析。
总体而言,HER2-low患者的预后显著优于HER2-0患者(P<0.001),其5年OS率达72.2%,而HER2-0患者仅为56.0%。在亚组分析中,同样在不同亚型患者中比较了HER2不同表达的预后差异。其中在TNBC患者中,HER2-low患者的预后显著优于HER2-0患者(P<0.001),其中HER-low患者的5年OS率为76.7%,而HER-0患者仅为58.3%。在Luminal型患者中,HER2-low患者表现出一定的生存优势,HER-low患者的5年OS率为70.1%,HER-0患者为59.1%,但差异无统计学意义(P=0.564,图1)。
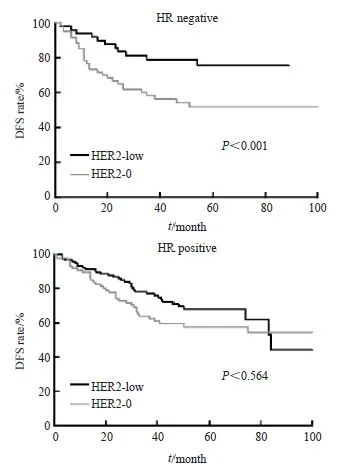
图1 不同HR表达亚组中HER2表达与预后关系
Fig. 1 HER2 expression and prognosis in different HR expression subgroups
3 讨 论
HER2在乳腺癌的分型和治疗中都具有不可替代的作用。基于既往针对HER2靶向治疗的临床研究结果,HER2-low(且ISH阴性)的患者与HER2-0患者均不能从抗HER2治疗中获益,因此很少将其作为一类单独的乳腺癌分型进行研究和讨论。随着抗HER2 ADC的研究进展,尤其是DS8201临床研究结果的发表[7,12-13],使人们重新认识到HER2-low乳腺癌亦可能在抗HER2治疗中获益,并可能具有不同于其他HER2阴性乳腺癌的临床特征。
既往研究对于HER-low的临床特征有过不同报道。目前认为,HER2-low更常见于HR阳性乳腺癌,在一项评估HER2-low乳腺癌患病率的研究[14]中(n=3 727),55.2%的HR阳性乳腺癌和28.1%的HR阴性乳腺癌中存在HER2-low。本研究亦证实在HR阳性患者中,与HR阴性患者相比,HER-low更为多见(56.1% vs 43.9%)。此外,HER2-low患者也具有相对较低的Ki-67增殖指数和较小的肿瘤直径,提示相对HER-0患者具有相对更多的Luminal型,而HER-0则具有相对更多的TNBC亚型。
本研究重点分析了HER2表达不同的患者在新辅助化疗中的疗效。基于本研究较大的样本量,根据HER2阴性患者的HER2蛋白表达量分为HER2-0、超低表达(HER2 1+)和低表达(HER2 2+)3类,总体而言,HER2蛋白表达水平越高,其pCR率越低。HER2-0、1+和2+患者的pCR率分别为20.5%、15.5%和11.8%,呈现出明显下降趋势。这一趋势在HR阳性乳腺癌患者中尤为明显,而在HR阴性患者中则无显著差别。在本研究的TNBC亚组中,HER2-0、1+和2+患者的pCR率分别为23.1%、22.5%和17.1%,差异无统计学意义(P=0.598)。而在Luminal型乳腺癌中,HER2-0、1+和2+患者的pCR率分别为19.3%、11.1%和6.1%,pCR率与HER2表达存在显著相关性(P=0.008)。这一发现与多数研究报道[15-16]相一致。在一项包含了四项前瞻性临床试验、共2 310例肿瘤患者的研究中[15],HER2-low共1 098例(47.5%),HER2-0共1 212例(52.5%),HER2-low肿瘤的pCR率明显低于HER-0肿瘤(29.2% vs 39.0%,P=0.000 2),在HR阳性亚组中,HER2-low肿瘤的pCR率也明显低于HER2-0肿瘤,但在HR阴性亚组中差异无统计学意义。国内小样本量的类似研究[16]也得出相同结论。在生存分析方面,本研究结论也与既往研究报道[15]类似。总体而言,尽管HER-low患者pCR率较低,但对于non-pCR患者而言,HER2-low患者的预后显著优于HER2-0患者(P<0.001),其5年OS率达72.2%,而HER2-0仅为56.0%。这一发现也符合对于HER2-low是一类化疗相对不敏感,但预后较好类型(类似Luminal型)的乳腺癌的判断。在一项纳入3 689例HER2阴性乳腺癌患者的研究[17]中,研究者利用PAM50多基因检测工具进行分类,发现在HR阳性HER2-low肿瘤中,多数为Luminal型乳腺癌,其中58.9%为Luminal A型,33.4%为Luminal B型。与HR阳性和HER2-0肿瘤相比,HER2-low肿瘤表达更高水平的Luminal相关基因。而在TNBC中, HER2-low和HER2-0肿瘤之间未发现基因表达差异。本研究结果提示,HER2的表达在不同分型乳腺癌中可能具有不同的意义,仅在某些特定的分型中HER-low才具有独立分型价值。
然而也有国内研究[18]通过对TNBC患者进行为期8年的随访调查,并且联合运用单细胞转录组和单细胞免疫受体测序技术,阐述了HER2-low与HER2-0 TNBC各自具有的独特临床表现和生物学特性。在本研究的亚组生存分析中,无论在TNBC还是在Luminal型中,HER2-low患者均表现出一定的生存优势,但这一优势在TNBC中较为明显,而在Luminal亚型患者中差异无统计学意义。鉴于本研究的分析主要是基于化疗后non-pCR的患者,即化疗耐药的患者,进一步提示HER2的表达有助于区分耐药TNBC亚型,可能对未来的临床工作有一定的指导意义。
目前对于HER2-low的定义仍不十分明确。根据指南[10-11],HER2-0类别包括在<10%的肿瘤细胞中微弱表达HER2的肿瘤,而新型ADC在这类HER2微弱表达乳腺癌患者中有潜在治疗获益[19]。这表明HER2-low和HER2-0乳腺癌之间的区别可能还没有确定的界限值,因而目前的定义不能真正将表达HER2的肿瘤与不表达HER2的肿瘤分开。HER2本身检测的异质性也为HER2-low的识别带来了较大影响[2]。此外,HER2低表达范围内的IHC检测技术本身就存在一定缺陷。在一项使用现行标准HER2检测的研究中[20],使用来自世界各地1 400多个实验室数据的美国病理学会调研结果显示,目前的标准HER2检测对0和1+病例的评价一致性较差,仅为26%。事实上,本研究中44.3%的HER2阴性乳腺癌存在HER2-low,而其他大型研究[21]发现的比例大致为30% ~ 60%,不同研究间存在着较大差异。由于缺乏较理想的评价标准,难以更精确地识别HER2蛋白的表达,从而更准确地识别HER-low人群,本研究依然难以得到更具有临床实践价值的结论,难以对HER2-low的分子生物学本质进行更深层次的研究和探讨。因此,目前针对HER2蛋白的检测亟待进一步完善,以准确识别出具有临床价值的HER2-low人群,使其能够独立于HER2阳性和HER2阴性人群,从而使HER2相关乳腺癌真正进入三分法的时代。
近年来,新型ADC的问世,打破了只有HER2阳性乳腺癌患者能从抗HER2靶向治疗中获益的传统认知。DB04研究成果[7]的重磅发布,证实T-DXd在HER2-low乳腺癌中疗效显著,使得乳腺癌临床治疗分类发生重大转变。本研究作为一项单中心较大样本量的回顾性研究,证实HER2-low患者有别于其他HER2阴性患者,具有其独特的临床特征、化疗敏感性及预后特征。期待新的前瞻性研究针对该类型人群进行进一步精准分型、病理学检测标准等方面的探索,以带来相对应的治疗策略的调整。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]CHOONG G M, CULLEN G D, O'SULLIVAN C C. Evolving standards of care and new challenges in the management of HER2-positive breast cancer[J]. CA Cancer J Clin, 2020, 70(5): 355-374.
[2]WOLFF A C, HAMMOND M E H, ALLISON K H, et al. Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update[J]. J Clin Oncol, 2018, 36(20): 2105-2122.
[3]KROP I E, LORUSSO P, MILLER K D, et al. A phase Ⅱ study of trastuzumab emtansine in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer who were previously treated with trastuzumab, lapatinib, an anthracycline, a taxane, and capecitabine[J]. J Clin Oncol, 2012, 30(26): 3234-3241.
[4]BASELGA J, LEWIS PHILLIPS G D, VERMA S, et al. Relationship between tumor biomarkers and efficacy in EMILIA, a phase Ⅲ study of trastuzumab emtansine in HER2-positive metastatic breast cancer[J]. Clin Cancer Res, 2016, 22(15): 3755-3763.
[5]KIM S B, WILDIERS H, KROP I E, et al. Relationship between tumor biomarkers and efficacy in TH3RESA, a phase Ⅲ study of trastuzumab emtansine (T-DM1) vs treatment of physician’s choice in previously treated HER2-positive advanced breast cancer[J]. Int J Cancer, 2016, 139(10): 2336-2342.
[6]LEE C K, DAVIES L, GEBSKI V J, et al. Serum human epidermal growth factor 2 extracellular domain as a predictive biomarker for lapatinib treatment efficacy in patients with advanced breast cancer[J]. J Clin Oncol, 2016, 34(9): 936-944.
[7]MODI S N, JACOT W, YAMASHITA T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer[J]. N Engl J Med, 2022, 387(1): 9-20.
[8]HORTOBAGYI G N. Comprehensive management of locally advanced breast cancer[J]. Cancer, 1990, 66(6 Suppl): 1387-1391.
[9]SCHWARTZ G F, HORTOBAGYI G N. Proceedings of the consensus conference on neoadjuvant chemotherapy in carcinoma of the breast, April 26-28, 2003, Philadelphia, Pennsylvania[J]. Cancer, 2004, 100(12): 2512-2532.
[10]Expert group of expert consensus on neoadjuvant treatment of breast cancer in China ( edition) . Expert consensus on neoadjuvant treatment of breast cancer in China (2021 edition)[J]. China Oncol, 2022, 32(1): 80-89.
[11]《中国乳腺癌新辅助治疗专家共识(2022年版)》专家组. 中国乳腺癌新辅助治疗专家共识(2022年版)[J]. 中国癌症杂志, 2022, 32(1): 80-89.
Expert group of expert consensus on neoadjuvant treatment of breast cancer in China (2022 edition) . Expert consensus on neoadjuvant treatment of breast cancer in China (2022 edition)[J]. China Oncol, 2022, 32(1): 80-89.[12]
MODI S N, SAURA C, YAMASHITA T, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer[J]. N Engl J Med, 2020, 382(7): 610-621.
[13]TAKEGAWA N, TSURUTANI J, KAWAKAMI H, et al. Fam-] trastuzumab deruxtecan, antitumor activity is dependent on HER2 expression level rather than on HER2 amplification[J]. Int J Cancer, 2019, 145(12): 3414-3424.
[14]PRAT A, BARDIA A, CURIGLIANO G, et al. An overview of clinical development of agents for metastatic or advanced breast cancer without ERBB2 amplification (HER2-low)[J]. JAMA Oncol, 2022. [Online ahead of print].
[15]DENKERT C, SEITHER F, SCHNEEWEISS A, et al. Clinical and molecular characteristics of HER2-low-positive breast cancer: pooled analysis of individual patient data from four prospective, neoadjuvant clinical trials[J]. Lancet Oncol, 2021, 22(8): 1151-1161.
[16]易 巧, 左怀全. HER2低表达乳腺癌的临床病理学特征及其新辅助化疗疗效的相关影响因素分析[J]. 中国普外基础与临床杂志, 2022, 29(9): 1213-1219.
YI Q, ZUO H Q. Clinicopathological features of breast cancer with low HER2 expression and analysis of factors related to the efficacy of neoadjuvant chemotherapy[J]. Chin J Bases Clin Gen Surg, 2022, 29(9): 1213-1219.
[17]SCHETTINI F, CHIC N, BRASÓ-MARISTANY F, et al. Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer[J]. NPJ Breast Cancer, 2021, 7(1): 1.
[18]HU X E, YANG P, CHEN S H, et al. Clinical and biological heterogeneities in triple-negative breast cancer reveals a non-negligible role of HER2-low[J]. Breast Cancer Res, 2023, 25(1): 34.
[19]MODI S, PARK H, MURTHY R K, et al. Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2-low-expressing advanced breast cancer: results from a phase Ⅰb study[J]. J Clin Oncol, 2020, 38(17): 1887-1896.
[20]FERNANDEZ A I, LIU M, BELLIZZI A, et al. Examination of low ERBB2 protein expression in breast cancer tissue[J]. JAMA Oncol, 2022, 8(4): 1-4.
[21]TARANTINO P, HAMILTON E, TOLANEY S M, et al. HER2-low breast cancer: pathological and clinical landscape[J]. J Clin Oncol, 2020, 38(17): 1951-1962.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











