Science Advances:大连理工大学刘宇博/张嘉宁等揭示乳腺癌转移的调控新机制
2023-08-22 iNature iNature 发表于上海
该研究揭示FOXA1 O-GlcNAcylation介导的转录开关控制乳腺癌转移能力。
FOXA1是一种参与表观遗传重编程的转录因子,对乳腺癌的进展至关重要。然而,FOXA1实现其致癌功能的机制仍然是未知的。
2023年8月18日,大连理工大学刘宇博、张嘉宁及中科院大连化学物理研究所吴思晋共同通讯在Science Advances 在线发表了题为“FOXA1 O-GlcNAcylation–mediated transcriptional switch governs metastasis capacity in breast cancer”的研究论文,该研究揭示FOXA1 O-GlcNAcylation介导的转录开关控制乳腺癌转移能力。该研究证明了FOXA1的O-连接的β-N-乙酰葡糖胺修饰(O-GlcNAcylation)通过协调多种转移调节因子的转录来促进乳腺癌症转移。Thr432、Ser441和Ser443的O-GlcNAcylation调节FOXA1的稳定性并促进其与染色质的组装。
O-GlcNAcylation形成FOXA1相互作用组,特别是触发转录抑制因子甲基CpG结合蛋白2的募集,从而刺激FOXA1染色质结合位点转换到粘附相关基因的染色质基因座,包括EPB41L3和COL9A2。FOXA1上O-GlcNAcylation的位点特异性缺失影响各种下游基因的表达,从而在体外和体内抑制乳腺癌症的增殖和转移。总之,该研究的数据确定了异常FOXA1 O-GlcNAcylation在乳腺癌症进展中的重要性,并表明靶向O-GlcNAcylation是转移性癌症的治疗策略。

作为一种转录组重编程因子,FOXA1诱导的初始染色质反作用触发了与乳腺癌症进展中的细胞粘附、细胞周期、分化、代谢过程和其他信号通路相关的各种基因的转录能力,这表明FOXA1是一个潜在的治疗靶点。尽管FOXA1已被报道介导ER-结合事件并驱动癌症的发展,但这种TF的染色质结合特性可以独立于雌激素刺激。此外,对FOXA1转录的研究强调了这种TF与DNA甲基化之间的联系。有趣的是,全基因组定位分析显示,FOXA1优先结合低甲基化区域,而在其他研究中发现了FOXA1向甲基化CpG二核苷酸的募集。尽管人们认识到FOXA1在癌症中发挥着非凡的调节作用,但FOXA1实现这些显著功能的确切机制仍然难以捉摸。
O-GlcNAcylation是一种重要的翻译后修饰,用于调节染色质组装和基因表达。O-GlcNAc单糖动态且可逆地连接到各种核蛋白的丝氨酸或苏氨酸羟基部分,并且几乎参与转录的每一步。这种修饰是由O-GlcNAc转移酶(OGT)特异性催化的,糖苷酶O-GlcNA酶(OGA)负责从蛋白质中切割O-GlcNAc。越来越多的证据表明,异常的O-GlcNAcylation在表观遗传学和肿瘤发生之间形成了交叉联系。其他研究小组和研究者的小组已经证明,癌症细胞中整体O-GlcNAcylation的水平发生了改变,这些改变通过影响转录活性、DNA结合和染色质调节因子的蛋白质-蛋白质相互作用来保护细胞免受化疗刺激。O-GlcNAcylation可能控制基因组中多个癌症相关基因的不同顺式调节元件,并最终导致癌症进展。
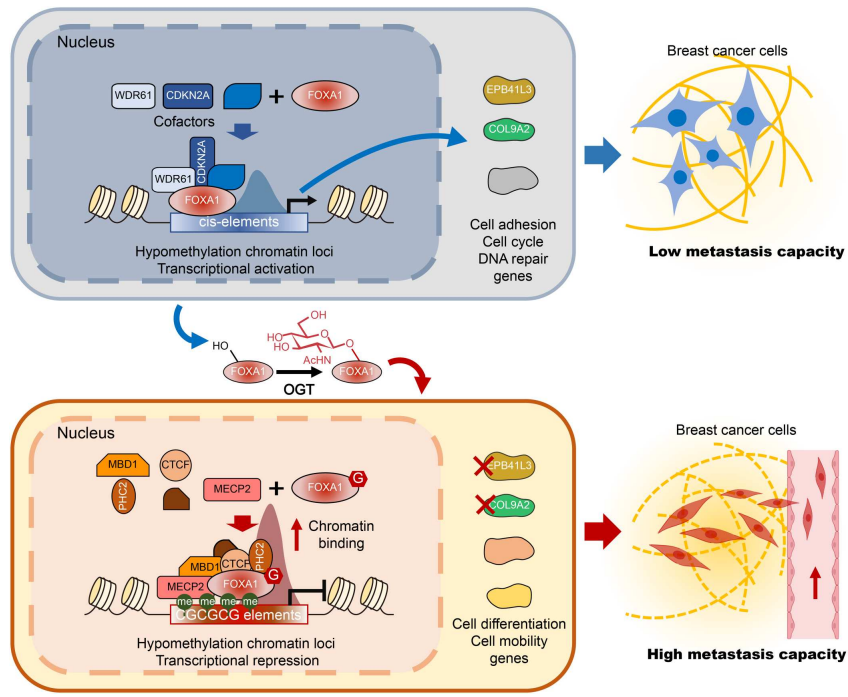
文章模式图(图源自Science Advances )
该研究揭示了FOXA1 O-GlcNAcylation增强乳腺癌症转移能力的一种以前未知的机制。在癌症细胞中证明了OGT和FOXA1之间的ER-非依赖性连接,其促进了三个保守位点(Thr432、Ser441和Ser443)的FOXA1 O-GlcNAcylation。该研究提供的证据表明,这些位点的O-GlcNAcylation塑造了FOXA1相互作用组,从而促进了FOXAl与癌症细胞染色质的组装。
O-GlcNAcylation触发的FOXA1和DNA甲基化读取器甲基CpG结合蛋白2(MECP2)之间的相互作用刺激FOXA1染色质结合位点的转换,导致转移相关基因的转录变化。此外,在小鼠异种移植物模型中,FOXA1上O-GlcNAcylation的缺失影响许多下游基因的表达,并抑制乳腺癌症细胞增殖和肿瘤转移。该研究的结果揭示了对异常FOXA1 O-GlcNAcylation在乳腺癌症进展中的关键作用的先前未知的机制见解,并通过减少FOXA1 O-GlcNAcylation为转移性癌症提供了潜在的治疗机会。
原文链接:
https://www.science.org/doi/full/10.1126/sciadv.adg7112
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言