基因疗法PR001治疗神经性戈谢病:IND已生效
Prevail Therapeutics是一家生物技术公司,致力于为神经退行性疾病患者开发基于腺病毒(AAV)的基因疗法,该公司近日宣布,美国FDA已通知Prevail,PR001用于治疗神经性戈谢病(
MedSci原创 - 神经性戈谢病,基因疗法PR001,FDA - 2019-12-27
FDA接受ST-001 nanoFenretinide治疗T细胞淋巴瘤的新药申请
美国FDA已接受SciTech Development公司的ST-001 nanoFenretinide的试验性新药(IND)申请,这是一种T细胞非霍奇金淋巴瘤(NHL)的实验性治疗方法。
MedSci原创 - nanoFenretinide,FDA,T细胞淋巴瘤 - 2019-12-24
FDA准许开展IMS001治疗多发性硬化症的临床计划
ImStem Biotechnology是一家生物制药公司,使用人类胚胎干细胞(ESC)衍生的间充质干细胞(hES-MSC)治疗神经系统疾病、自身免疫疾病和罕见疾病。
MedSci原创 - FDA,IMS001,多发性硬化症 - 2020-03-21
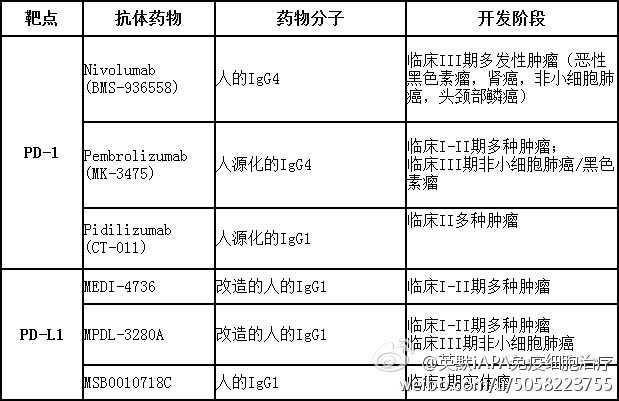
NEJM:Pembrolizumab用于晚期NSCLC展现出良好抗肿瘤活性(KEYNOTE-001研究)
来自Westwood Bowyer 癌症中心r的Edward B. Garon等在线发表在4月19日的《新英格兰医学杂志》上的研究显示:Pembrolizumab治疗晚期非小细胞肺癌患者具有抗肿瘤活性,且治疗时所发生的副反应在可接受的范围内。至少50%的肿瘤细胞出现PD-L1表达与pembrolizumab疗效提高具有相关性。 在一项一期研究中,研究者们对pembrolizumab抑制晚期非小细
MedSci原创 - Pembrolizumab,NSCLC - 2015-04-23
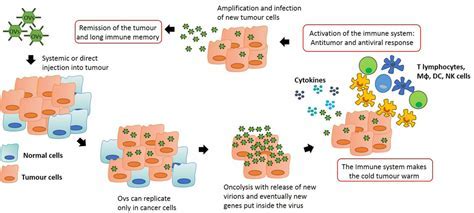
2020 AACR:多功能溶瘤病毒BT-001对实体瘤具有强大活性
生物技术公司BioInvent和Transgene今日公布了用于癌症治疗的多功能溶瘤病毒BT-001的临床前数据,展示了抗CTLA4抗体编码溶瘤病毒BT-001对实体瘤的广泛治疗潜力。
MedSci原创 - 溶瘤病毒,BT-001 - 2020-05-16
FDA已授予NTX-001快速通道资格:以治疗周围神经损伤(PNI)
Neuraptive是一家临床阶段的生物技术公司,致力于开发用于治疗周围神经损伤(PNI)的新型疗法。
MedSci原创 - 周围神经损伤,NTX-001 - 2020-05-15
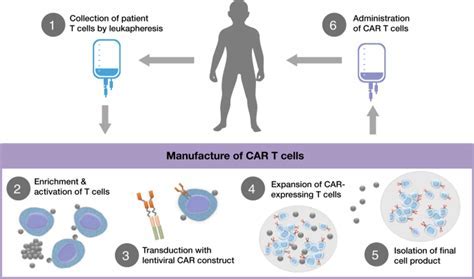
FDA授予CAR-T癌症疗法CLBR001 + SWI019“快速通道称号”
美国FDA已授予Calibr研发的新型“可切换”CAR-T细胞疗法CLBR001 + SWI019“快速通道称号”,以加快药物开发和审查。
MedSci原创 - CAR-T疗法,CAR-T细胞,CLBR001 + SWI019,快速通道称号,Calibr - 2020-10-02
FDA授予PR001治疗神经衰弱性戈谢病(nGD)的孤儿药认定
该公司近日宣布,美国食品药品监督管理局(FDA)已授予研究性基因疗法PR001治疗神经衰弱性戈谢病(nGD)的孤儿药认定。
MedSci原创 - 神经衰弱性戈谢病(nGD),PR001,孤儿药认定 - 2020-02-14
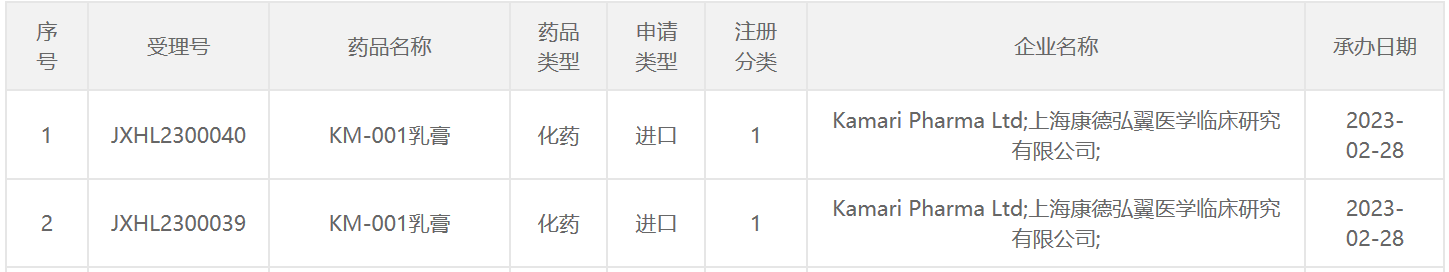
TRPV3抑制剂KM-001在中国申报临床,治疗皮肤瘙痒
新型TRPV3抑制剂KM-001乳膏向中国国家药监局药品审评中心(CDE)递交了1类新药临床试验申请,并获得CDE受理。KM-001是Kamari Pharma在研的一种治疗瘙痒的新型药物,也是一种T
MedSci原创 - 皮肤瘙痒,TRPV3抑制剂,KM-001 - 2023-03-07
通用型流感疫苗M-001的II期临床试验取得积极结果
BiondVax制药公司今日宣布,BiondVax的通用型流感疫苗候选药物M-001的II期临床试验取得积极结果。
MedSci原创 - 通用型流感疫苗,M-001,II期临床 - 2020-02-06
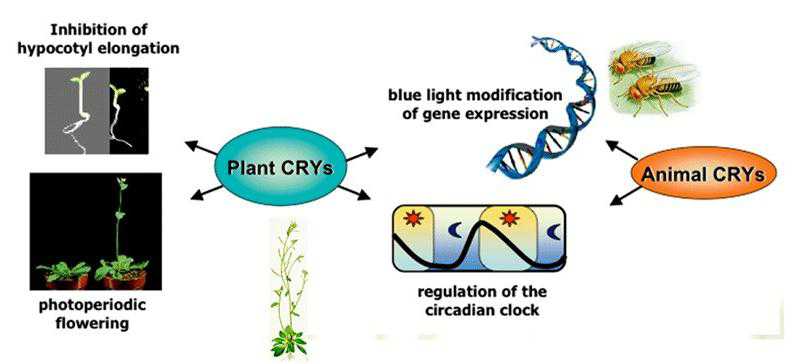
Science:KL001是一种与生物钟失调有关的小分子
7月12日,Science在线报道了一种新颖,有效的研究生物节律的小分子物质KL001. 生物钟失调一直伴随着许多生理障碍,包括代谢性疾病。通过一个非偏性以细胞为基础的昼夜节律筛选,研究者确定一个称为KL001的小分子,可特异性地与昼夜节律关键调节因子--蓝光受体蛋白crypto
生物谷 - KL001,生物钟,小分子 - 2012-07-16
Neuraptive Therapeutics宣布NTX-001预防面瘫的2期试验入组首位患者,并公布NTX-001治疗外伤导致的外周神经损伤的2期研究的最新进展
该试验旨在评估NTX-001在治疗和预防面瘫方面相比标准护理的安全性和有效性。
网络 - 临床阶段生物技术公司,治疗周围神经损伤 - 2022-07-25
美国FDA批准RV001治疗晚期前列腺癌的IIb期临床试验
RhoVac制药公司近日宣布,2020年2月28日,美国食品药品监督管理局(FDA)批准了RV001的研究性新药申请(IND),以启动RV001治疗晚期前列腺癌的IIb期临床试验。
MedSci原创 - RV001,晚期前列腺癌,FDA - 2020-03-01
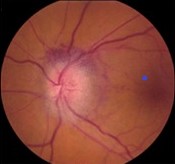
梅斯病例报告001|非动脉炎性前部缺血性视神经病变
男,62岁,因“左眼出现视力障碍5d,加重1d“于2020年4月28日急诊科就诊。患者主诉前一天晚上睡觉前视力正常(戴双焦矫正眼镜)次日醒来时,左眼出现严重视力模糊。
MedSci原创 - 病例讨论,非动脉炎性前部缺血性视神经病变 - 2021-05-19
大型人群队列现场调查管理技术规范(T/CPMA 001-2019)
前言 本标准按照GB/T 1.1-2009给出的规则起草。 本标准由中华预防医学会归口。 本标准起草单位:中国医学科学院、浙江省疾病预防控制中心、北京大学。 本标准主要起草人:郭彧、卞铮、谭云龙、许祥、刘亚宁、俞敏、龚巍巍、吕筠、余灿清、李立明。 本标准为首次发布。 引言 队列研究是经典的分析性流行病学方法之一,它满足由因及果的前瞻性时序关系,具有较强的因果检
中华流行病学杂志 - 队列,现场调查 - 2019-09-24
为您找到相关结果约500个