2019年6月CDE药品审评情况报告
摘要· 6月CDE共承办药品注册申请628件· 恒瑞医药提交马来酸吡咯替尼新适应症临床申请· 正大天晴首家提交甲磺酸仑伐替尼胶囊仿制申请· 9个品种通过仿制药一致性评价· 69个受理号获临床试验默示许可总体承办情况:药品注册申请628个据MED中国药品审评数据库2.0统计,2019年6月CDE共承办药品注册申请628个。
米内网 - CDE,药品审评 - 2019-07-04
FDA“创新行动计划”促进药品研发与审评
FDA新任局长Scott Gottlieb 博士于2017年7月7日在FDA的官方博客-FDA Voice上发表了题为“ How FDA Plans to Help Consumers Capitalize on Advances in Science”的文章,旨在推行“创新行动计划”,使公众尽快获益于安全有效的新药和新的医疗技术。
CDE网站;凡默谷 - FDA,药品研发,药品评审 - 2017-09-08
药监局重磅发布:2018年度药品审评报告
7月1日,国家药品监督管理局药品审评中心官网发布了2018年度药品审评报告。2018年,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家局)坚强领导下,继续贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44
药监局 - 药监局 - 2019-07-03
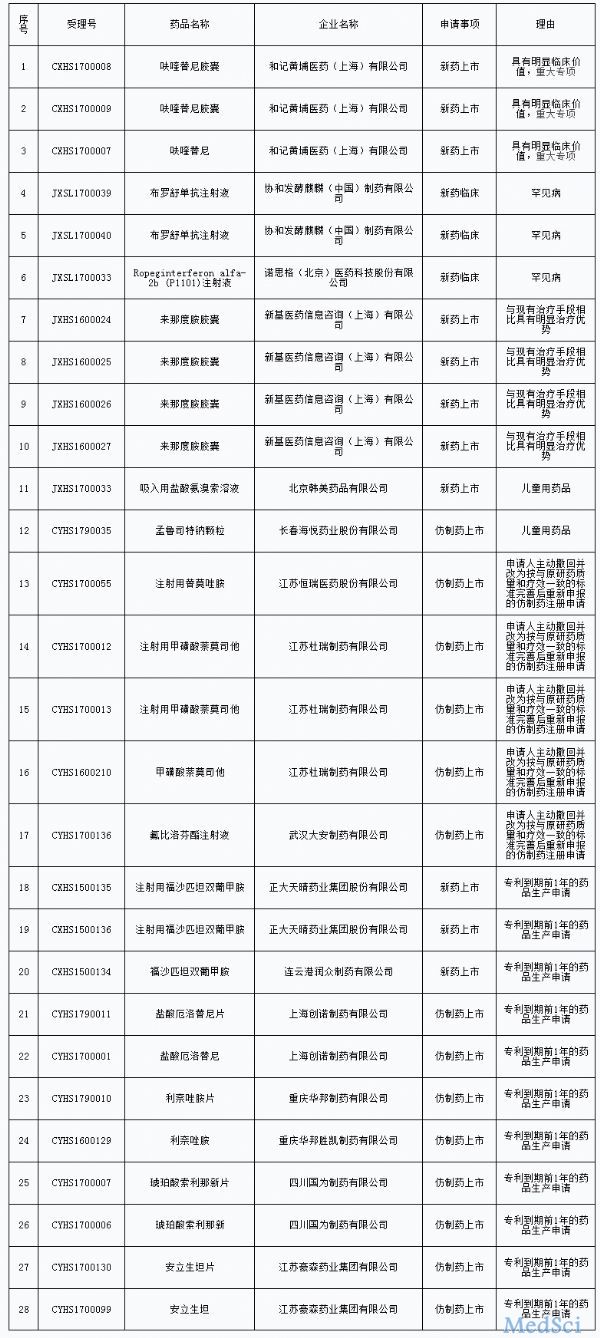
最新优先审评名单出炉,再添28个药品
今日(9月4日),国家食品药品监督管理总局药品审评中心(简称“CDE”)发布《拟纳入优先审评程序药品注册申请的公示(第二十二批)》,将拟优先审评的药品注册申请及其申请人予以公示,根据公示名单,此次入选的28个药品,13个药品为仿制药上市,3个药品为新药临床,其余12个为新药上市,具体名单如下:
医谷 - 药品,评审,药品注册申请 - 2017-09-04
中国药品审评审批制度改革提速,药品申请积压现象缓解
日前,原国家食品药品监管总局(现国家市场监管总局)发布了《2017年度药品审评报告》(以下简称《报告》)。报告显示,在鼓励药物创新、提高药品质量方面,我国药品审评审批制度改革发挥了重要作用。2015年,国务院发布《关于改革药品医疗器械审评审批制度的意见》,提出了12项改革任务;2017年,中办、国办发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出鼓励药品创新36条意见。
东方网 - 中国药品,审批,药品 - 2018-04-08
《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》修订说明
我们对《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》工作程序进行了修订,现面向社会征求意见。
国家药品监督管理局药品审评中心 - 临床试验 - 2023-07-10
第27批拟被纳入优先审评药品名单出炉 26药品入选
CDE官网公示了第二十七批拟纳入优先审评程序药品注册申请名单,其中,12药品为新药上市,9药品为新药临床,其余5药品为仿制药上市申请。
CDE官网 - 优先审评,CDE,药品注册 - 2018-03-29
对比药品关联审评审批政策 明确法规趋向
2019年7月16日,国家药监局发布《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年 第56号,简称"正式稿",下同),这对应的是2019年4月4日发布的国家药监局综合司再次公开征求《关于进一步完善药品关联审评审批和监管工作有关事宜的公告(征求意见稿)》(简称"征求意见稿",下同)。
CPhI制药在线 - 药品关联审批,法规政策 - 2019-07-31
我国药品审评审批制度改革再提速
日前,原国家食品药品监管总局(现国家市场监管总局)发布了《2017年度药品审评报告》(以下简称《报告》)。报告显示,在鼓励药物创新、提高药品质量方面,我国药品审评审批制度改革发挥了重要作用。
光明日报 - 药品审评审批,制度改革,中国 - 2018-04-08
药品审评审批信息保密管理实施细则出台
日前,国家药品监督管理局公布《关于加强药品审评审批信息保密管理的实施细则》(以下简称《实施细则》),以维护药品注册申请人的合法权益,规范和加强审评审批信息保密管理,确保药品审评审批工作合法高效运行。
中国医药报 - 药品审评审批,信息保密管理 - 2018-05-23
国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)(征求意见稿)
为落实《药品注册管理办法》(国家市场监督管理总局令第27号)相关要求,我中心组织起草了《国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)》,现在中心网站予以公示,以广泛听
CDE - 药品审评 - 2021-11-19
药审中心技术审评报告公开工作规范(试行)
根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)和《药品注册管理办法》(国家市场监督管理总局令第27号)等相关规定,为进一步落实药品审评审批改革相关要求,深入推进审评信息
CDE - 药审中心 - 2021-05-13
《药品注册申请审评期间变更工作程序》(征求意见稿)
为配合《药品注册管理办法》(国家市场监督管理总局令第27号)的贯彻实施,我中心组织起草了《药品注册申请审评期间变更工作程序》,经请示国家局,现在中心网站予以公示。
CDE - 药品注册 - 2021-06-27
为您找到相关结果约500个