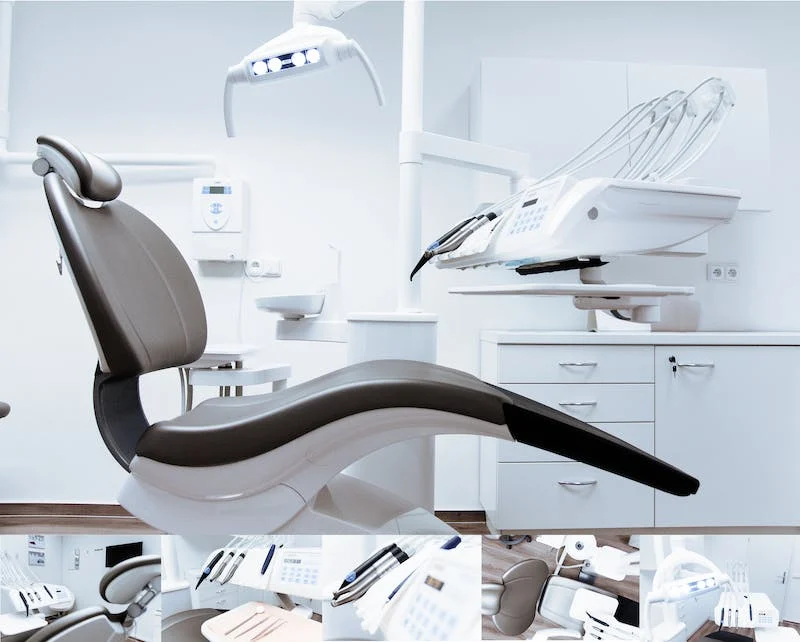
爱琅医疗携多款首秀产品亮相第六届进博会 以创新赋能发展,以专注迎面变革
爱琅医疗携多款“中国首秀”、“展品变商品”、“本土化生产”创新产品重磅亮相,全方位展示企业创新产品组合、研发实力与本土化发展的最新成果,坚定推动中国介入领域高质量发展的承诺与决心。
爱琅医疗 - 2023-11-06
国家药监局器审中心关于发布医疗器械真实世界研究设计和统计分析注册审查指导原则的通告(2024年第3号)
为进一步引导医疗器械真实世界研究的规范开展,国家药监局器审中心组织制定了《医疗器械真实世界研究设计和统计分析注册审查指导原则》,现予发布。
国家药品监督管理局 - 医疗器械真实世界研究 - 2024-01-18
YY 0272-2023《牙科学 氧化锌/丁香酚水门汀和不含丁香酚的氧化锌水门汀》等20项医疗器械行业标准
YY 0272-2023《牙科学 氧化锌/丁香酚水门汀和不含丁香酚的氧化锌水门汀》等20项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和
国家药品监督管理局官网 - 医疗器械 - 2023-07-03
国家药监局综合司公开征求《关于进一步加强医疗器械注册人委托生产监管工作的意见(征求意见稿)》意见
国家药监局组织起草了《关于进一步加强医疗器械注册人委托生产监管工作的意见(征求意见稿)》,现向社会公开征求意见。
国家药品监督管理局 - 医疗器械注册人委托生产监管 - 2023-07-29
FDA指南:使用国际标准ISO10993-1“医疗器械的生物学评估-第1部分:风险管理过程中的评估和测试”
本指南的目的是提供有关使用国际标准ISO 10993-1“医疗器械生物学评估-第1部分:风险管理过程中的评估和测试”的进一步澄清和更新信息,以支持向FDA的申请。
FDA官网 - 风险管理 - 2023-12-19
YY/T 1426.2—2016《外科植入物 全膝关节假体的磨损 第2部分:测量方法》医疗器械行业标准第1号修改单
本文为国家药品监督管理局审核发布的文件:YY/T 1426.2—2016《外科植入物 全膝关节假体的磨损 第2部分:测量方法》医疗器械行业标准第1号修改单。
国家药品监督管理局官网 - 膝关节假体 - 2023-11-27
YY/T 0919—2014《无源外科植入物关节置换植入物 膝关节置换植入物的专用要求》医疗器械行业标准第1号修改单
本文为国家药品监督管理局审核发布的文件:YY/T 0919—2014《无源外科植入物 关节置换植入物 膝关节置换植入物的专用要求》医疗器械行业标准第1号修改单。
国家药品监督管理局官网 - 关节置换 - 2023-11-27
FDA 工业和食品药品监督管理局工作人员指南:某些旨在治疗性改善 2 型糖尿病患者血糖控制的医疗器械的可行性和早期可行性临床研究
本指导文件提供了 FDA 对某些旨在治疗改善 2 型糖尿病 (T2DM) 患者血糖控制的医疗器械的可行性和早期可行性临床研究的建议。这些医疗器械旨在治疗性地降低 T2DM 患者的糖化血红蛋白 (HbA
FDA官网 - 2型糖尿病,血糖控制 - 2022-07-08
YY/T 1426.3—2017《外科植入物 全膝关节假体的磨损 第3部分:位移控制的磨损试验机的载荷和位移参数及相关的试验环境条件》医疗器械行业标准第1号修改单
本文为国家药品监督管理局审核发布的文件:YY/T 1426.3—2017《外科植入物 全膝关节假体的磨损 第3部分:位移控制的磨损试验机的载荷和位移参数及相关的试验环境条件》医疗器械行业标
国家药品监督管理局官网 - 膝关节假体 - 2023-11-27
YY/T 1426.1—2016《外科植入物 全膝关节假体的磨损 第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件》医疗器械行业标准第1号修改单
本文为国家药品监督管理局审核发布的文件:YY/T 1426.1—2016《外科植入物 全膝关节假体的磨损 第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件》医疗器械行业标
国家药品监督管理局官网 - 全膝关节假体 - 2023-11-27
国家药监部门或将收回二类医械审评审批权
《医疗器械监督管理条例修正案(草案送审稿)》公开征求意见,将第二类医疗器械产品注册由省、自治区、直辖市药品监督管理部门审评审批改由国务院药品监督管理部门审评审批,对审批程序也进行了一定优化。
健康点healthpoint - 国家药监部门,二类医械审评审批权 - 2018-06-29
CFDA:中国无创产前检测试剂批准上市
7月2日,国家食品药品监督管理总局在官网上发布通知,首次批准第二代基因测序诊断产品上市,根据通知,这次批准的产品是华大基因的BGISEQ-1000基因测序仪、BGISEQ-100基因测序仪和胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(联合探针锚定连接测序法)、胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(半导体测序法)医疗器械注册。上述获批的产品可通过对孕周12周以上
不详 - 药品,产前检测 - 2014-07-03
为您找到相关结果约500个