赛诺菲计划重新提交单抗药Lemtrada sBLA
赛诺菲(Sanofi)及旗下健赞(Genzyme)4月7日宣布,经过与FDA之间富有建设性的讨论,计划于第二季度重新向FDA提交单抗药物Lemtrada(alemtuzumab,阿伦单抗)的补充生物制品许可申请
生物谷 - 新药,FDA - 2014-04-08
ESTRIMS 2016:赛诺菲Lemtrada治疗复发缓解型多发性硬化症(RRMS)疗效持续长达6年
法国制药巨头赛诺菲(Sanofi)近日在英国伦敦举行的第32届欧洲多发性硬化治疗和研究委员会(ECTRIMS)大会上公布了多发性硬化症药物Lemtrada(alemtuzumab)治疗复发缓解型多发性硬化症CARE-MS 2个关键III期临床研究中接受Lemtrada治疗的RRMS患者,在为期2年时间的研究中所取得的疗效在扩展研究中的额外4年时间中均得以维持。
生物谷 - Lemtrada,alemtuzumab,多发性硬化症 - 2016-09-24
CHMP建议批准赛诺菲单抗药物Lemtrada用于活动性复发缓解型多发性硬化症(RRMS)治疗
赛诺菲(Sanofi)旗下健赞(Genzyme)上周五宣布,单抗药物Lemtrada(alemtuzumab)获得了欧洲药品管理局(EMA)人用医药产品委员会(CHMP)积极意见。CHMP建议批准Lemtrada用于活动性复发缓解型多发性硬化症(RRMS)成人患者的治疗。预计欧盟委员会(EC)将在未来几个月内做出最终审查决定。Lemtrada是一种单克隆抗体,靶向于CD52,这是一种位于T细胞及B
生物谷 - 赛诺菲,Lemtrada,RRMS,CD52,阿仑单抗 - 2013-07-03
由于毒副作用,欧洲药品管理局建议限制Lemtrada在多发性硬化症中的使用
欧洲药品管理局的药物警戒风险评估委员会(PRAC)已开始审查赛诺菲的多发性硬化症药物Lemtrada(alemtuzumab)。
MedSci原创 - 毒副作用,Lemtrada,多发性硬化症 - 2019-04-15
【盘点】9月多发性硬化症研究进展一览
【盘点】9月多发性硬化症研究进展一览多发性硬化(Multiple Sclerosis,MS)是一种无法治愈的神经系统进展性疾病,主要损害脊髓、大脑以及视神经,易发于15-40岁青壮年人群,常见的症状有视力模糊、身体麻木、四肢异常疲劳等,如不治疗,严重时会造成突然失明、瘫痪。我国目前还缺乏这方面的流行病学数据,特点尚不明确。现在小M整理了关于MS研究的新进展及重大新闻与大家分享。【1】ECTRI
MedSci原创 - 多发性硬化症 - 2016-09-28
2012年新药市场群星璀璨
2012年,一批新的重要药物即将上市销售,作为新秀的它们,将给医药市场带来更多生机和活力。 Inlyta:竞争者众多 辉瑞公司的Inlyta(阿西替尼)已被批准为肾细胞癌的二线治疗药物。预计该药2014年将达到每年6亿美元的销售收入,不过,这一市场竞争依旧激烈,主要竞争者包括辉瑞的索坦(舒尼替尼)、拜耳的多吉美(索拉非尼)、葛兰素史克的Votrient(帕唑帕尼)和诺华的Afinitor(依维
医药经济报 - 新药,FDA - 2012-04-16
1年注射2次!罗氏多发性硬化症新药Ocrevus将2017年上市,年销轻松突破20亿美元
瑞士制药巨头罗氏(Roche)免疫管线近日在欧盟和美国监管方面同时传来喜讯。欧盟方面,欧洲药品管理局(EMA)已受理单抗药物Ocrevus(ocrelizumab)治疗复发型多发性硬化症(RMS)和原发进展型多发性硬化症(PPMS)的上市许可申请(MAA)。美国方面,FDA已受理Ocrevus治疗RMS和PPMS的生物制品许可申请(BLA),同时授予优先审查资格并指定处方药用户收费法(PDUFA)
生物谷 - 罗氏,Ocrevus,Ocrelizumab,多发性硬化症 - 2016-06-29
CTRIMS 2016:罗氏新药Ocrevus(一年注射2次)显著提高多发性硬化症疾病控制
瑞士制药巨头罗氏(Roche)近日在英国伦敦举行的第32届欧洲多发性硬化治疗和研究委员会(ECTRIMS)大会上公布了多发性硬化症新药Ocrevus(ocrelizumab)治疗复发型多发性硬化症(RMS)和原发进展型多发性硬化症(PPMS)的3个III期临床的新分析数据。 在单独的事后分析中,Ocrevus提高了RMS患者和PPMS患者的疾病控制。这些分析中,采用临床预后和MRI检查结
生物谷 - 多发性硬化症 - 2016-09-19
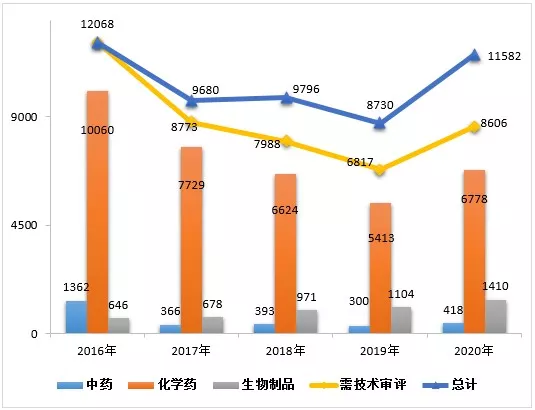
2020年度药品审评报告
2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,中国国家药品监督管理局药品审评中心(以下简称药审中心)在中国国家药品监督管理局(以下简称国家药监局)的坚强领导下,贯彻《药品管理法》《疫苗管理法
CDE - 药品审评报告 - 2021-06-23
赛诺菲多发性硬化症新药Lemtrada获FDA批准上市
上周五,美国FDA更改了其早前的决定,决定批准制药巨头赛诺菲公司开发的多发性硬化症药物Lemtrada上市。这一决定也表明赛诺菲公司在这一领域再下一城。不过,和其他多发性硬化症药物类似,Lemtrada上市时,也会着重标明这种药物可能会导致自身免疫反应以及其他严重的不良反应。同时药物的使用有增大患者患甲状腺癌等恶性癌症的风险。大约一年前,FDA就因为担忧Lemtrada的副作用而选择将其拒之门
生物谷 - 赛诺菲,新药Lemtrada - 2014-11-19
FDA委员会:安全性问题不妨碍赛诺菲MS药物Lemtrada的获批
FDA顾问委员会周三举行会议,认为赛诺菲(Sanofi)开发的实验性多发性硬化症(MS)药物Lemtrada的安全性问题,并不妨碍(preclude)该药的批准,但该委员会对相关临床研究的质量表示了担忧该委员会以17:0,1票弃权的投票结果认为,Lemtrada潜在导致癌症及其他严重疾病的安全性问题,不能成为阻止MS患者获得该药的一个理由。 然而,该委员会大多数成员认为,Lemtrad
生物谷 - 新药,FDA - 2013-11-20
FDA审查人员对赛诺菲旗下MS药物阿仑单抗安全性表示担忧
美国食品药品管理局(FDA)对使用赛诺菲旗下多发性硬化症新药阿仑单抗患者所存在的“多种严重及潜在致命安全性问题”表示担忧,这也给这款药物能否获批增加了不确定性因素。FDA审查人员在先于11月13日专家顾问小组召开会之前准备的一项报告中说,阿仑单抗的风险可能太大而不能使其在这个全球最大医药市场获得批准,除非这款药物显示有“相当的临床受益。” 阿仑单抗是一种注射剂药物,是赛诺菲两
dxy - 赛诺菲,MS药物阿仑单抗 - 2013-11-11
2013年全球药物研发的一些新的趋势
在过去被称为失去的十年中,全球制药业的研发产品线并不理想。近年来有哪些趋势呢?William Looney给您进行如下解释。作者主要介绍了包括以下一些研究热点领域:老年性痴呆,丙肝药物,类风湿性关节炎,肿瘤,高血脂,糖尿病,多发性硬化,骨质疏松,以及一些孤儿药的开发状况。
MedSci原创 - 药物,研发 - 2013-07-05
“常见”的罕见病(rare diseases,RD)有哪些?
近年来,不少罕见病“砸入”了我们的眼球,从引发全球关注“冰桶挑战”,常被误认为是颈椎病的ALS(肌萎缩侧索硬化症,患者俗称“渐冻人”),到有一个可爱名字的“瓷娃娃”病(也就是成骨不全症),从香港艺人杜汶泽患上的“怪病”——Fisher综合征(一种多发性神经炎疾病),到被称为月亮孩子的白化病,罕见病 (rare diseases,RD)不仅给患者及其家庭带来了无尽的痛苦,而且也造成了不少社会问题
MedSci原创 - 罕见病,多发性硬化 - 2015-01-01
为您找到相关结果约14个