王福俤&闵军霞团队| 审校、编辑、排版
铁死亡Club编委会| 审校
2022年1月25日星期二,王福俤/闵军霞团队在国际著名学术期刊《Cell Death & Differentiation》(影响因子15.828)发表题为 “The multifaceted role of ferroptosis in liver disease” 的综述。该综述总结了铁死亡在肝脏疾病研究最新进展,提出靶向铁死亡诊治肝脏疾病的新策略,并讨论领域未来发展方向 [1]。
Reviewer: This extensively revised manuscript is excellent and should be published quickly.
(论文评审匿名专家:论文精修稿超级棒,杂志应该尽快发表)
免费全文下载链接:
https://doi.org/10.1038/s41418-022-00941-0

图1. 论文首页截图
肝脏疾病仍是全球致死严重疾病;越来越多研究提示铁死亡等多种细胞死亡方式在肝病发生和发展过程中起到关键作用。综述从五个部分/角度高度凝练了铁死亡与肝病研究进展。
综述,首选总结了肝脏在机体营养物质代谢中的重要作用,同时肝脏作为重要的贮铁器官,在维持铁稳态的过程中发挥着不可替代的重要作用,铁稳态失衡会引起脂质过氧化堆积触发细胞铁死亡最后导致铁死亡相关疾病。进一步,描述了调控铁死亡分子通路,同时讨论了氧化应激相关转录因子和线粒体在铁死亡中的作用。随后,描述和讨论了铁死亡在从急性肝损伤到肝纤维化最后到肝癌等肝脏疾病发生发展的报道和研究进展,这些研究都说明了铁死亡在不同肝脏疾病中发挥了不可忽视中重要作用,同时总结了铁死亡激活剂和抑制剂作用机制和靶点。
最后作者展望了靶向铁死亡治疗肝脏疾病诊治策略以及相关药物开发应用前景、机遇和挑战。
Part 1 肝脏中糖、脂肪及氨基酸的代谢与铁死亡
肝脏作为机体糖、脂和氨基酸等营养物质的代谢中心,其代谢功能异常会导致细胞氧化应激和发生肝脏代谢性疾病。在这一过程中,许多代谢通路和代谢产物都与铁死亡发生密切有关,例如NADPH的生成和脂肪酸代谢等。
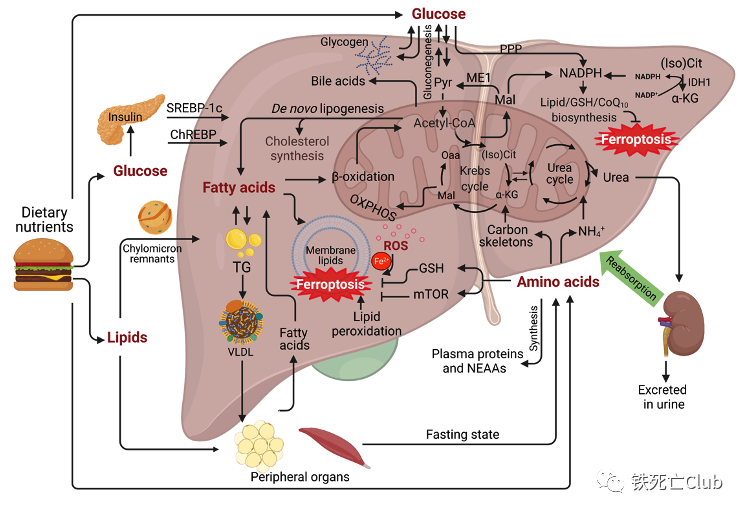
图2. 肝脏糖、脂肪和氨基酸代谢模式图
(论文figure 1)
Part 2 肝脏铁稳态与铁死亡
机体、肝脏和细胞铁稳态受到各种信号和通路的精准调控,以维持机体正常的生理功能。简言之,铁通过TFR1(transferrin receptor 1)和SLC39A14运输到肝细胞内参与各项生理过程和代谢过程,多余的铁储存在铁蛋白(ferritin)中,最后由铁泵蛋白(ferroportin, FPN)外排。铁调素(hepcidin)、RNF217(ring finger protein 217)和IRP(iron regulatory protein)等众多调控因子构成了胞内精密且复杂的调控网络。调控失衡会导致铁过载,过量的游离铁就会介导芬顿反应(Fenton reaction)引起多不饱和脂肪酸的脂质过氧化和最终的铁死亡。
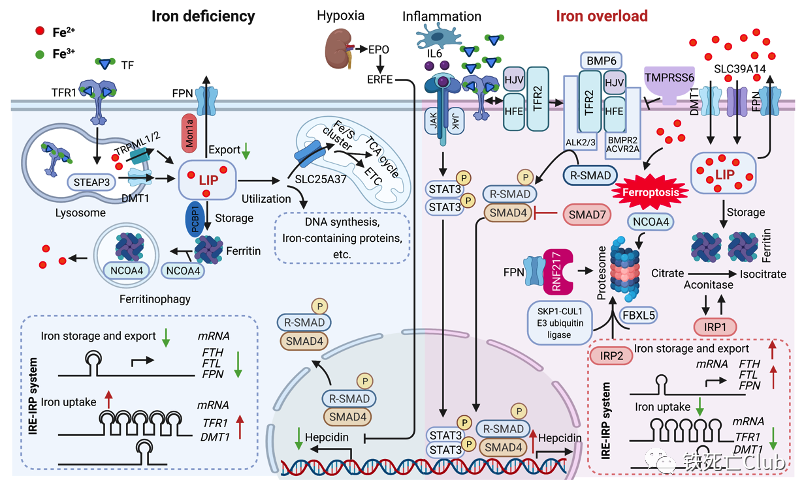
图3. 肝脏及肝细胞铁稳态调控模式图
(论文figure 3)
Part 3 铁死亡调控通路
除铁代谢通路参与了铁死亡调控以外,还有多条代谢通路和抗氧化系统参与铁死亡发生。这些通路包括GSH/GPX4轴、NAD(P)H/FSP1/CoQ10系统和GCH1/BH4/DHFR系统,同时线粒体GPX4和DHODH以及NRF2、p53和YAP1/TAZ等转录因子在调控铁死亡过程中发挥了重要的作用。
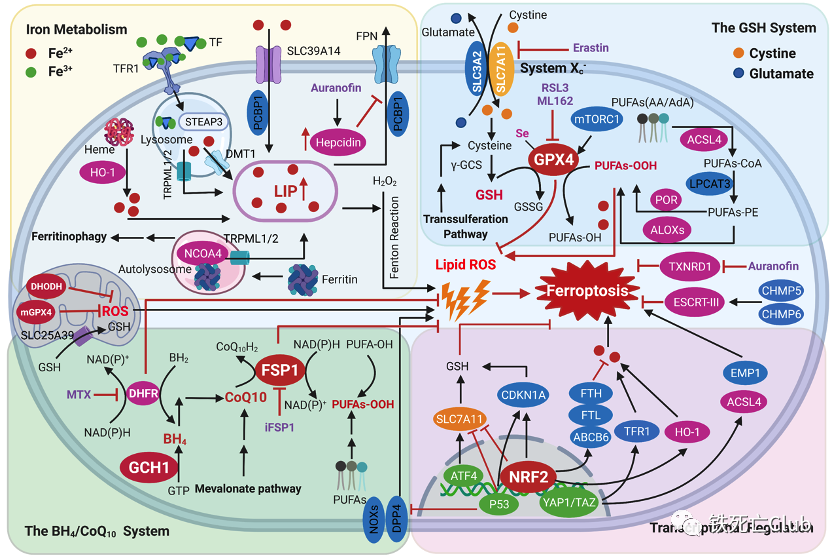
图4. 肝脏铁死亡调控通路模式图
(论文figure 4)
Part 4 铁死亡在肝脏疾病中的作用
药物(对乙酰氨基酚)或缺血再灌注均可造成急性肝脏损伤中细胞发生铁死亡,并且铁死亡抑制剂能够有效的缓解肝脏损伤。长期刺激因素(病毒、酒精和铁蓄积等)会导致急性损伤转化为肝炎、肝纤维化到不可逆的肝硬化等慢性肝脏疾病。作者团队研究揭示了转铁蛋白(transferrin)通过向胞外排铁抑制铁死亡的发生和肝脏的纤维化[2]。此外,诱导肝脏星状细胞铁死亡从而阻断纤维生成也是潜在的治疗策略。铁死亡还参与非酒精性脂肪肝炎(non-alcoholic steatohepatitis, NASH)发生和发展过程中,在小鼠NASH模型中,抑制铁死亡显著降低NASH的严重程度。不同于上述肝脏疾病,肝癌中肿瘤细胞存在着逃逸细胞死亡的倾向,但耐药肿瘤细胞对铁死亡仍有很高的敏感性,提示靶向肿瘤细胞铁死亡能够治疗肝癌和克服耐药。
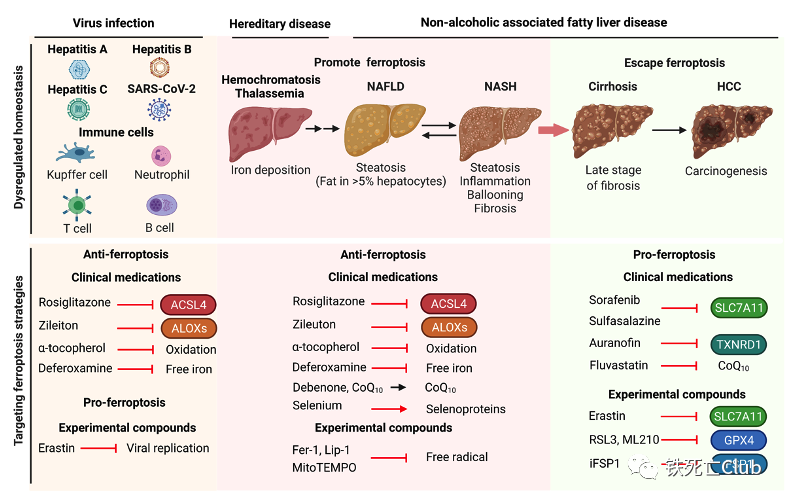
图5. 靶向铁死亡治疗肝病策略模式图
(论文figure 5)
感谢西湖大学邹贻龙教授、MD Anderson肿瘤研究中心甘波谊教授、王福俤/闵军霞教授团队蒋丽博士和余盈盈博士对文稿审校建议。该成果得到国家自然科学基金和国家重点研发计划的资助。
浙江大学医学院陈峻逸研究生、李肖朋博士后和葛朝东研究生为共同第一作者。
浙江大学医学院闵军霞教授和浙江大学医学院王福俤教授为共同通讯作者;南华大学为合作单位。
近日,王福俤团队铁死亡领域另一篇综述发表在国际著名学术期刊《Liver International》(影响因子5.828),论文题目为“Ferroptosis and metabolic dysfunction-associated fatty liver disease: Is there a link?”。该综述深入讨论了“铁死亡与代谢相关脂肪性肝病MAFLD”研究进展以及靶向铁死亡给MAFLD疾病诊治带来的新希望。温州医科大学郑明华教授和浙江大学王福俤教授为论文共同通讯作者。
免费全文下载链接
https://onlinelibrary.wiley.com/doi/10.1111/liv.15163

图6. 综述论文首页截图
靶向铁死亡防治肝病
——王福俤/闵军霞团队重要研究方向之一
重要代表作如下
2007年,发现新基因Mon1a调控铁泵蛋白(Ferroportin,FPN)维持巨噬细胞铁稳态重要功能及机制,成果发表在著名学术期刊《Nature Genetics》[3];2011年团队利用组织特异敲除小鼠阐明铁泵蛋白是肝实质细胞及巨噬细胞铁离子外排蛋白质分子,成果先后发表在著名学术期刊《Hepatology》[4]和《Blood》[5]。
2017年,首次利用多种铁过载性基因敲除小鼠模型发现并阐明铁死亡是铁过载诱发血色病消暑肝脏损伤的重要致病机制。成果以封面论文形式发表在《Hepatology》(影响因子17.425);论文题目为:“Characterization of ferroptosis in murine models of hemochromatosis”(高被引论文)[6]。
2020年,首次揭示并阐明转铁蛋白通过调控铁死亡抑制肝脏纤维化发生的分子机制;并首次利用动物模型展示肝脏的金属离子转运蛋白Slc39a14通过吸收非转铁蛋白结合铁而诱发肝实质细胞铁死亡,进而导致肝脏纤维化的发生,有望成为肝脏纤维化防止的新靶点[2]。成果以封面论文形式发表在著名学术期刊《Blood》(影响因子23.629);论文题目为 “Hepatic transferrin plays a role in systemic iron homeostasis and liver ferroptosis”(高被引论文)[2]。
2020年,团队发现药物金诺芬通过抑制硫氧还蛋白还原酶TXNRD导致细胞膜脂质过氧化累积,并最终引发铁死亡。该成果首次将TXNRD蛋白引入到铁死亡调控网络。这也是全球建立的第一个铁死亡肝损伤模型——金诺芬诱导模型。成果发表在著名学术期刊《Signal Transduction and Targeted Therapy》(影响因子18.187);论文题目为“Auranofin mitigates systemic iron overload and induces ferroptosis via distinct mechanisms” [7]。
2021年,团队首次阐明铁泵蛋白在体内外被降解的调控机制,揭示新蛋白分子RNF217作为E3连接酶通过泛素化降解FPN,还同时发现DNA去甲基化酶Tet1具有调控铁稳态的重要功能。成果发表以封面论文发表在著名学术期刊《Blood》(影响因子23.629) [8];论文题目为 “RNF217 regulates iron homeostasis through its E3 ubiquitin ligase activity by modulating ferroportin degradation”。
2021年,与厦门大学刘刚团队合作,首次报道临床常用肝功能检测及手术导航制剂吲哚菁绿(ICG)可作为磁共振对比剂和去铁剂用于铁过载疾病诊疗一体化新策略,原创性地提出开发ICG作为铁螯合剂,用于体内外铁过载疾病的诊疗一体化研究。成果发表在Science旗下子刊《Science Advances》(影响因子14.136),题目为 “Repurposing ICG enables MR/PA imaging signal amplification and iron depletion for iron-overload disorders” [9]。
参考文献
细胞铁死亡交流群
扫描下方二维码进入细胞铁死亡交流群
可与该领域大咖一起交流研究

关注铁死亡微信公众号
获得更新的入群二维码
若后期群人员数量达到上限
将开设分站群
欢迎大家关注与加入我们
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#铁死亡#
75