病理干货 | 肝癌中基于治疗疗效的生物标志物
2023-11-08 上海阿克曼病理 上海阿克曼病理 发表于上海
在这篇文章中,我们重点介绍了肝癌生物标志物的一些最新研究进展和未来应用方向。
肝癌是目前最常见的恶性肿瘤之一,发病率和死亡率都很高。也是全球第二大致命的恶性肿瘤[1]。虽然在肝癌治疗方面取得了相当大的进展,各种治疗方法包括局部区域治疗、分子靶向治疗和免疫治疗已被广泛应用,然而,肝癌患者的5年总生存期(OS)并没有显著改善,保持在30%。原因包括早期筛查和诊断能力不足,复发和转移发生率高,肿瘤异质性高,以及免疫抑制肿瘤微环境。因此,识别和验证特异性和稳健的肝癌生物标志物对于早期筛查、及时诊断、准确预后和预防肿瘤进展具有重要意义。在这篇文章中,我们重点介绍了肝癌生物标志物的一些最新研究进展和未来应用方向。
01 肝癌的潜在生物标志物
血清标志物的检测在肝癌的诊断中起着至关重要的作用。液体活检通过检测体液中少量肿瘤来源的核酸和其他生物标志物(主要是血液样本),为早期肿瘤诊断提供了希望。液体活检可以对循环肿瘤细胞(CTCs)、循环肿瘤DNA(ctDNA)、循环RNA(miRNAs、circRNAs和lncRNAs)和细胞外囊泡(EVs)[2]进行分析。它们参与了肝癌的发生、进展和转移,与患者的预后密切相关。可以作为早期诊断和治疗进展监测[3]生物标志物。
随着多组学技术的进步,肝癌的潜在组织学标志物也有新的发现。通过对HCC和非病理组织的广泛分析,揭示了与HCC预后相关的各种差异表达分子,包括EpCAM、CD90、CD133和CK19等。此外,DNA甲基化从肝硬化到发育不良病变逐渐增加,并在HCC[4]早期达到最大值(图1),Anwar等人证实,在HCC上存在频繁和广泛的DNA甲基化畸变,其中一组低甲基化患者的OS[5] 较短(图1)。

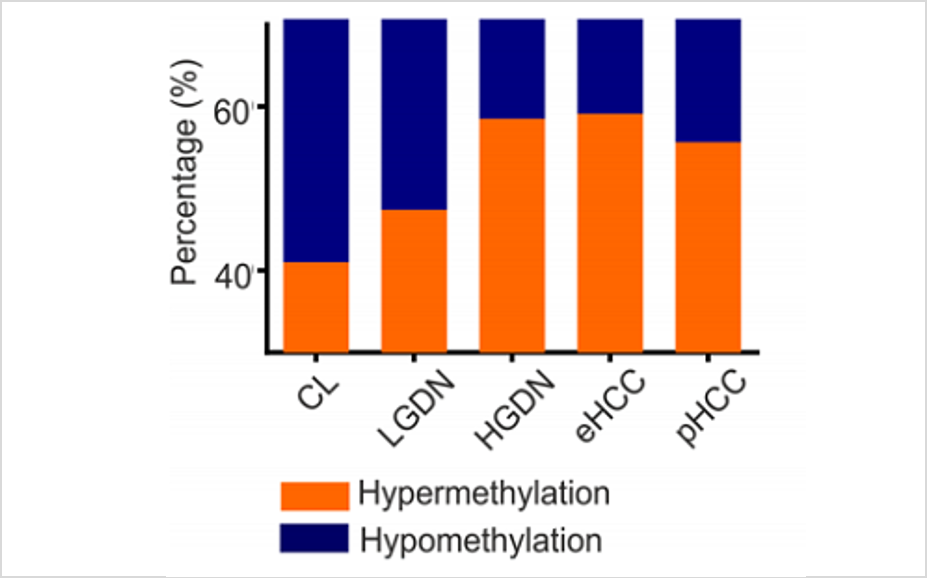

图1:HCC中DMGR(差异甲基化基因组区域)显著升高(左、中); 与对照组相比,低甲基化患者组的OS较短(右)
02 基于肝癌治疗疗效的生物标志物
随着医学技术的进步,肝癌的治疗进展迅速,包括手术切除(肝切除术和肝移植)、局部治疗和全身治疗以及联合治疗等方式。其中,免疫检查点抑制剂(ICI)和靶向治疗是治疗aHCC[6]的主要手段。
2.1 肝癌免疫治疗疗效生物标志物
肝癌免疫治疗主要分为两类:靶向免疫相关分子(即单克隆抗体)和细胞免疫治疗(免疫细胞如嵌合抗原受体T细胞,CAR-T)[7]。其中,免疫检查点封锁(ICB)治疗是目前应用最为广泛的免疫疗法。单次ICI、联合ICI、ICI联合抗血管生成治疗已逐渐成为aHCC患者[8]的主要治疗方法。因此,识别ICB治疗的潜在受益者已成为HCC临床研究的一个热点。PD-L1表达、肿瘤突变负荷(TMB)和微卫星不稳定性(MSI)是FDA批准的用于ICB治疗疗效预测的三种生物标志物。
2.1.1 PD-L1/PD-1
FDA已批准PD-L1表达检测用于实体瘤的ICB治疗诊断,包括膀胱癌、乳腺癌、宫颈癌、胃癌和非小细胞肺癌,但不包含肝癌(HCC)。在HCC临床研究中,PD-L1阴性表达的患者对ICIs也有较高的应答率[9]。最新对于索拉非尼辅助治疗肝癌的研究表明,PD-L1过表达可作为高复发风险肝细胞癌患者术后接受索拉非尼辅助治疗复发的独立预测因素。
2.1.2 TMB
TMB代表每兆碱基中DNA的突变数,TMB越高的患者可以产生更大的肿瘤新抗原负荷,并引起强烈的新抗原特异性T细胞反应,提示HCC患者ICB治疗获益越大。但是由于TMB缺乏统一的标准阈值,需与其他预测生物标志物结合共同预测HCC患者免疫治疗疗效。
2.1.3 MSI-H
MSI检测也有助于预测患者免疫治疗疗效,MSI-H的肿瘤患者有更好的免疫治疗结果。然而,与胃癌和结肠癌相比,HCC患者中MSI-H的患病率相对较低,这意味着伴有MSI-H的HCC患者太少,无法确定其预测准确性[10],这限制了MSI检测在肝癌免疫治疗中的应用。
2.1.4 TILs
肿瘤浸润性淋巴细胞 (Tumor Infiltrating Lymphocytes, TILs) 是指离开血液进入到肿瘤中的淋巴细胞,包括T细胞、B细胞、NK细胞,巨噬细胞等,是肿瘤微环境中的一大重要组成部分。肿瘤中免疫淋巴细胞的高度浸润能够显著增加肿瘤细胞免疫检查点受体表达,如PD-1、CTLA-4等,导致肿瘤患者对ICI治疗疗效更加敏感。因此,TILs在肿瘤及其微环境中浸润程度与分布可作为预测患者ICI治疗疗效的重要指标。其中,CD8+T细胞浸润是肝癌潜在的预后生物标志物,有研究证实,肿瘤中CD8+肿瘤浸润淋巴细胞(TILs)的比例较高提示患者OS更长[11]。
2.1.5 肠道微生物(肠道菌群)
肠道微生物群是人体内最重要的微生态系统,被称为人类的“第二基因组”。肠道微生物群组成在肝病恶性转化过程中发生相应的变化。健康受试者、HCC患者也可根据肠道微生物群谱进行区分。研究证实,不可切除的HCC患者的肠道微生物群与ICB治疗疗效相关[12](图2)。鉴于微生物相关多组学分析技术的快速发展,肠道微生物群作为肝癌免疫治疗疗效的预测生物标志物,具有极大的潜力。

图2:HCC患者肠道菌群丰富度与总体生存期的相关性
2.2 肝癌靶向治疗疗效生物标志物
目前,HCC靶向治疗主要是TKIs,包括VEGFR、EGFR、PDGFRα、MET抑制剂等。TKIs分为三组:多靶点TKIs(如列伐替尼、瑞格非尼、索拉非尼)、VEGFR拮抗剂(如阿帕替尼、阿西替尼)和VEGF/VEGFR单克隆抗体(如贝伐单抗、雷莫妥单抗)。尽管TKIs在临床试验中有明显的作用,但其耐药性和副作用也限制了它们在一些患者中的应用。我们总结了最近关于肝癌靶向治疗的潜在生物标志物的研究(图3),包括在临床和临床前研究中评估的靶点。
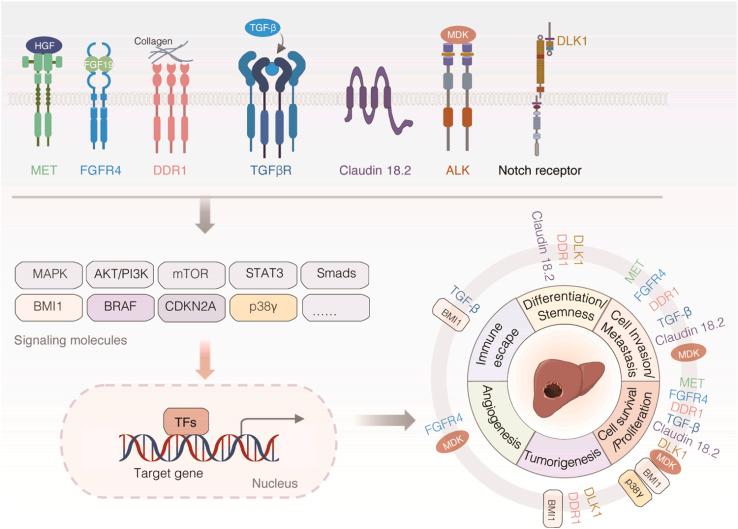
图3:肝癌靶向治疗的潜在生物标志物
2.2.1 MET
MET(HGFR)是受体酪氨酸激酶超家族的一个成员。MET与其配体HGF的结合激活了RAS-MAPK和PI3K-AKT信号,参与肿瘤的发生。MET靶向药物包括多靶点激酶抑制剂(如卡博赞替尼和克里唑替尼),选择性MET激酶抑制剂(如替万替尼和特泊替尼),以及一些单克隆药物。替万替尼和特泊替尼已被FDA批准用于肺癌治疗,并且两者都已在HCC中进行了研究。在一项II期临床试验中,与安慰剂相比,接受替万替尼二线治疗的aHCC患者的中位进展时间延长。特泊替尼是FDA批准的第一个口服MET抑制剂,在II期临床试验[13]中,作为索拉非尼预处理的MET过表达的aHCC患者的二线治疗选择,其安全有效性得到证实。
2.2.2 FGFR4
FGFR4在HCC等多种恶性肿瘤中大量表达,通过FGF19及其受体FGFR4进行的异常信号传导是HCC细胞生长和存活的关键驱动因子。因此,FGFR4靶向药物对HCC治疗具有很高的潜力。在一项使用FGFR4选择性小分子抑制剂BLU-554治疗aHCC的I期临床试验中,观察到17%的总缓解率和62%的疾病控制率[14](图4)。

图4
2.2.3 CLDN18.2
CLDN(Claudin )18.2高度选择性、稳定地表达于包含HCC等各种特定肿瘤组织,参与肿瘤细胞的增殖分化和迁移,使其成为潜在的抗肿瘤药物的有效分子靶点。目前,全球针对Claudin18.2为靶点的产品类型包括单克隆抗体、双特异性抗体、CAR-T 细胞疗法和ADC药物,由于其在肝癌组织的高表达,也可能作为HCC患者的潜在治疗靶点。
2.2.4 DDR1
DDR1(RTK盘状蛋白结构域受体1)作为新的潜在治疗靶点,在细胞分化、增殖、粘附、迁移和恶性转化中发挥重要作用。机制上,DDR1促进了肿瘤周围的物理屏障,防止T细胞浸润到肿瘤组织中,并有望作为一种免疫抑制因子,成为肿瘤免疫治疗[15]的新靶点。临床前研究表明,DDR1抑制剂在患者源性肝癌、乳腺癌、结肠直肠癌、胃癌和非小细胞肺癌[16]的小鼠异种移植模型中表现出强大的抗肿瘤活性。此外,DDR1靶向药物(ICP-033)治疗包括肝癌在内的实体肿瘤的临床试验正在进行中。
虽然近年来在肝癌治疗方面取得了显著进展,但患者的总体5年生存率并没有得到显著改善,这突出了探索可靠的生物标志物对改善肝癌治疗结果的重要性。我们期待着更特异性、更高效、更准确的用于肝癌诊断和治疗的生物标志物的出现,并开发出基于新型生物标志物的更安全、更有效的“广谱”疗法。
参考文献
[1] L. Ma, M.O. Hernandez, Y. Zhao, M. Mehta, B. Tran, M. Kelly, Z. Rae, J. M. Hernandez, J.L. Davis, S.P. Martin, D.E. Kleiner, S.M. Hewitt, K. Ylaya, B. J. Wood, T.F. Greten, X.W. Wang, Tumor cell biodiversity drives microenvironmental reprogramming in liver cancer, Cancer Cell 36 (2019) 418–430.e416, https://doi.org/10.1016/j.ccell.2019.08.007.
[2] J.C. Ahn, P.C. Teng, P.J. Chen, E. Posadas, H.R. Tseng, S.C. Lu, J.D. Yang, Detection of circulating tumor cells and their implications as a biomarker for diagnosis, prognostication, and therapeutic monitoring in hepatocellular carcinoma, Hepatology 73 (2021) 422–436, https://doi.org/10.1002/hep.31165.
[3] J.C. Ahn, P.C. Teng, P.J. Chen, E. Posadas, H.R. Tseng, S.C. Lu, J.D. Yang, Detection of circulating tumor cells and their implications as a biomarker for diagnosis, prognostication, and therapeutic monitoring in hepatocellular carcinoma, Hepatology 73 (2021) 422–436, https://doi.org/10.1002/hep.31165.
[4] C. Czauderna, A. Poplawski, C.J. O’Rourke, D. Castven, B. Perez-Aguilar, D. Becker, S. Heilmann-Heimbach, M. Odenthal, W. Amer, M. Schmiel, U. Drebber, H. Binder, D.A. Ridder, M. Schindeldecker, B.K. Straub, P.R. Galle, J. B. Andersen, S.S. Thorgeirsson, Y.N. Park, J.U. Marquardt, Epigenetic modifications precede molecular alterations and drive human hepatocarcinogenesis, JCI Insight 6 (2021), https://doi.org/10.1172/jci. insight.146196.
[5] O. Brunetti, A. Gnoni, A. Licchetta, V. Longo, A. Calabrese, A. Argentiero, S. Delcuratolo, A.G. Solimando, A. Casadei-Gardini, N. Silvestris, Predictive and prognostic Factors in HCC patients treated with sorafenib, Medicina 55 (2019),https://doi.org/10.3390/medicina55100707.
[6] M. Reig, L.G. da Fonseca, S. Faivre, New trials and results in systemic treatment of HCC, J. Hepatol. 69 (2018) 525–533, https://doi.org/10.1016/j. jhep.2018.03.028.
[7] B. Ruf, B. Heinrich, T.F. Greten, Immunobiology and immunotherapy of HCC: spotlight on innate and innate-like immune cells, Cell Mol. Immunol. 18 (2021)112–127, https://doi.org/10.1038/s41423-020-00572-w.
[8] U. Harkus, M. Wankell, P. Palamuthusingam, C. McFarlane, L. Hebbard, Immune checkpoint inhibitors in HCC: cellular, molecular and systemic data, Semin. Cancer Biol. 86 (2022) 799–815, https://doi.org/10.1016/j.
[9] A.B. El-Khoueiry, B. Sangro, T. Yau, T.S. Crocenzi, M. Kudo, C. Hsu, T.-Y. Kim, S.-P. Choo, J. Trojan, T.H. Welling, T. Meyer, Y.-K. Kang, W. Yeo, A. Chopra, J. Anderson, C. dela Cruz, L. Lang, J. Neely, H. Tang, H.B. Dastani, I. Melero, Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial, Lancet 389 (2017) 2492–2502, https://doi.org/10.1016/s0140-6736(17) 31046-2.
[10] T. Terashima, Microsatellite instability-high in Japanese patients with hepatocellular carcinoma, Hepatol. Res. 50 (2020) 773–774, https://doi.org/ 10.1111/hepr.13534.
[11] W. Ding, X. Xu, Y. Qian, W. Xue, Y. Wang, J. Du, L. Jin, Y. Tan, Prognostic value of tumor-infiltrating lymphocytes in hepatocellular carcinoma: a meta-analysis, Medicine 97 (2018), e13301, https://doi.org/10.1097/MD.0000000000013301.
[12] P.C. Lee, C.J. Wu, Y.W. Hung, C.J. Lee, C.T. Chi, I.C. Lee, K. Yu-Lun, S.H. Chou, J. C. Luo, M.C. Hou, Y.H. Huang, Gut microbiota and metabolites associate with outcomes of immune checkpoint inhibitor-treated unresectable hepatocellular carcinoma, J. Immunother. Cancer 10 (2022), https://doi.org/10.1136/jitc-2022-004779.
[13] T. Decaens, C. Barone, E. Assenat, M. Wermke, A. Fasolo, P. Merle, J.F. Blanc, V. Grando, A. Iacobellis, E. Villa, J. Trojan, J. Straub, R. Bruns, K. Berghoff, J. Scheele, E. Raymond, S. Faivre, Phase 1b/2 trial of tepotinib in sorafenib pretreated advanced hepatocellular carcinoma with MET overexpression, Br. J.Cancer 125 (2021) 190–199, https://doi.org/10.1038/s41416-021-01334-9.
[14] R.D. Kim, D. Sarker, T. Meyer, T. Yau, T. Macarulla, J.W. Park, S.P. Choo, A. Hollebecque, M.W. Sung, H.Y. Lim, V. Mazzaferro, J. Trojan, A.X. Zhu, J. H. Yoon, S. Sharma, Z.Z. Lin, S.L. Chan, S. Faivre, L.G. Feun, C.J. Yen, J.F. Dufour, D.H. Palmer, J.M. Llovet, M. Manoogian, M. Tugnait, N. Stransky, M. Hagel, N. E. Kohl, C. Lengauer, C.A. Sherwin, O. Schmidt-Kittler, K.P. Hoeflich, H. Shi, B. B. Wolf, Y.K. Kang, First-in-human phase I study of fisogatinib (BLU-554) validates aberrant FGF19 signaling as a driver event in hepatocellular carcinoma,Cancer Discov. 9 (2019) 1696–1707, https://doi.org/10.1158/2159-8290.CD-19-0555.
[15] X. Sun, B. Wu, H.C. Chiang, H. Deng, X. Zhang, W. Xiong, J. Liu, A.M. Rozeboom, B.T. Harris, E. Blommaert, A. Gomez, R.E. Garcia, Y. Zhou, P. Mitra, M. Prevost, D. Zhang, D. Banik, C. Isaacs, D. Berry, C. Lai, K. Chaldekas, P.S. Latham, C. A. Brantner, A. Popratiloff, V.X. Jin, N. Zhang, Y. Hu, M.A. Pujana, T.J. Curiel, Z. An, R. Li, Tumour DDR1 promotes collagen fibre alignment to instigate immune exclusion, Nature 599 (2021) 673–678, https://doi.org/10.1038/s41586-021-04057-2.
[16] A. Elkamhawy, Q. Lu, H. Nada, J. Woo, G. Quan, K. Lee, The journey of DDR1 and DDR2 kinase inhibitors as rising stars in the fight against cancer, Int. J. Mol. Sci. 22 (2021) 6535, https://doi.org/10.3390/ijms22126535.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











