JCO:Pegilodecakin+FOLFOX二线治疗未能改善吉西他滨难治性转移性胰腺癌的疗效
2021-02-09 MedSci原创 MedSci原创
Pegilodecakin(PEG)联合亚叶酸钙、氟尿嘧啶和奥沙利铂(FOLFOX)二线治疗吉西他滨难治性转移性胰腺导管腺癌(PDAC),未能改善其OS、PFS或ORR,也没有观察到新的安全信号。
Pegilodecakin(PEG)联合亚叶酸钙、氟尿嘧啶和奥沙利铂(FOLFOX)二线治疗吉西他滨难治性转移性胰腺癌(PDAC),未能改善其OS、PFS或ORR,也没有观察到新的安全信号。但FOLFOX探索性的药效学结果与IL-10R途径的免疫刺激信号一致,IFN-γ、颗粒酶B和IL-18与PEG + FOLFOX方案相比未见明显增加。
2月8日,Journal of Clinical Oncology在线发布该研究的Ⅲ期研究结果。这项全球性的Ⅲ期随机研究旨在检测OS和评估安全性。
该研究在2017年3月1日至2019年9月9日之间,随机为567名患者分配PEG + FOLFOX(n = 283)或FOLFOX(n = 284)。94.7%患者接受过吉西他滨联合nab紫杉醇治疗。两组之间的所有基线疾病特征均保持良好平衡。

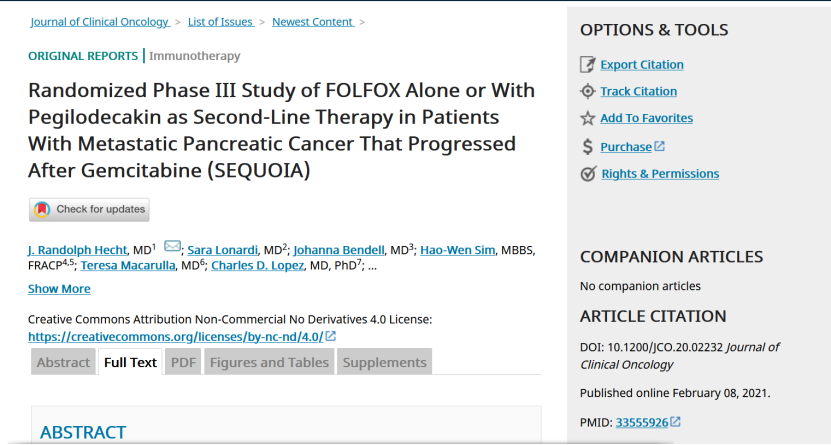
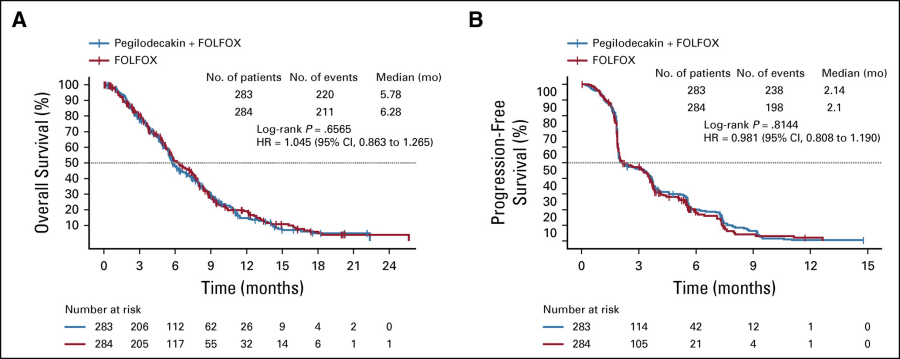
使用2019年9月9日的截止日期对最终OS进行了分析。PEG + FOLFOX组的中位随访时间为15.0个月,而FOLFOX组的中位随访时间为14.5个月。PEG + FOLFOX(5.8个月)和FOLFOX(6.3个月)的OS中位数相似,HR = 1.045(95%CI,0.863-1.265),根据Kaplan-Meier分析,在1年时的估计OS率为14.7%。 PEG + FOLFOX组和FOLFOX组的19.1%。
使用2019年9月9日的截止日期对最终OS进行了分析。PEG + FOLFOX组的中位随访时间为15.0个月,而FOLFOX组的中位随访时间为14.5个月。PEG + FOLFOX(5.8个月)和FOLFOX(6.3个月)的OS中位数相似,HR = 1.045(95%CI,0.863-1.265),根据Kaplan-Meier分析,在1年时的估计OS率为14.7%。 PEG + FOLFOX组和FOLFOX组的19.1%。
两组中位PFS均为2.1个月,也无显著差异(HR = 0.918;95%CI,0.808-1.190)。
两组ORR(4.6% v 5.6%)也无显著差异。在任一治疗组中均未观察到CR。两组之间的反应持续时间和反应时间相似。
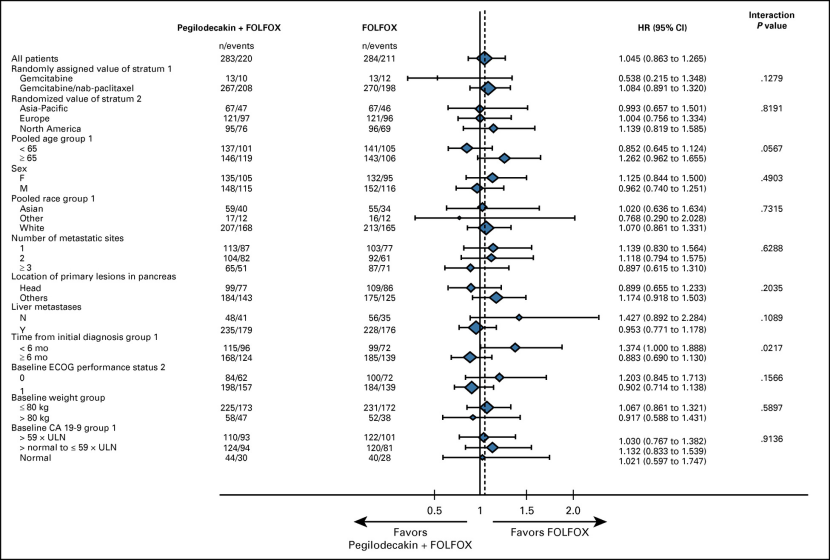
PEG + FOLFOX与FOLFOX相比,最常见的治疗相关不良事件为血小板减少症(55%v 20%),贫血(40%v 16%),疲劳(61%v 45%),中性粒细胞减少症(39%v28%),腹痛(37%v 29%),恶心(45%v 41%),神经病(37%v 38%)和食欲下降(35%v 31%)。74.5%(394/529)患者发生3级甚至以上的TEAE。与FOLFOX相比,PEG + FOLFOX较常见不良事件主要是的是血小板减少症、贫血(、中性粒细胞减少症和疲劳。PEG + FOLFOX的组合显示出与先前在Ⅰ期研究(IVY)中PDAC患者中PEG和FOLFOX组合所观察到的安全性一致的安全性。然而,与单独使用FOLFOX相比,联合治疗的总体毒性更高。
探索性分析显示,FOLFOX和PEG + FOLFOX之间的细胞因子水平相当。PEG + FOLFOX在C1D13,C2D13和C4D13处的颗粒酶B,IFNγ和IL-18均比基线有所增加,而FOLFOX则未观察到这种变化。
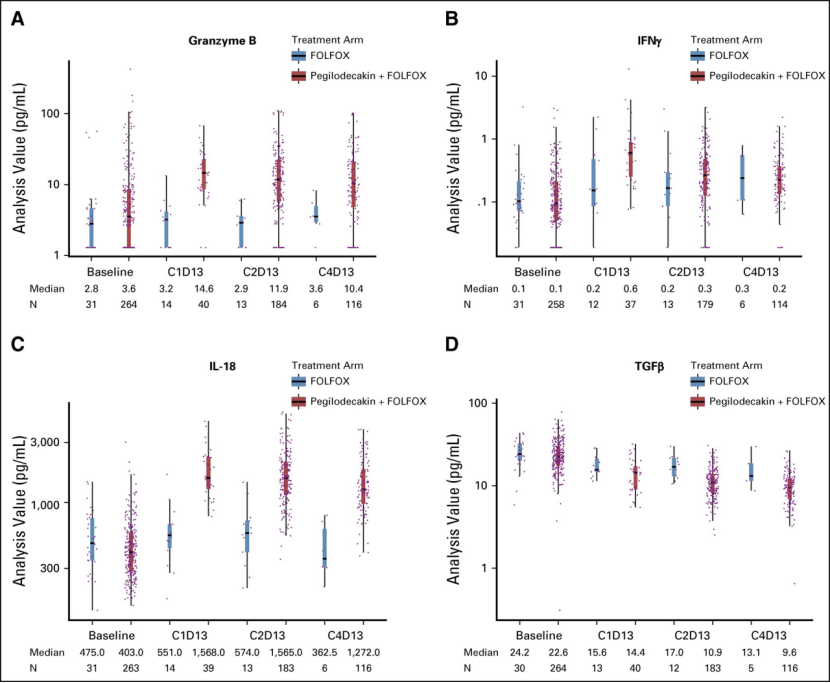
二线吉西他滨难治性转移性PDAC的治疗选择进展仍然不佳。加入FOLFOX的PEG不能改善晚期吉西他滨难治性PDAC的疗效。安全性研究结果与先前在PEG化疗中观察到的结果一致,毒性是可控和可忍受的。FOLFOX探索性的药效学结果与IL-10R途径的免疫刺激信号一致。
综上所述,尽管使用PEG + FOLFOX进行IVY的I期研究的安全性和有效性数据令人鼓舞,但在这项大型的随机III期试验中,SEQUOIA的结果并未显示OS,PFS或ORR有所改善。
Reference:
J. Randolph Hecht, Sara Lonardi, Johanna Bendell,et al. Randomized Phase III Study of FOLFOX Alone or With Pegilodecakin as Second-Line Therapy in Patients With Metastatic Pancreatic Cancer That Progressed After Gemcitabine (SEQUOIA). published on February 8, 2021. DOI:10.1200/JCO.20.02232 Journal of Clinical Oncology.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#JCO#
42
#PE#
27
#Pegilodecakin#
41
#AKI#
38
#转移性#
22
#转移性胰腺癌#
32
#FOLFOX#
26
#难治性#
28
#PEG#
35
#二线治疗#
38