Cancer Res:看见肿瘤转移
2014-07-01 韩北北 肿瘤新青年论坛
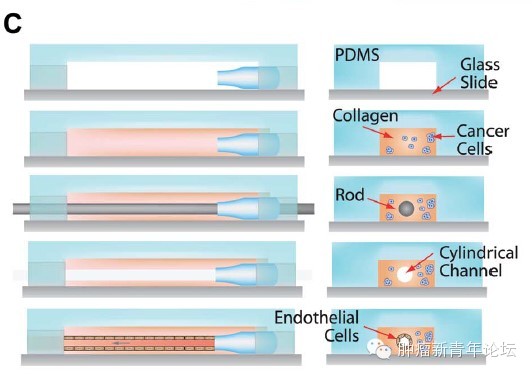
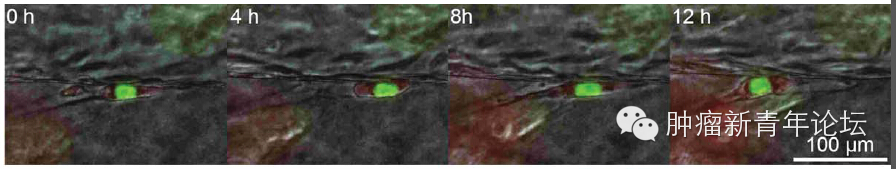
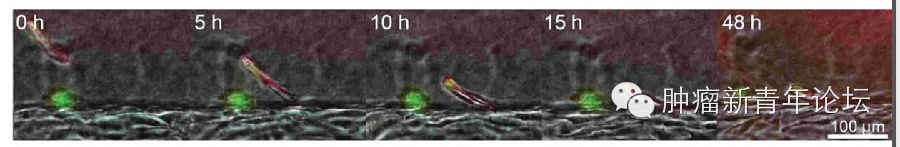
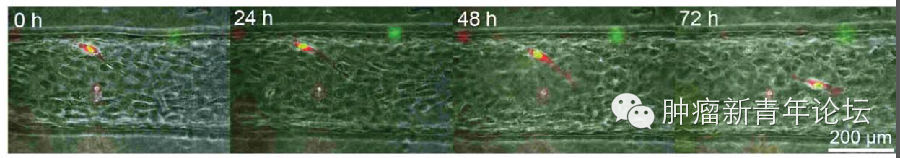
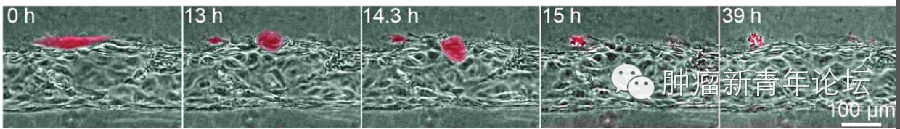
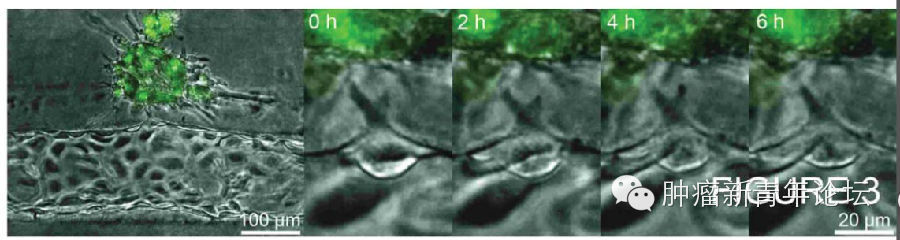
研究者首先倒腾出了一个道具(如下图),在聚二甲硅氧烷(polydimethylsiloxane,PDMS)支架里,灌注一层I型胶原,由于预先在中间放置圆柱形的模具,因此将模具抽出后将获得一个管状通道。在管状通道内表面铺上血管内皮细胞,在I型胶原基质里埋进肿瘤细胞,就大功告成啦。 忍不住秀下这个酷炫的道具,看下图,可以看到I型胶原基质中的HT-1080纤维肉瘤细胞似乎已经向血管壁伸出了欲望
研究者首先倒腾出了一个道具(如下图),在聚二甲硅氧烷(polydimethylsiloxane,PDMS)支架里,灌注一层I型胶原,由于预先在中间放置圆柱形的模具,因此将模具抽出后将获得一个管状通道。在管状通道内表面铺上血管内皮细胞,在I型胶原基质里埋进肿瘤细胞,就大功告成啦。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肿瘤转移#
32