导读:肝细胞癌(HCC)是最常见的原发性肝癌类型,是全球日益严重的公共卫生问题。HCC的主要遗传改变之一是Wnt/β-连环蛋白信号传导的失调,β-连环蛋白的激活与肝细胞癌的进展有关。
近日,中南大学湘雅医院周乐杜等在《Cell Death & Disease》上发表题为“USP8 positively regulates hepatocellular carcinoma tumorigenesis and confers ferroptosis resistance through β-catenin stabilization”的研究论文,研究表明,USP8通过β-连环蛋白的翻译后机制激活了Wnt/β-连环蛋白信号传导,USP8的高表达促进HCC的进展并抑制铁死亡。靶向USP8可能是肝癌患者的有希望的策略。

https://www.nature.com/articles/s41419-023-05747-7
研究背景
01
肝细胞癌是一种侵袭性和毒性实体瘤,参与HCC发生和进展的潜在分子机制在很大程度上仍不清楚。寻找更多新的候选靶点并改善治疗策略是一个紧迫的问题。泛素化是最重要的翻译后修饰之一,它对细胞稳态至关重要,在细胞蛋白降解机制中起核心作用。泛素化涉及由三种酶介导的泛素分子的顺序转移:泛素激活酶(E1)、泛素偶联酶(E2)和泛素连接酶(E3)。E3泛素连接酶选择性介导底物的泛素偶联,可通过去泛素化酶逆转。E3连接酶或去泛素化酶的失调在各种人类癌症中经常观察到。然而,DUB在HCC中的潜在作用尚未得到充分确定。
研究进展
USP8 是一种 DUB,属于泛素特异性加工(USP)蛋白酶家族。USP8的表达经常在多种癌症类型中过表达,包括肺癌、乳腺癌、胆管癌、胃癌和黑色素瘤。USP8被确定为肿瘤中的增殖和转移增强剂。在本研究中,我们将USP8确定为一种有效的DUB药物,可以去泛素化和稳定HCC中的β-连环蛋白。
首先,USP8和β-连环蛋白相互作用。协同IP分析确定了USP8和β-连环蛋白之间的相互作用。其次,USP8减少了β-连环蛋白多泛素化,并以取决于其DUB活性的方式促进β-连环蛋白的稳定。USP8的缺失显著降低了β-连环蛋白的蛋白丰度,USP8-WT的异位表达可以恢复β-连环蛋白丰度的降低,但不能恢复其催化无活性突变体USP8C786A.在蛋白酶体抑制剂MG132的处理下,USP8缺失不能进一步影响β-连环蛋白水平。USP8耗竭缩短了β-连环蛋白的半衰期。USP8-WT的异位表达,但USP8的异位表达C786A,显着降低β-连环蛋白的泛素化。体内去泛素化试验表明,USP8可以剂量依赖性方式直接去除β-连环蛋白上的泛素链。为了进一步找出USP8去除了β-连环蛋白上哪种类型的泛素链,我们使用一系列泛素突变体进行了泛素化测定,包括K6,K11,K27,K29,K33,K48和K63。我们观察到USP8显著降低了β-连环蛋白的K48连接的多泛素化。由于通过Ub的K48进行多泛素化通常会导致蛋白酶体降解,USP8可以通过从β-连环蛋白中去除K48连接的泛素链来维持β-连环素的稳定性。最后,USP8可以通过β连环蛋白促进HCC的肿瘤增殖、侵袭和茎样特性。敲低USP8显著抑制肿瘤增殖,侵袭和茎样特性。此外,β-连环蛋白表达的恢复消除了USP8耗竭诱导的影响。我们进一步检查了USP3的小分子抑制剂DUB-IN-8,以验证我们的发现。正如预期的那样,DUB-IN-3处理以剂量依赖性方式抑制HCC细胞增殖,侵袭和干细胞样特性。相应地,DUB-IN-3处理降低了β-连环蛋白丰度,降低了β-连环蛋白的多泛素化。CHX分析表明,DUB-IN-3处理后β-连环蛋白的半衰期显著缩短,表明DUB-IN-3与USP8耗竭一样,促进β-连环蛋白泛素化和降解。
最近的一项研究表明,Wnt/β-连环蛋白信号通路通过上调GPX4的表达来减弱细胞脂质过氧化水平,从而抑制铁死亡。在本研究中,我们观察到USP8的抑制促进了HCC细胞的铁死亡。进一步的机制分析表明,USP8稳定β-连环蛋白,USP8的耗竭降低了GPX4的蛋白水平,表明USP8可能通过Wnt/β-连环蛋白/GPX4轴参与铁死亡。
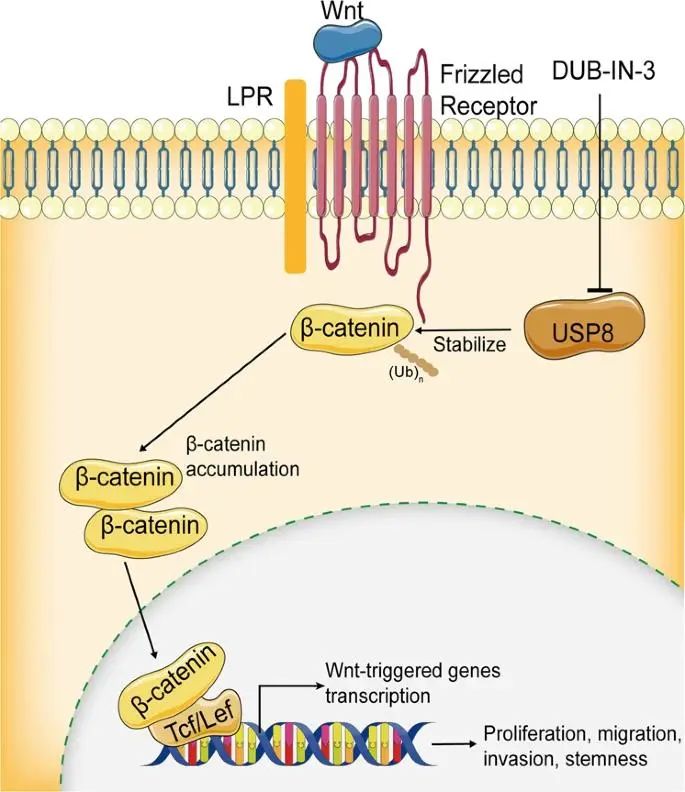
机制图。USP8 是一种β连环蛋白 DUB,可稳定β连环蛋白并通过其去泛素化活性促进肿瘤生长、侵袭、肿瘤干样特性和铁死亡抵抗力。
总之,我们证明了USP8是一种β连环蛋白DUB可稳定β连环蛋白并通过其去泛素化活性促进肿瘤生长,侵袭,肿瘤干细胞样特性和铁死亡抵抗力。我们的研究结果为USP8在Wnt/β-连环蛋白信号通路中的作用提供了新的见解,并揭示了利用USP8抑制剂进行HCC治疗的潜在治疗策略。
参考资料:
https://www.nature.com/articles/s41419-023-05747-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#湘雅医院##周乐杜#团队发现靶向#USP8#可能抑制#肝癌#的进展,#铁死亡##靶点# 不过,此前也有研究发现,USP8 抑制通过提高 TRAF6 介导的 K63 连接的 PD-L1 #泛素化#以拮抗 K48 连接的泛素化和 #PD-L1# 降解来增加 PD-L1 蛋白丰度。此外,USP8 抑制还主要通过激活 NF-κB 信号传导来触发先天免疫反应和 MHC-I 表达。基于这些机制,USP8 抑制剂联合 PD-1/PD-L1 阻断剂可显著激活浸润的 CD8+ T 细胞以抑制肿瘤生长,并提高几种小鼠肿瘤模型的生存获益。因此,该研究揭示了一种潜在的联合治疗策略,即利用 USP8 抑制剂和 PD-1/PD-L1 阻断剂来增强抗肿瘤功效。 #抑制去泛素酶# USP8 通过重塑炎症#肿瘤微环境# (TME) 显著提高抗 #PD-1/PD-L1# 免疫疗法的功效。 因此,USP8可能会成为一个新靶点的可能。
82