CGP新进展|心血管疾病与心理疾病流行病学及相关机制研究
2024-01-09 中国全科医学杂志 中国全科医学杂志 发表于陕西省
本文通过全面检索国内外近5年有关心理疾病和心脏疾病的相关文章,整合了该方向的前沿进展及重点研究成果,并从机制入手总结了心血管疾病造成心理疾病、心理疾病造成心脏疾病的两方面主要内容。
本文来源
张瑾怡,张世忠. 心血管疾病与心理疾病流行病学及相关机制研究新进展[J]. 中国全科医学, 2024, 27(08): 893-899.
随着“生物医学模式”向“生物-心理-社会医学模式”的转变,心血管疾病与心身的关系越来越受到重视。《中国心血管健康与疾病报告2022》指出,中国心血管疾病负担持续加重,每5例死亡病例中就有2例死于心血管疾病,心血管疾病的防治工作依旧任重道远。同时,WHO统计数据显示,全球约10亿人正在遭受精神心理障碍困扰,而中国心理疾病患病率高达17%。因此,研究心理疾患与心血管疾病的相关性,人的情绪与心血管系统之间的深层联系,以及控制这些心理疾患对心血管疾病转归的影响已成为世界公共卫生学者关注的重点方向。
本文通过全面检索国内外近5年有关心理疾病和心脏疾病的相关文章,整合了该方向的前沿进展及重点研究成果,并从机制入手总结了心血管疾病造成心理疾病、心理疾病造成心脏疾病的两方面主要内容,旨在为双心医学的交融发展提供更多参考,精彩内容敬请浏览全文!
01 心血管疾病与心理疾病之间的流行病学研究
1.1 心肌缺血与心理疾病
1.1.1 不良情绪和认知障碍会诱发缺血性心肌病:
缺血性心肌病是指由于长期心肌缺血导致心肌局限性或弥漫性纤维化,从而造成心脏收缩和舒张功能受损,也是导致心血管疾病发病率和死亡率的重要因素。Obraztsov和Strazhesko于1910年首次观察到负面情绪对冠状动脉血栓形成有一定影响,他们也首次将情绪触发因素纳入急性心肌梗死的发病机制。随后有大量的研究者把目光转向了心理与心脏,大量文献表明不良情绪和心血管疾病之间密不可分的交联关系。抑郁症和焦虑症已经被证明是心血管疾病的重要驱动因素,影响其发生和预后。
根据国家健康保险研究数据库统计分析显示,焦虑和抑郁情绪会增加老年人缺血性心脏病的死亡风险。抑郁症患者的缺血性心脏病的发生率是普通人群的2~3倍,且重度抑郁症的患者发生缺血性心脏病的概率比正常患者高32%。
精神应激诱发的心肌缺血是心血管疾病患者的常见现象之一,且心理社会的应激原可能是促成日常心绞痛的重要原因。抑郁症的严重程度和心绞痛发生的次数有显著相关性。一项临床研究表明,在日常生活中压力所产生的不良情绪例如愤怒和敌意,和心脏病患者的心脏缺血有着高度的相关性。具有愤怒这种心理特征的患者会增加因情绪压力引起的无症状缺血风险,以及导致更差的预后。利用国家卫生研究所数据库抽取随机样本进行统计分析,双相情感障碍患者的缺血性心脏病患病率和发病率也显著高于一般人群,尤其是年轻人群。
此外,慢性的社会心理压力已被证明会损伤正常血压的大鼠心脏的机械功能,加重心肌缺血再灌注后诱发的心律失常。持续的社会心理压力也会增加心血管疾病的发生风险,造成心外膜或微血管收缩,从而引起局部性缺血性损伤,此外患有创伤后应激障碍(PTSD)的雄性大鼠,对心肌缺血会展现超高的敏感性。
1.1.2 缺血性心肌病会导致认知障碍和抑郁症:
心血管疾病也会引发一定的心理疾病。德国神经病学家Robert Gaupp在1905年就提出了老年人动脉粥样硬化会引发抑郁症的观点。一方面是由于心血管疾病降低了患者的生活质量,患者受到病理性疼痛、经济等方面等压力,会让其长期处于焦虑、抑郁等不良情绪中。另一方面,心脏收缩功能障碍减少了脑部血流,脑细胞缺血缺氧会引起一系列的脑部损伤,包括能量代谢障碍、炎症反应、脑细胞损伤和树突棘减少等,造成认知功能下降;由于缺血性心脏病的后期一般伴随血液的再灌注,发生再灌注时,氧化应激反应和钙超载等可造成心肌进一步损伤,相关文献表明,心肌缺血再灌注损伤会诱发认知功能障碍,如大鼠经历了40min缺血再灌注后,其认知功能明显下降,再灌注16周之后被确定为认知障碍和抑郁症。研究者通过位置记忆任务和情景恐惧条件反射的测定,表明缺血再灌注可明显降低大鼠学习能力和记忆力。心肌梗死患者在认知的多个领域出现了损伤,例如通过延迟单词回忆测试表明记忆功能的下降,注意力和处理速度也受到损伤。
1.2 心肌梗死与心理疾病
1.2.1 心肌梗死和不良情绪具有显著相关性:
有研究对抑郁症基因和心肌梗死基因进行了相关性分析,结果表明抑郁症的遗传易感性和心肌梗死有显著相关性。与健康对照组相比,心肌梗死和非阻塞性冠状动脉患者在焦虑和抑郁分量表上得分更高。
在心肌梗死患者中,超过2/3在心肌梗死的第1个月内伴随抑郁和焦虑合并症,且与心肌梗死患者入院时相比,患者抗抑郁药物的使用频率在12个月内几乎翻了1倍,表明随着心肌梗死疾病的发生和发展,会对患者造成更多的抑郁情绪。此外,心肌梗死患者的抑郁和死亡焦虑也随着年龄的增长而增加。
除此之外,心肌梗死患者的死亡焦虑水平高于癌症患者,因为其面临不确定性的猝死的风险。同时也有研究表明,在心肌梗死后对患者进行运动性的心脏康复可以减轻焦虑和抑郁症状。
目前大多数相关研究是基于外国的患者人群,而我国研究者GU等在2019年发布的以我国心肌梗死患者为基础的相关研究表明,抑郁症在中国心肌梗死患者中很常见,且抑郁症会增加心肌梗死患者全球死亡率和心血管事件的风险。抑郁症可能会降低个人对医疗和康复计划的依从性。此外,抑郁症与不健康的行为相关,例如吸烟、高脂肪饮食、缺乏体育锻炼和社会关系中断。这些不健康的行为可能是与抑郁症相关的心理机制。
1.2.2 心肌梗死会损伤认知功能:
有研究表明,患有心肌梗死的患者在认知的多个领域出现了损伤,例如延迟单词回忆测试表明患者记忆功能的下降,注意力和处理速度也受到损伤。认知能力下降最常见的原因为心脏收缩功能障碍导致脑部血液灌注减少。相关研究使用各种认知功能测试,包括逆转测试、莫里斯水迷宫(MWM)测试和新物体识别(NOR)测试来检测心肌梗死大鼠的认知功能。结果表明空间学习能力、短时记忆有明显降低。发生心肌梗死后,患者因为心肌缺血坏死会向着心力衰竭发展。心力衰竭是老年人群最常见的心血管疾病,其与神经认知功能下降有关,心力衰竭和神经认知障碍与反复住院和老年人死亡率增加有关。
02 心血管疾病影响心理疾病的相关机制
2.1 脑部缺血性损伤
心脏舒缩功能的下降使机体循环血量发生改变,造成脑部血流灌注量降低,营养物质、氧气含量减少,从而对脑细胞以及神经元造成损伤。有相关研究表明,心力衰竭的患者的脑部血流量降低了约30%,且主要的降低区域在颞叶、顶叶和枕叶区域,丘脑以及海马和杏仁核,从而损伤患者的认知功能。
循环血流下降时,会使肾脏的灌流量减少,促进肾小球旁器的球旁细胞分泌肾素,肾素进入血液后,会刺激肝脏生成血管紧张素原(AGT),随后受肾素酶催化成为血管紧张素Ⅰ,其随血液流经肺循环时,受肺所分泌的血管紧张素转化酶(ACE)作用,被水解为血管紧张素Ⅱ(Ang-Ⅱ)。Ang-Ⅱ是一种强缩血管物质,能使全身小动脉收缩从而升高血压,因此脑部血管也会随之收缩,造成脑部供血不足,严重时会引起脑栓塞。
除此之外,Ang-Ⅱ可以诱导血管周围巨噬细胞的激活,从而使一氧化氮酶、NADPH氧化酶等多种酶被激活以促进活性氧(ROS)的过量产生,例如超氧化物、一氧化氮(NO)等,其会对细胞分子产生氧化损伤,且Ang-Ⅱ被发现可刺激缺氧诱导的线粒体活性氧(mtROS)的产生,从而抑制线粒体呼吸链并降低ATP的能量。同时,Ang-Ⅱ和血管紧张素受体1(AT1)结合后会激活鸟苷酸结合的调节蛋白,从而激活细胞膜上的磷脂酶C去水解二磷酸磷脂肌醇,产生三磷酸肌醇(IP3)和二酰基甘油,其中IP3会与脑细胞内质网上的IP3受体结合,使内质网释放Ca2+。二酰基甘油会进一步激活蛋白激酶C,增加脑细胞内外的Na+-H+交换,从而促进Ca2+-Na+交换,共同使脑细胞内形成钙超载。
虽然在缺血早期,机体血液重新分布收缩外周血管,优先保证大脑的血流供应,但在进一步发展后,早期的应激反应失调,脑组织会出现一系列的缺血性损伤。由于黄嘌呤氧化酶系统被激活、中性粒细胞的聚集和激活以及儿茶酚胺发生自氧化,会形成大量自由基例如过氧化氢、超氧阴离子等,氧自由基会对脑细胞的线粒体膜以及细胞膜造成损伤,线粒体膜受损后会引起三羧酸循环障碍,线粒体功能受损,不能将氧气充分利用从而增加ROS的形成。而这些ROS会使脑细胞膜受损,通透性增加,从而使Ca2+内流,造成钙超载。此外膜磷脂还将被分解成更多的ROS和生物活性物质例如血栓素A2和前列腺素等,严重时ROS还会造成核酸及染色体的破坏,引起染色体畸变和核酸的改变。
脑细胞膜受损后会更加利于Ca2+的内流,且在应激状态时,内源性的儿茶酚胺含量增多,会激活肌质网释放Ca2+同时激活L型的Ca2+通道,使Ca2+内流。细胞内Ca2+浓度升高后会激活磷脂酶,导致细胞膜磷脂被降解造成脑细胞的结构损伤。此外Ca2+还会与含有磷酸根的化合物结合形成不溶性的磷酸钙,造成线粒体损伤。一些钙依赖性的蛋白酶也会被激活例如黄嘌呤氧化酶,形成更多的氧自由基,加重酸中毒,见图1。
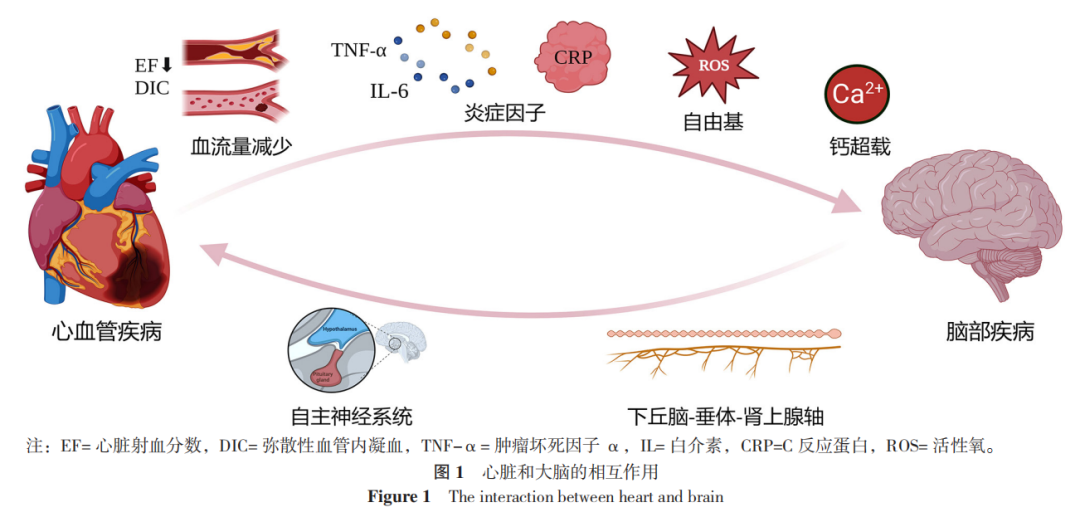
此外,在脑缺血缺氧时造成的能量代谢障碍会直接抑制细胞膜上Na+-K+-ATP酶的活性,使胞外K+浓度显著增高,脑部神经元去极化,一些兴奋性的氨基酸例如谷氨酸和天冬氨酸在突触间隙被大量释放,使突触后神经元过度兴奋并最终死亡。
脑部神经损伤包括神经元萎缩、突触损失、树突棘减少等,而脑细胞的损伤和很多精神和神经行为问题有关,轻度脑损伤和一系列的不良情绪和PTSD有关,严重的脑损伤甚至会造成自杀、重度抑郁症等恶性心理疾病。因此,心血管疾病一定程度上会造成心理疾病。
2.2 炎症反应
心肌在受到损伤时,会发生心脏局部的炎症反应而后造成全身的炎症反应,且促炎因子的水平会随着心力衰竭的恶化而增加。机体常见的炎症反应包括急性期蛋白的释放、促炎因子的生成等。目前C反应蛋白(CRP)是心血管风险分层的首选炎症生物标志物,相关研究表明,CRP的释放与心血管疾病的发生发展有着紧密联系。CRP水平升高已被证明是抑郁症和心血管疾病的风险标志,CRP可以通过促进炎症发生、调节固有免疫应答、促进血栓形成以及血管的重塑等方式来影响心血管疾病的发生发展。有研究表明,在心肌的受损区域的边缘位置,会有巨噬细胞的浸润,心肌缺血会激活巨噬细胞上的单体CRP(mCRP)的表达。在急性心肌梗死后1周内,心脏的mCRP表达持续升高。mCRP可以通过激活白细胞上的整合素而从促进白细胞黏附的作用,介导白细胞的聚集从而放大心脏受损所引起的炎症反应。
研究表明,大量的精神分裂患者会表现出免疫反应性增强,从而导致小胶质细胞损伤、炎症因子水平增高甚至脑炎,在精神分裂症的不同阶段表现出CRP水平升高。此外,外周的炎症和双相情感障碍患者的认知能力和情绪处理有相关性,且CRP和个体情绪的抑制性有关联。一项对于南非成年人研究表明,心理困扰和CRP的水平升高有关。
此外,炎症发生时,促炎因子也会大量释放,如肿瘤坏死因子α(TNF-α)等。而脑部的小胶质细胞对炎症因子有很强的反应性,其形态和活性会随着心肌梗死的发展时间而改变,其过度活化可以诱导神经元中促炎因子的产生。TNF-α作为重要的炎症因子,可以直接刺激下丘脑-垂体-肾上腺轴(HPA),同时促进5-羟色胺的前体色氨酸的分解代谢来影响脑部的学习记忆功能与情绪反应。此外,TNF-α还可以刺激鞘氨醇-1-磷酸(S1P)的生成,S1P也是重要的生物活性递质,参与神经元的死亡的调控。
这些由心脏损伤所引起的炎症反应,会通过体液的循环影响大脑,并且激活脑部的炎症反应,影响大脑的中枢神经系统功能。尤其是大脑的前纹状体抑制神经回路,这些区域的神经胶质受体密度高,非常容易受到炎症因子的影响。
03 心理疾病影响心血管疾病的相关机制
3.1 自主神经系统
心理疾病可通过自主神经系统对心脏产生影响。自主神经系统是外周传出神经的一部分,能够调节内脏、血管平滑肌、心脏和腺体的活动,且通过交感神经和副交感神经来维持机体基本的生理过程。根据心脏解剖学,心脏上具有交感神经和副交感神经的神经纤维,且心脏内在自主神经系统包含200~1000个神经元的神经节。这些神经节形成了一个复杂的神经网络,且神经节丛受到肾上腺素的支配。其中交感神经纤维位于心房和心室,对前室壁和后室壁产生主要影响,副交感神经主要由交感神经携带,突触位于心房、心室壁的心外膜脂肪的神经节内。
多项研究表明,心脏疾病的发生通常与交感神经的活动增加和副交感神经的反应性下降有关,且这一复杂的系统失调会造成心脏疾病的发病和死亡。有相关研究证明,交感神经和副交感神经参与了心房颤动的发生,且电刺激可以支配心脏的自主神经诱发心房颤动。交感神经还可以通过促进钙超载来诱发心律失常,被激活的肾上腺素可以增加钙进入突触前神经元,此外,迷走神经也会诱发心律失常,且这些作用可能是由于迷走神经释放的血管活性多肽介导的,其可以增强延迟的钾离子电流并降低Na+电流,从而有助于影响迷走神经对心房的动作电位持续时间并增加房颤倾向。有研究表明,在1517例阵发性心房颤动患者中,有33%患者的心房颤动受到自主神经调节的影响。
调节心脏功能的交感神经主要位于大脑的星状神经细胞,当其接收到刺激信号时,可以直接或者通过锁骨下的神经节传出信号到心脏。与此同时,这些传入神经还能通过释放各种神经肽例如去甲肾上腺素和乙酰胆碱来参与心脏的局部炎症反应和血管反应。研究发现精神分裂症患者的双心室舒张末期、收缩末期和每搏量指数显著降低,室间隔厚度增加。
3.2 下丘脑-垂体-肾上腺(HPA)轴
情绪的调控通常与大脑中的下丘脑、扣带回和杏仁核等区域有关,调节的方式为神经-体液调节。其中最主要的就是HPA轴。HPA轴主要包括下丘脑室旁核、垂体前叶和肾上腺皮质,三者之间通过各种神经激素的释放来进行直接刺激和反馈调节,包括糖皮质激素等。
皮质醇是一种主要的应激激素,可以作用于身体的多种器官组织。机体在压力状态下可以通过皮质醇来维持正常的生理功能,因为皮质醇可以促进肌肉蛋白质的分解和肝脏中糖原的分解从而产生氨基酸和葡萄糖,这些物质会被输送到血液中作为能量物质使用。当机体受到紧张刺激之后,皮质醇的合成会增加,从而使机体进入"警戒"状态。皮质醇是导致应激性高血糖的关键原因,患有心肌衰竭的患者在住院期间,血清的皮质醇和葡萄糖水平显著升高,相关研究表明血清皮质醇的水平与缺血性心肌损伤的程度成正比,皮质醇水平高与缺血性心脏病和心血管死亡率增加的风险之间存在密切关系。
糖皮质激素具有快速且强大的抗炎作用,可以抑制毛细血管扩张,抑制免疫细胞的浸润和吞噬,从而减轻炎症反应。糖皮质激素可以调节紧张程度,长时间高水平的糖皮质激素会导致下丘脑萎缩并使人处于极度紧张、焦虑的状态。糖皮质激素通过结合糖皮质激素受体来发挥生理学作用,但是在组织受损或者氧化应激的情况下,糖皮质激素会结合相关的盐皮质激素受体,对心功能产生不利影响。根据相关临床数据整合,糖皮质激素会增加患者心肌梗死和静脉血栓的风险。
04 总结与展望
心血管疾病和心理疾病是现如今公共卫生组织重点关注的疾病,且两者之间存在密不可分的关系。本文对不良情绪、认知障碍和缺血性心脏病、心肌梗死之间的流行病学数据进行了整合分析,且阐述了心血管疾病和心理疾病之间可能存在的内在机制。
心血管疾病造成心理疾病的机制主要有以下几个方面:(1)心功能障碍时引发的有效循环血量的降低会造成脑部缺血,对颞叶、丘脑以及海马等区域的血流量降低显著,造成患者认知障碍。此外循环血量下降引起的Ang-Ⅱ的分泌会诱发脑细胞受到缺血再灌注损伤例如ROS和钙超载,造成神经元萎缩和突触损伤。(2)心肌受损时引发局部炎症反应产生的急性期蛋白和炎症因子会随着血液循环进入大脑,造成脑部炎症,影响中枢神经系统功能。
心理疾病造成心脏疾病的机制主要有以下几个方面:(1)心理疾病通过自主神经系统对心脏的舒张和收缩进行调节,通过促进钙超载、增加心房动作电位持续时间以及释放神经肽引发心房颤动和心律失常;(2)HPA轴通过释放糖皮质激素使人处于紧张和警戒状态,增加缺血性心脏病和心肌梗死的风险。
由于现如今疾病诊断和治疗普遍具有局部性和单一性,较少医师和患者会关注该疾病之外的影响因素。而长期的心理疾病是心脏疾病的"导火索",心脏病患者也时常备受心理疾病的折磨。因此进行学科交叉,从更多角度对疾病进行研究,能够更全面地揭示心血管疾病和心脏疾病的发病机制。为心血管疾病高风险患者提供更多预防思路,也为心理疾病患者的诊断治疗提供新的研究方向。
参考文献
[1] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2020概要[J]. 中国循环杂志,2021,36(6):521-545.
[2] KIM H, YOO J, HAN K,et al. Physical activity and cardiovascular health in depression:links between changes in physical activity and cardiovascular risk[J]. Gen Hosp Psychiatry,2022,78:35-41.
[3] FIORANELLI M, BOTTACCIOLI A G, BOTTACCIOLI F,et al. Stress and inflammation in coronary artery disease:a review psychoneuroendocrineimmunology-based[J]. Front Immunol,2018,9:2031.
[4] IVANOVS R, KIVITE A, ZIEDONIS D,et al. Association of depression and anxiety with the 10-year risk of cardiovascular mortality in a primary care population of Latvia using the SCORE system[J]. Front Psychiatry,2018,9:276.
[5] NASIŁOWSKA-BARUD A, ZAPOLSKI T, BARUD M,et al. Overt and covert anxiety as a toxic factor in ischemic heart disease in women:the link between psychological factors and heart disease[J]. Med Sci Monit,2017,23:751-758.
[6] KWAPONG Y A, BOAKYE E, KHAN S S,et al. Association of depression and poor mental health with cardiovascular disease and suboptimal cardiovascular health among young adults in the United States[J]. J Am Heart Assoc,2023,12(3):e028332.
[7] MA G R, WANG C, JIA Y L,et al. Electrocardiographic and electrooculographic responses to external emotions and their transitions in bipolar I and II disorders[J]. Int J Environ Res Public Health,2018,15(5):884.
[8] MOTYKA P, GRUND M, FORSCHACK N,et al. Interactions between cardiac activity and conscious somatosensory perception[J]. Psychophysiology,2019,56(10).
[9] HEADRICK J P, PEART J N, BUDIONO B P,et al. The heartbreak of depression:'Psycho-cardiac’ coupling in myocardial infarction[J]. J Mol Cell Cardiol,2017,106:14-28.
[10] ALLGULANDER C. Anxiety as a risk factor in cardiovascular disease[J]. Curr Opin Psychiatry,2016,29(1):13-17.
[11] HSU J H, CHIEN I C, LIN C H. Increased risk of ischemic heart disease in patients with bipolar disorder:a population-based study[J]. J Affect Disord,2021,281:721-726.
[12] EISENMANN E D, RORABAUGH B R, ZOLADZ P R. Acute stress decreases but chronic stress increases myocardial sensitivity to ischemic injury in rodents[J]. Front Psychiatry,2016,7:71.
[13] ZOLADZ P R, D'ALESSIO P A, SEELEY S L,et al. A predator-based psychosocial stress animal model of PTSD in females:influence of estrous phase and ovarian hormones[J]. Horm Behav,2019,115:104564.
[14] WIUM-ANDERSEN M K, WIUM-ANDERSEN I K, PRESCOTT E I B,et al. An attempt to explain the bidirectional association between ischaemic heart disease,stroke and depression:a cohort and meta-analytic approach[J]. Br J Psychiatry,2020,217(2):434-441.
[15] MALICK M, GILBERT K, BROUILLETTE J,et al. Cognitive deficits following a post-myocardial infarct in the rat are blocked by the serotonin-norepinephrine reuptake inhibitor desvenlafaxine[J]. Int J Mol Sci,2018,19(12):3748.
[16] JINAWONG K, APAIJAI N, CHATTIPAKORN N,et al. Cognitive impairment in myocardial infarction and heart failure[J]. Acta Physiol,2021,232(1):e13642.
[17] VU K, CLAGGETT B L, JOHN J E,et al. Depressive symptoms,cardiac structure and function,and risk of incident heart failure with preserved ejection fraction and heart failure with reduced ejection fraction in late life[J]. J Am Heart Assoc,2021,10(23):e020094.
[18] DANIEL M, AGEWALL S, BERGLUND F,et al. Prevalence of anxiety and depression symptoms in patients with myocardial infarction with non-obstructive coronary arteries[J]. Am J Med,2018,131(9):1118-1124.
[19] VON KÄNEL R, PAZHENKOTTIL A P, MEISTER-LANGRAF R E,et al. Longitudinal association between cognitive depressive symptoms and D-dimer levels in patients following acute myocardial infarction[J]. Clin Cardiol,2021,44(9):1316-1325.
[20] YıLDıRıM D, KOCATEPE V. Evaluating death anxiety and death depression levels among patients with acute myocardial infarction[J]. Omega (Westport),2023,86(4):1402-1414.
[21] ZHENG X H, ZHENG Y, MA J,et al. Effect of exercise-based cardiac rehabilitation on anxiety and depression in patients with myocardial infarction:a systematic review and meta-analysis[J]. Heart Lung,2019,48(1):1-7.
[22] GU X H, HE C J, SHEN L,et al. Association between depression and outcomes in Chinese patients with myocardial infarction and nonobstructive coronary arteries[J]. J Am Heart Assoc,2019,8(5):e011180.
[23] KOP W J, GALVAO T F, SYNOWSKI S J,et al. Effects of environmental stress following myocardial infarction on behavioral measures and heart failure progression:the influence of isolated and group housing conditions[J]. Physiol Behav,2015,152(Pt A):168-174.
[24] TOLEDO C, ANDRADE D C, DÍAZ H S,et al. Neurocognitive disorders in heart failure:novel pathophysiological mechanisms underpinning memory loss and learning impairment[J]. Mol Neurobiol,2019,56(12):8035-8051.
[25] CELANO C M, FREEDMAN M E, HARNEDY L E,et al. Feasibility and preliminary efficacy of a positive psychology-based intervention to promote health behaviors in heart failure:the REACH for Health study[J]. J Psychosom Res,2020,139:110285.
[26] PRICE R B, DUMAN R. Neuroplasticity in cognitive and psychological mechanisms of depression:an integrative model[J]. Mol Psychiatry,2020,25(3):530-543.
[27] HOWLETT J R, NELSON L D, STEIN M B. Mental health consequences of traumatic brain injury[J]. Biol Psychiatry,2022,91(5):413-420.
[28] ŚWIĄTKIEWICZ I, MAGIELSKI P, KUBICA J. C-reactive protein as a risk marker for post-infarct heart failure over a multi-year period[J]. Int J Mol Sci,2021,22(6):3169.
[29] MINCU R I, JÁNOSI R A, VINEREANU D,et al. Preprocedural C-reactive protein predicts outcomes after primary percutaneous coronary intervention in patients with ST-elevation myocardial infarction a systematic meta-analysis[J]. Sci Rep,2017,7:41530.
[30] LEBOYER M, SORECA I, SCOTT J,et al. Can bipolar disorder be viewed as a multi-system inflammatory disease?[J]. J Affect Disord,2012,141(1):1-10.
[31] BADIMON L, PEÑA E, ARDERIU G,et al. C-reactive protein in atherothrombosis and angiogenesis[J]. Front Immunol,2018,9:430.
[32] DIX C, ZELLER J, STEVENS H,et al. C-reactive protein,immunothrombosis and venous thromboembolism[J]. Front Immunol,2022,13:1002652.
[33] ULLAH I, AWAN H A, AAMIR A,et al. Role and perspectives of inflammation and C-reactive protein (CRP) in psychosis:an economic and widespread tool for assessing the disease[J]. Int J Mol Sci,2021,22(23):13032.
[34] SEWPAUL R, NAUDÉ P J W, STEIN D J,et al. Psycho-logical distress and C-reactive protein in a South African natio-nal survey[J]. Acta Neuropsychiatrica,2019,31(5):270-275.
[35] ZHENG H X, TEAGUE T K, YEH F C,et al. C-Reactive protein and the kynurenic acid to quinolinic acid ratio are independently associated with white matter integrity in major depressive disorder[J]. Brain Behav Immun,2022,105:180-189.
[36] KHAN A A, LIP G Y H, SHANTSILA A. Heart rate variability in atrial fibrillation:the balance between sympathetic and parasympathetic nervous system[J]. Eur J Clin Invest,2019,49(11):e13174.
[37] CHADDA K R, AJIJOLA O A, VASEGHI M,et al. Ageing,the autonomic nervous system and arrhythmia:from brain to heart[J]. Ageing Res Rev,2018,48:40-50.
[38] CLYBURN C, SEPE J J, HABECKER B A. What gets on the nerves of cardiac patients? Pathophysiological changes in cardiac innervation[J]. J Physiol,2022,600(3):451-461.
[39] PATTERSON E, PO S S, SCHERLAG B J,et al. Triggered firing in pulmonary veins initiated by in vitro autonomic nerve stimulation[J]. Heart Rhythm,2005,2(6):624-631.
[40] RONEY C H, NG F S, DEBNEY M T,et al. Determinants of new wavefront locations in cholinergic atrial fibrillation[J]. Europace,2018,20(suppl_3):iii3-15.
[41] CLYBURN C, SEPE J J, HABECKER B A. What gets on the nerves of cardiac patients? Pathophysiological changes in cardiac innervation[J]. J Physiol,2022,600(3):451-461.
[42] DE VOS C B, NIEUWLAAT R, CRIJNS H J,et al. Autonomic trigger patterns and anti-arrhythmic treatment of paroxysmal atrial fibrillation:data from the Euro Heart Survey[J]. Eur Heart J,2008,29(5):632-639.
[43] GOLDBERGER J J, ARORA R, BUCKLEY U,et al. Autonomic nervous system dysfunction:JACC focus seminar[J]. J Am Coll Cardiol,2019,73(10):1189-1206.
[44] HOU J Q, WANG C, MA D,et al. The cardioprotective and anxiolytic effects of Chaihujialonggumuli Granule on rats with anxiety after acute myocardial infarction is partly mediated by suppression of CXCR4/NF-κB/GSDMD pathway[J]. Biomed Pharmacother,2021,133:111015.
[45] ALADIO J M, COSTA D, MATSUDO M,et al. Cortisol-mediated stress response and mortality in acute coronary syndrome[J]. Curr Probl Cardiol,2021,46(3):100623.
[46] SWIESZKOWSKI S P, COSTA D, ALADIO J M,et al. Neurohumoral response and stress hyperglycemia in myocardial infarction[J]. J Diabetes Complications,2022,36(12):108339.
[47] SUNDBØLL J, DARVALICS B, HORVÁTH-PUHÓ E,et al. Preadmission use of glucocorticoids and risk of cardiovascular events in patients with ischemic stroke[J]. J Thromb Haemost,2018,16(11):2175-2183.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#流行病学# #心血管疾病# #心理疾病#
40