【专题论著】| 近5年单中心肢端型及皮肤型黑色素瘤外科治疗患者的预后因素分析
2023-08-31 中国癌症杂志 中国癌症杂志 发表于上海
本文回顾性分析了近5年在复旦大学附属肿瘤医院接受外科治疗的AM和CM患者的预后情况,探索新药治疗时代影响黑色素瘤术后的预后因素。
[摘要] 背景与目的:中国及亚洲部分国家和地区的恶性黑色素瘤(malignant melanoma,MM)患者的预后显著低于欧美人群,主要是因为肢端型黑色素瘤(acral melanoma,AM)无论是在生物学行为、临床特征、预后以及药物的疗效(主要是免疫治疗)上都差于皮肤型黑色素瘤(cutaneous melanoma,CM)。近5年在MM外科治疗和药物辅助治疗选择方面发生了一定的变化。本文回顾性分析近5年单中心经手术治疗的AM及CM患者的生存变化和相关的独立预后因素。方法:对2017—2021年在复旦大学肿瘤医院黑色素瘤诊治中心接受外科治疗的MM患者进行回顾性研究。通过病史回顾和随访收集患者完整的基本信息、原发灶特点、淋巴灶转移特征和生存状态,剔除黏膜型、原发不明、随访时间短于6个月的病例。通过生存分析和多因素分析,探讨患者生存的差异和相关预后因素。结果:本研究共入组585例黑色素瘤患者,其中AM 397例,CM 188例。中位年龄59(19~89)岁,女性占54%。AM和CM在性别、年龄、原发灶位置、基因突变分布和辅助治疗等方面存在差异,但在Breslow深度、溃疡、淋巴结转移等肿瘤负荷因素上差异无统计学意义。中位随访时间为24个月,中位无疾病生存期为36个月,1、2年无复发生存期(relapse-free survival,RFS)分别为75.6%和61.2%。但两亚型的预后差异无统计学意义。AM中RFS的独立风险因素包括:原发灶溃疡(HR=2.265,95% CI:1.257~4.080),NRAS基因突变(HR=1.816,95% CI:1.211~2.725),较晚的N分期(N1、N2、N3相较N0的HR分别为1.850、4.085、4.191);保护因素为女性(HR=0.636,95% CI:0.433~0.933)和上肢原发灶(HR=0.259,95% CI:0.105~0.639)。CM中RFS的独立风险因素包括:原发灶溃疡(HR=4.073,95% CI:1.718~9.654),较晚的N分期(其中N3期的HR=5.482,95% CI:2.385~12.601)。结论:预后分析发现,原发灶的肿瘤负荷仍旧与CM和AM患者的预后密切相关,而NRAS基因的突变状态则提示AM预后更差。
[关键词] 黑色素瘤;肢端型;皮肤型;预后分析;外科治疗
[Abstract] Background and purpose: The prognosis of malignant melanoma (MM) in China and Asia is significantly worse than that of European and American populations, mainly because acral melanoma (AM) is inferior to cutaneous melanoma (CM) in terms of biological behavior, clinical features, prognosis, and efficacy of drugs (mainly immunotherapy). Certain changes have occurred in the last 5 years in the choice of surgical and drug-adjuvant treatment for MM. This study retrospectively analyzed the survival outcomes of Chinese CM and AM patients after surgical treatment in a single cancer center for the past five years. Methods: Data of melanoma patients undergoing surgical treatment were retrospectively collected from 2017 to 2021 in Fudan University Shanghai Cancer Center. The basic clinical characteristics, pathological features, lymph node tumor burden and survival information were carefully collected from medical document. Patients with mucosal subtype, unknown primary sites, or follow-up less than 6 months were excluded. Survival analysis and multivariable Cox regression analysis were performed to explore prognosis and associated risk factors. Results: Totally 585 patients were enrolled, including 397 AM and 188 CM patients. The median age was 59 (19-89) years, and 54% were female. AM and CM patients differed in gender, age, primary tumor location, gene mutation distribution and adjuvant therapy, but not in tumor burden associated factors including the Breslow thickness, ulceration and lymph node involvment. The median follow-up time was 24 months, and the median relapse-free survival (mRFS) was 36 months, with 1-year and 2-year RFS of 75.6% and 61.2%, respectively. However, there was no statistically significant difference in prognosis between the two subtypes. Primary ulceration (HR=2.265, 95% CI: 1.257-4.080), NRAS mutation (HR=1.816, 95% CI: 1.211-2.725) and advanced N stage (HR of N1, N2 and N3 versus N0 were 1.850, 4.085 and 4.191, respectively) were independent prognostic risk factors for RFS in AM; while the protective factors were female (HR=0.636, 95% CI: 0.433-0.933) and upper extremity primary lesions (HR=0.259, 95% CI: 0.105-0.639). Independent risk factors for RFS in CM included primary ulceration (HR=4.073, 95% CI: 1.718-9.654), and later N stage (HR=5.482, 95% CI: 2.385-12.601 for N3 stage). Conclusion: High tumor burden of primay lesion still deteriorates overall outcomes for both AM and CM, while harboring NRAS mutation might suggest even worse outcome for AM.
[Key words] Melanoma; Acral; Cutaneous; Prognostic analysis; Surgical treatment
恶性黑色素瘤(malignant melanoma,MM)的发病呈现明显的地域性,而在不同地区,MM的主要亚型分布也存在显著差异。基于GLOBOCAN 2020年统计数据,西方国家皮肤型黑色素瘤(cutaneous melanoma,CM)的年发病率为(14~42)/100 000人,而在大多数非洲和亚洲国家,黑色素瘤仍较为罕见,年发病率基本都低于1/100 000人[1]。2022年全国癌症报告显示中国皮肤黑色素瘤发病率和死亡率分别为0.32/10万和0.17/10万[2]。亚型分布亦随人种改变[3],CM为高加索MM中的优势亚型,占总体病例近90%,肢端型黑色素瘤(acral melanoma,AM)则非常罕见,占比不足2%。而在有色人种中,主要的优势亚型为肢端型黑色素瘤,占比约60%。中国及亚洲部分国家和地区黑色素瘤的预后也显著低于欧美人群[4],主要的原因在于肢端型黑色素瘤,无论是在生物学行为、临床特征、预后以及药物的疗效(主要是免疫治疗)上都差于皮肤型黑色素瘤[3,5-6]。
规范化外科治疗是可切除早期黑色素瘤的主要治疗手段,但临床和病理学因素是影响外科治疗预后的关键因素。以往我们也总结过外科治疗的疗效和预后因素[7],但近5年在MM外科治疗和药物辅助治疗选择方面发生了一定的变化,例如外科方面前哨淋巴结活检阳性后可选择观察而不必立刻行淋巴结清扫[8],而在药物治疗方面靶向治疗和免疫治疗都相继在中国获批黑色素瘤适应证,也成为了MM术后辅助治疗的首选方案[9]。
本文回顾性分析了近5年在复旦大学附属肿瘤医院接受外科治疗的AM和CM患者的预后情况,探索新药治疗时代影响黑色素瘤术后的预后因素。
1 资料和方法
1.1 研究对象
本文回顾性分析2017年—2021年在复旦大学附属肿瘤医院接受外科手术治疗的MM患者。纳入标准为:① 经病理学检查证实为原发性AM和CM的患者;② 接受包括原发灶扩大切除、区域前哨淋巴结活检、区域淋巴结清扫等规范化手术。排除黏膜型黑色素瘤、原发不明黑色素瘤、眼黑色素瘤病例;排除临床病理学信息严重不全的病例;截至最后随访时间,随访小于6个月的病例。
通过医院病史系统采集患者的临床和病理学检查相关信息。所有患者均通过病理学检查诊断为AM和CM,并按规定签署知情同意书、授权委托书以及手术风险告知书后接受手术治疗。通过本院住院及门诊病史系统采集患者术后辅助治疗方案、复发、转移和进展情况。通过医院临床信息中心的随访数据库提取患者死亡信息。
1.2 数据搜集和随访
本研究收集了患者一般临床信息包括年龄、性别、病理学信息和辅助治疗情况;病理学信息包括原发灶部位、溃疡、Breslow厚度、Clark分级、基因突变情况和淋巴结转移情况。淋巴结转移情况包括淋巴结分期(N stage)、淋巴结累及站数(station)和淋巴结转移模式(involvement)等。淋巴结站数中,N1代表第一站淋巴结,如腋窝淋巴结和腹股沟淋巴结;N2代表第二站淋巴结,如髂窝淋巴结和锁骨上淋巴结;N-ITT代表途中淋巴结,包括肘窝淋巴结和腘窝淋巴结等。淋巴结转移模式中,分为通过前哨淋巴结活检确诊的微转移(micrometastasis)和淋巴结临床显性转移(macrometastatasis)。最终的TNM分期根据美国癌症联合会(American Joint Committee on Cancer,AJCC)癌症分期手册第8版标准确定。
患者术后接受常规的临床体检和影像学检查,包括超声、CT和MRI等。随访频率为2年内每3个月随访1次,术后第3~5年每6个月随访1次,5年后为每年1次或临床需要时。除门诊随访外,还根据医院统计中心通过电话和信件随访所获得的信息获得随访结果,随访直至死亡或2022年1月31日。
总生存期(overall survival,OS)定义为从根治性手术日期到死亡或最后一次随访时间的间隔。无复发生存期(relapse-free survival,RFS)定义为根治性手术与局部复发或远处转移的时间间隔。局部无复发生存期(local recurrence-free survival,LRFS)定义为根治性手术与局部复发、移行转移或淋巴结转移的时间间隔。无远处转移生存期(distant mestastasis-free survival, DMFS)定义为根治性手术与远处转移的时间间隔。
本研究经复旦大学附属肿瘤医院伦理委员会批准(伦理号:2208259-10)。每个入组的患者在入院及术前都签署了知情同意书。
1.3 统计学处理
采用Wilcoxon符号秩检验比较肢端型和皮肤型亚组间Clark水平、N分期、淋巴结累及站数、淋巴结转移模式和整体分期间的差异,采用Pearson卡方检验和Fisher精确检验比较两亚组间性别、原发灶、基因突变情况、溃疡、辅助治疗方案间的差异,采用独立t检验比较两组间年龄、Breslow指数间差异。采用二分类logistics分析和回归分析比较因素间相关性。生存分析采用Kaplan-Meier法以及Cox比例风险回归分析法,其中单变量生存分析筛选预后因素分别以P<0.10为标准纳入多变量模型,得出调整后P值或log-rank P值、HR和95% CI值。多变量分析采用双侧检验,P<0.05为差异有统计学意义。所有统计学分析均采用SPSS 26.0(SPSS Company,Chicago,IL)软件。
2 结 果
2.1 一般情况
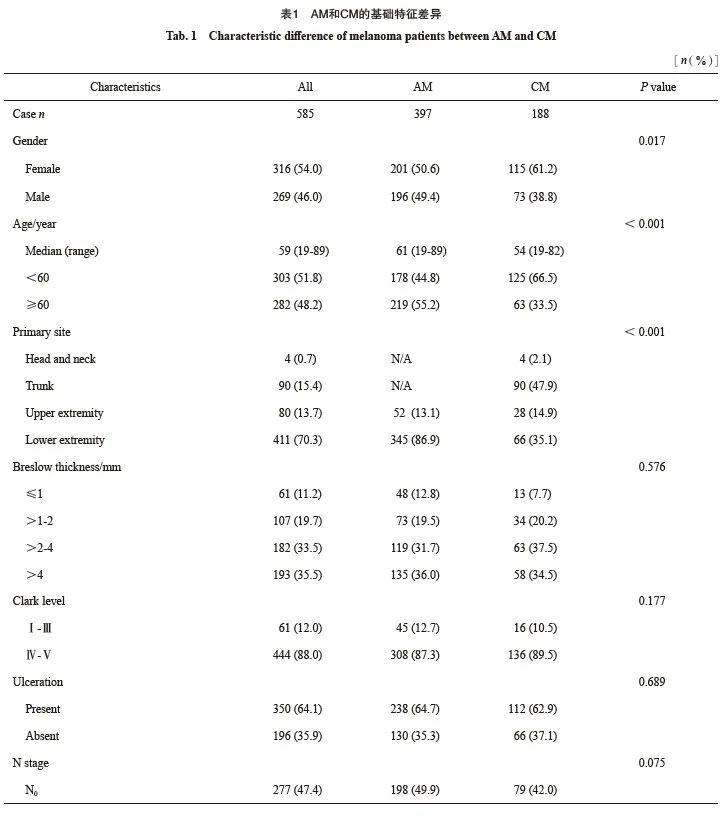
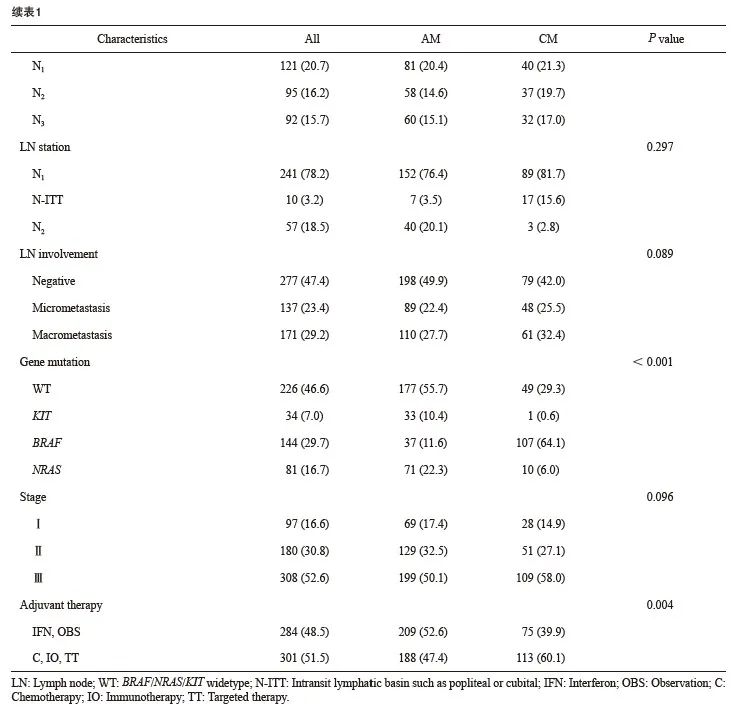
共纳入585例MM患者,包含397例AM和188例CM。男性269例,女性316例;年龄19~89岁,平均55.7岁,中位年龄59岁。平均Breslow深度为3.62 mm;溃疡率为64.1%;淋巴结转移率为52.6%。AJCC 第8版分期Ⅰ、Ⅱ、Ⅲ期分别占16.6%、30.8%、52.6%(表1)。
2.2 AM和CM之间临床病理学特征差异
AM和CM之间性别、年龄、原发灶位置分布、基因突变和辅助治疗情况等因素存在显著差异(表1)。相较于CM,AM中男性比例高、年龄大、BRAF基因突变少、接受化疗、免疫或靶向辅助治疗比例低。原发灶分布有差异,但仅考虑上肢起病与否二者差异无统计学意义(P=0.555)。其余与肿瘤负荷相关病理学特征两组差异无统计学意义,包括Breslow深度、Clark分级、溃疡情况等原发灶特征,以及N分期、累及站数、转移方式等淋巴结负荷情况(表1)。
2.3 生存分析
中位随访时间24个月,9.57%(56/585)的患者因病死亡,30.51%(209/585)的患者出现疾病复发。mRFS为36个月,mOS未达到。1和2年RFS率分别为75.6%和61.2%,1和2年OS率分别为97.2%和91.2%(表2)。
复发模式方面,局部复发率略高于远处复发率,2年LRFS和DMFS分别为69.0%和79.1%。
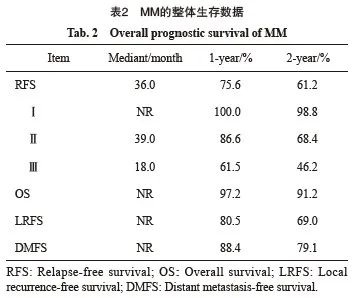
2.4 预后因素分析
AM和CM的RFS和OS差异无统计学意义。原发灶溃疡、N分期是黑色素瘤整体RFS和OS的独立影响因素(图1)。
单因素分析发现,AM中RFS、OS预后因素均为6个,其中RFS相关的为女性(HR=0.658,P=0.013 )、上肢原发灶(HR=0.420,P=0.008)、NRAS基因突变(HR=1.937,P=0.001)、Breslow深度(HR=4.322,P<0.001)、原发灶溃疡(HR=4.355,P<0.001)和N分期(P<0.001);OS分析剔除上肢原发灶,但年龄60岁及以上(HR=2.386,P=0.011)为风险因素(表3)。CM中RFS的风险因素为NRAS基因突变(HR=2.504,P=0.035 )、Breslow 深度(HR=4.941,P=0.001)、原发灶溃疡(HR=5.402,P<0.001)和N分期(P<0.001);OS则与Breslow厚度(HR=5.658,P=0.094)和原发灶溃疡(HR=9.351,P=0.031)相关(表4)。
多因素分析方面,对于AM,男性、非上肢部位、NRAS基因突变(HR=1.816,95% CI:1.211~2.725)、原发灶溃疡(HR = 2.265,95% CI:1.257~4.080)和N分期(N1、N2、N3相较N0的HR分别为1.850、4.085、4.191)是独立的疾病复发风险因素;女性(HR = 0.636,95% CI:0.433~0.933)和上肢原发灶(HR=0.259,95% CI:0.105~0.639)为独立保护因素(表 3)。年龄是独立的死亡风险因素(表3),60岁以上人群疾病死亡风险是60岁以下人群的3.014倍(95% CI:1.267~7.171)。对于CM,伴随溃疡和N3的复发风险分别显著增加307.3%(95% CI:1.718~9.654)、448.2%(95% CI:2.385~12.601),但未发现OS的独立预后因素(表4)。
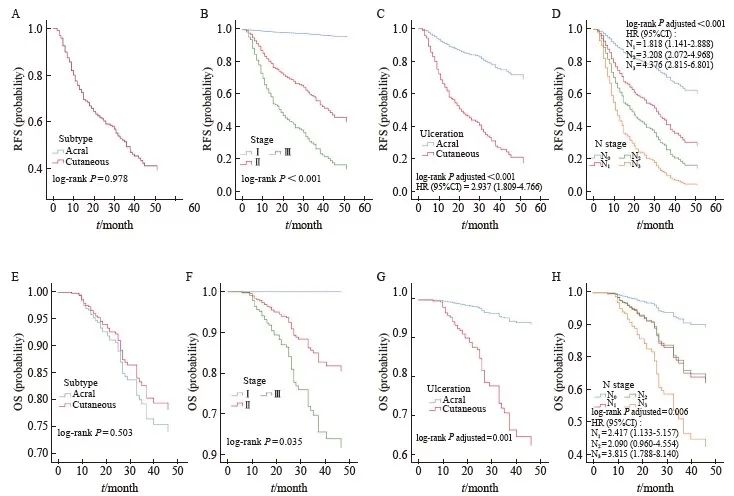
图1 整体黑色素瘤生存分析
Fig. 1 Univariable and multivariable survival analyses of clinicopathologic factors associated with RFS and OS in melanoma patients
RFS: Relapse-free survival; OS: Overall Survival. A: RFS for patients with acral melanomas compared with those with the other cutaneous subtypes (P=0.978). B: RFS for patients with different stages (P <0.001). C: RFS for patients with ulceration compared with those without (P<0.001, HR=2.937, 95% CI: 1.809-4.766). D: RFS for patients with different N stages (P<0.001). The risk of recurrence for patients in stage N3 was 4.376 times higher compared with patients in stage N1 (95% CI: 2.815-6.801). E: OS for patients with acral melanomas compared with those with the other cutaneous subtypes (P=0.503). F: OS for patients with different stages (P=0.035). G: OS for patients with ulceration compared with those without (P=0.001, HR=5.285, 95% CI: 2.068-13.507). H: OS for patients with different N stages (P=0.006). The risk of death for patients in stage N3 was 3.815 times higher compared with patients in stage N1 (95% CI: 1.788-8.140).
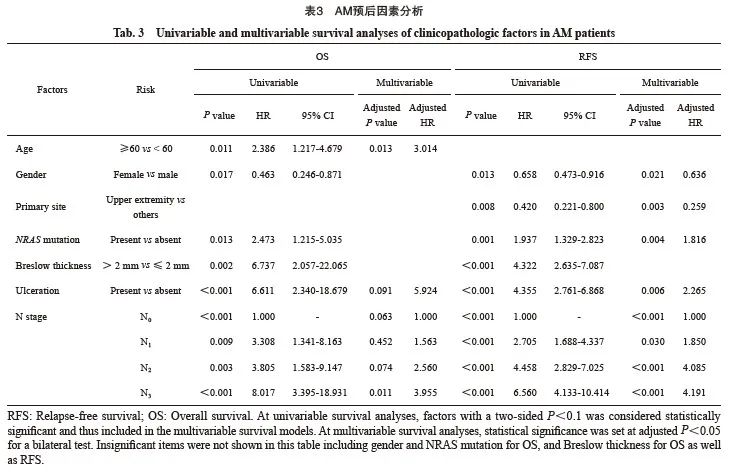
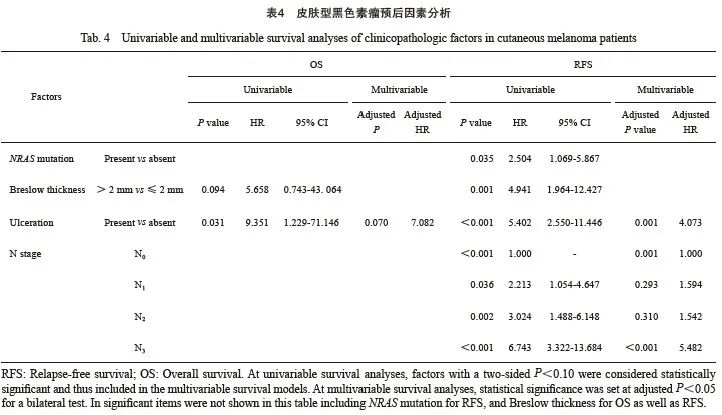
3 讨 论
本研究回顾性分析了本中心近5年来接受外科手术治疗的AM和CM患者的生存情况。本组患者中67.9%为AM。中位RFS达36个月,1和2年RFS分别为75.6%和61.2%。本研究首次提供了中国黑色素瘤在免疫治疗和靶向治疗时代外科治疗后的预后数据。尽管AM和CM之间不存在显著的预后差异,但除了已知的独立预后因素外,本研究发现男性、NRAS突变、下肢原发也是AM高复发风险的预后因素。
中山大学肿瘤防治中心团队回顾分析了1999—2014年接受外科治疗的1 012例黑色素瘤患者的预后,其中肢端型占39.5%,中位随访60个月,1年内复发转移率为38%,中位疾病复发时间仅12个月[4]。郭军教授等分析了2000—2017年中国多中心收治的1 157例AM病例,其中Ⅲ~Ⅳ期的患者占34.9%,5年OS率为58.2%,中位OS达80.1个月[10]。本中心和美国Mayo诊所团队共同分析了2009—2015年外科收治的AM患者的预后,本中心共纳入280例患者,Ⅲ期患者占27.2%,5年OS率为68.4%,而有研究[11]报道的62例高加索人患者,Ⅲ期仅占19.4%,5年OS率达73.0%。因此将本研究的数据与以上的文献相比可以看出,本中心近5年来外科治疗后的复发和生存情况,优于国内较早期的队列的预后数据。这与近5年来外科规范化治疗的推广,以及免疫治疗和靶向治疗等新药的临床应用密切相关。首先在药物治疗方面,过去辅助治疗选择仅限于干扰素、白细胞介素和化疗等不良反应大、疗效甚微的治疗方案。而近5年,随着免疫治疗及靶向治疗在黑色素瘤中的成功运用,一大批新药包括程序性死亡[蛋白]-1(programmed death-1,PD-1)单抗免疫治疗,及维莫非尼、达拉非尼、曲美替尼等靶向治疗药物都相继登上黑色素瘤术后辅助治疗的舞台[4, 11]。外科治疗方面,更为强调对于临床Ⅰ~Ⅱ期患者进行前哨淋巴结活检和病理学评估,而对于前哨淋巴结阳性后清扫手术的选择也变得更为慎重[12],对于区域淋巴结功能的保留,或能更好地激发免疫治疗的潜力[8,13-14]。
前面提到的郭军教授牵头的国内多中心AM队列研究中,发现足底的黑色素瘤患者生存显著差于手掌和甲下的黑色素瘤(P=0.005)[10]。此外,原发灶溃疡对黑色素瘤预后的影响随Breslow浸润的加深而改变,对于浸润深度在1 mm以内的黑色素瘤来说,溃疡显著提示预后更差(P<0.001),而对于浸润深度1 mm以上患者,溃疡对预后的影响不显著(P>0.05)[15]。在我们的研究中,对于肢端型,非上肢原发是复发的独立风险因素。且总体而言上肢病灶的复发风险较其他部位减少58%(P=0.008)。进一步分析发现,345例下肢原发的AM中足底部位高达85.2%,而49例上肢原发的患者中,91.8%为甲下黑色素瘤,这也解释了为何原发部位是AM的独立预后因素。此外,原发灶溃疡在本研究中依然是黑色素瘤最重要的预后风险因素之一,整体疾病复发风险和死亡风险分别为无溃疡人群的2.937倍(P<0.001)和5.285倍(P=0.001),并在肢端型(P=0.006,HR=2.265)和皮肤型(P=0.001,HR=4.073)中均表现为更高的复发风险。溃疡还与Breslow浸润≥2 mm显著相关(P<0.001,OR=12.26),因此在多因素预后分析模型中同时纳入溃疡和Breslow浸润深度会降低两者的相关性,使得本研究中Breslow厚度不再与预后显著相关。
除了溃疡,我们也发现了基因突变状态或能影响患者的复发和预后。我们分析了 AM和CM的基因突变分布的差异。在本研究队列中,107(64.1%)例CM携带BRAF基因突变。71(22.3%)例AM携带NRAS基因,且NRAS突变在预后分析中成为了影响术后复发的独立风险因素(HR=1.816,95% CI:1.211~2.725,P=0.004)。已有研究表明,即使是皮肤型黑色素瘤,NRAS突变的无进展生存期也比BRAF突变型更短[16]。从机制上说,白色人种由于暴露于紫外线(ultraviolet,UV)辐射、晒伤史和对抵御阳光的能力较差等因素,近90%为从色素痣恶变而来的皮肤型黑色素瘤,具有更高的肿瘤突变负荷(tumor mutation burden,TMB)[17–19],也较AM有更高的BRAF突变比例,从而可以更多地接受高效的靶向治疗,因此AM和CM的预后也可能会由于药物疗效的差异而出现差距。但对于亚洲黄色人种的优势亚型AM,目前其发病原因还不明,可能与皮肤的慢性炎症损伤、免疫微环境较差等因素相关。由于RAS基因突变肿瘤的侵袭性高,缺乏有效的靶向治疗,对免疫治疗也存在更多的原发性耐药,NRAS突变的患者总体预后较差[16]。
在一项回顾性分析美国癌症监测、流行病学和最终结果(the Surveillance, Epidemiology, and End Results,SEER)数据库于2006—2015年纳入的1 724例AM和87 442例CM的研究中,尽管AM的预后差于CM,但两种亚型的5年OS率均达到80.6%和93.0%(P<0.001)。这是由于尽管AM的肿瘤负荷高于CM,但仍有45%患者属于Ⅰ期黑色素瘤,Breslow深度小于1 mm的比例也达36%[20]。本研究分析观察到AM和CM的OS(P=0.503)和RFS(P=0.978)差异并无统计学意义,但本研究的预后仍明显差于欧美的报道,其本质原因可能还是亚洲人的黑色素瘤较欧美人群具有更高的肿瘤负荷[11]。在本组数据中,中位的Breslow深度达到3.62 mm,溃疡率达64.1%,Ⅲ期的比例超过50%。但在另一项意大利开展的针对临床Ⅰ~Ⅱ期的黑色素瘤多中心队列研究[21]中,结节型皮肤黑色素瘤由于具有更厚的浸润深度和更高的溃疡率,其前哨淋巴结阳性率、分期分布和预后都接近AM。由此也提示,AM和CM的预后差异不一定单纯在于亚型或部位差异,也有可能是由于诊断时肿瘤负荷的不同。因此,加强对肢端可疑色斑的监测,做到早发现、早诊断和早治疗,仍是改善中国黑色素瘤患者预后的关键。
本研究尚存在一些不足。首先,作为单中心研究,限制了患者的地区分布多样性,无法反映中国黑色素瘤近5年外科治疗的全貌。同时,本研究仅包括AM和CM,缺乏例如黏膜黑色素瘤、原发不明等特殊类型的黑色素瘤的预后和治疗资料。最后,作为回顾性研究,剔除了随访时间不足、信息不全的部分患者,可能使结果产生偏倚。此外,仅2年的中位随访时间,还无法提供更远期的生存数据。后续需继续扩大样本量,延长随访时间,以获得更为准确的复发和生存的 结果。
综上所述,本回顾性研究是目前样本量最大的,近5年来中国黑色素瘤外科治疗的预后分析。尽管本队列研究中AM和CM的预后差异不显著,但在预后分析中,除了传统的溃疡和淋巴结转移等因素,我们发现携带NRAS突变和下肢原发显著影响AM患者的预后,这对中国黑色素瘤患者的外科治疗及预后预测均具有重要意义。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] ARNOLD M, SINGH D, LAVERSANNE M, et al. Global burden of cutaneous melanoma in 2020 and projections to 2040[J]. JAMA Dermatol, 2022, 158(5): 495-503.
[2] ZHENG R S, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9.
[3] BRADFORD P T, GOLDSTEIN A M, MCMASTER M L, et al. Acral lentiginous melanoma: incidence and survival patterns in the United States, 1986-2005[J]. Arch Dermatol, 2009, 145(4): 427-434.
[4] WEN X Z, LI D D, ZHAO J J, et al. Time-varying pattern of recurrence risk for localized melanoma in China[J]. World J Surg Oncol, 2020, 18(1): 6.
[5] NAGORE E, PEREDA C, BOTELLA-ESTRADA R, et al. Acral lentiginous melanoma presents distinct clinical profile with high cancer susceptibility[J]. Cancer Causes Control, 2009, 20(1): 115-119.
[6] DUARTE C A, FLÓREZ J P, LÓPEZ H G, et al. Survival of acral lentiginous melanoma in the national cancer institute of Colombia[J]. J Eur Acad Dermatol Venereol, 2017, 31(3): 438-442.
[7] LIAN B, et al. The natural history and patterns of metastases from mucosal melanoma: an analysis of 706 prospectivelyfollowed patients[J]. Ann Oncol, 2017, 28(4): 868-873.
[8] FARIES M B, THOMPSON J F, COCHRAN A J, et al. Completion disp or observation for sentinel-node metastasis in melanoma[J]. N Engl J Med, 2017, 376(23): 2211-2222.
[9] CURTI B D, FARIES M B. Recent advances in the treatment of melanoma[J]. N Engl J Med, 2021, 384(23): 2229-2240.
[10] WEI X T, WU D, LI H, et al. The clinicopathological and survival profiles comparison across primary sites in acral melanoma[J]. Ann Surg Oncol, 2020, 27(9): 3478-3485.
[11] HUANG K, XU Y, GABRIEL E M, et al. Comparative analysis of acral melanoma in Chinese and Caucasian patients[J]. J Skin Cancer, 2020, 2020: 5169051.
[12] FRANKE V, VAN AKKOOI A C J. The extent of surgery for stage Ⅲ melanoma: how much is appropriate? [J]. Lancet Oncol, 2019, 20(3): e167-e174.
[13] LEITER U, STADLER R, MAUCH C, et al. Complete lymph node disp versus no disp in patients with sentinel lymph node biopsy positive melanoma (DeCOG-SLT): a multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2016, 17(6): 757-767.
[14] LEITER U, STADLER R, MAUCH C, et al. Final analysis of DeCOG-SLT trial: no survival benefit for complete lymph node disp in patients with melanoma with positive sentinel node[J]. J Clin Oncol, 2019, 37(32): 3000-3008.
[15] WEI X T, WU D, CHEN Y, et al. Prognostic value of ulceration varies across Breslow thicknesses and clinical stages in acral melanoma: a retrospective study[J]. Br J Dermatol, 2022, 186(6): 977-987.
[16] RANDIC T, KOZAR I, MARGUE C, et al. NRAS mutant melanoma: towards better therapies[J]. Cancer Treat Rev, 2021, 99: 102238.
[17] WHITE R M, ZON L I. Melanocytes in development, regeneration, and cancer[J]. Cell Stem Cell, 2008, 3(3): 242-252.
[18] ALEXANDROV L B, NIK-ZAINAL S, WEDGE D C, et al. Signatures of mutational processes in human cancer[J]. Nature, 2013, 500(7463): 415-421.
[19] CHALMERS Z R, CONNELLY C F, FABRIZIO D, et al. Analysis of 100 000 human cancer genomes reveals the landscape of tumor mutational burden[J]. Genome Med, 2017, 9(1): 34.
[20] HUANG K, FAN J, MISRA S. Acral lentiginous melanoma: incidence and survival in the United States, 2006-2015, an analysis of the SEER registry[J]. J Surg Res, 2020, 251: 329-339.
[21] MANDALÀ M, RUTKOWSKI P, GALLI F, et al. Acral lentiginous melanoma histotype predicts outcome in clinical stage Ⅰ-Ⅱ melanoma patients: an international multicenter study[J]. ESMO Open, 2022, 7(3): 100469.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言