变身还是隐身?肺癌患者ALK抑制剂耐药后竟检出EGFR突变!
2023-10-31 苏州绘真医学 苏州绘真医学 发表于上海
本文报告1例经病理证实的ALK重排转移性肺腺癌患者,在接受两线ALK抑制剂治疗后,疾病进展时出现EGFR L858R突变。
本文报告1例经病理证实的ALK重排转移性肺腺癌患者,在接受两线ALK抑制剂治疗后,疾病进展时出现EGFR L858R突变。在初步诊断时,检测到肿瘤ALK表达,未检测到EGFR突变。患者经一线克唑替尼和后续布格替尼治疗后均达到持续部分缓解。布格替尼治疗时,疾病进展,循环肿瘤DNA的液体活检结果仅显示EGFR L858R,经锁骨上淋巴结肿瘤再次活检证实了这一结果。患者最初接受培美曲塞和卡铂治疗,2个周期化疗后加用厄洛替尼。联合治疗使患者获得了部分缓解和轻微的不良反应。整个临床过程表明最初存在两个独立的肿瘤克隆,在诊断时以ALK为主。对布格替尼初始应答后,随后的突破性疾病进展与EGFR突变肿瘤亚群不受控制的生长有关。本文将对其获得性耐药的分子机制和治疗策略进行讨论。
背 景
在晚期肺腺癌中驱动基因(如EGFR和ALK)共存的情况鲜有报道。本文报告了1例ALK重排的转移性肺腺癌患者,患者先前对2种ALK抑制剂反应良好,但随后可能因未检出的EGFR突变肿瘤克隆而导致治疗失败。本病例报告已从患者处获得了知情同意。
病 例
患者男,65岁,长期吸烟40包年,2019年1月在香港玛丽医院被诊断为Ⅳ期右下叶肺腺癌伴右锁骨上淋巴结和双侧肺内转移。锁骨上淋巴结细针穿刺(FNA)结果显示腺癌,免疫染色显示TTF-1呈弥漫性强阳性,p40呈阴性,与肺起源相符(图1A)。随后进行分子检测,通过等位基因特异性聚合酶链反应(PCR)技术,未发现EGFR突变,但免疫组化染色显示ALK呈阳性(图1B),未检测到ROS1。!
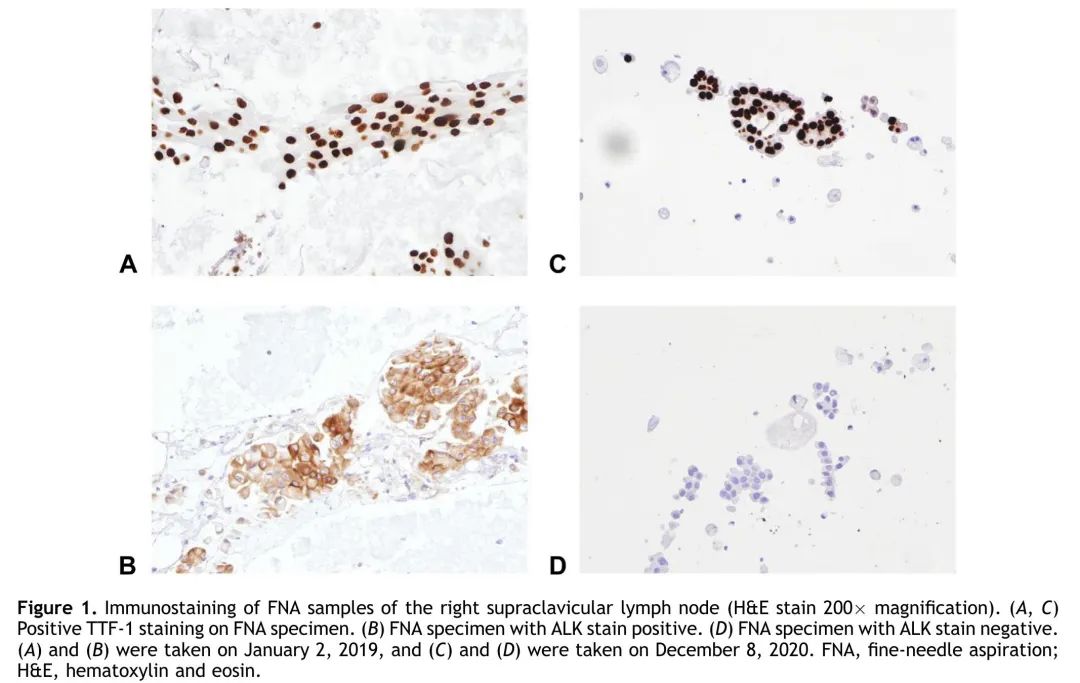
图1. 右侧锁骨上淋巴结FNA标本免疫组化染色。
根据临床试验方案,患者自2019年2月起接受克唑替尼(250 mg,每日2次)治疗,部分缓解。患者于2019年11月疾病进展,胸部CT扫描显示左肺上叶结节增大,颅脑MRI显示右枕叶皮质下新发5mm病变。自2020年2月以来,在另一项临床试验中,全身性治疗转为布格替尼二线治疗(在第1周每日90 mg治疗后,每日180 mg),间隔CT扫描显示疾病稳定,MRI显示脑部病变消退。患者于2020年10月开始出现疾病进展,右侧锁骨上淋巴结肿大。进行血浆二代测序显示仅发现EGFR L858R突变,未发现ALK变异或其他共突变。2020年12月对右侧锁骨上淋巴结进行重复FNA,证实为伴EGFR第21外显子L858R突变的腺癌,但免疫组化染色未检测到ALK蛋白(图1C和D)。病理学家对患者2019年的FNA标本进行了复查和验证,未见EGFR突变。血浆游离DNA也检出EGFR L858R突变(等位基因分数为1.3%)。
该患者先前确诊为ALK变异的肺腺癌,经布格替尼治疗后证实为EGFR突变型肺腺癌,于2020年12月8日开始接受培美曲塞(500 mg/m²)和卡铂(曲线下面积= 5),根据临床试验方案停用布格替尼。自2021年2月9日起,患者在化疗的基础上加用了厄洛替尼(每日150 mg)(代替奥希替尼,以应对经济原因)。迄今为止,患者已完成了6个周期的双药化疗,目前正在使用培美曲塞(第19个周期)联合厄洛替尼维持治疗。患者胸部X光片系列见图2。重新评估的胸部CT扫描显示部分缓解,左肺上叶肿块缩小和淋巴管炎好转(图3)。颅脑MRI未见转移。联合治疗的耐受性良好。
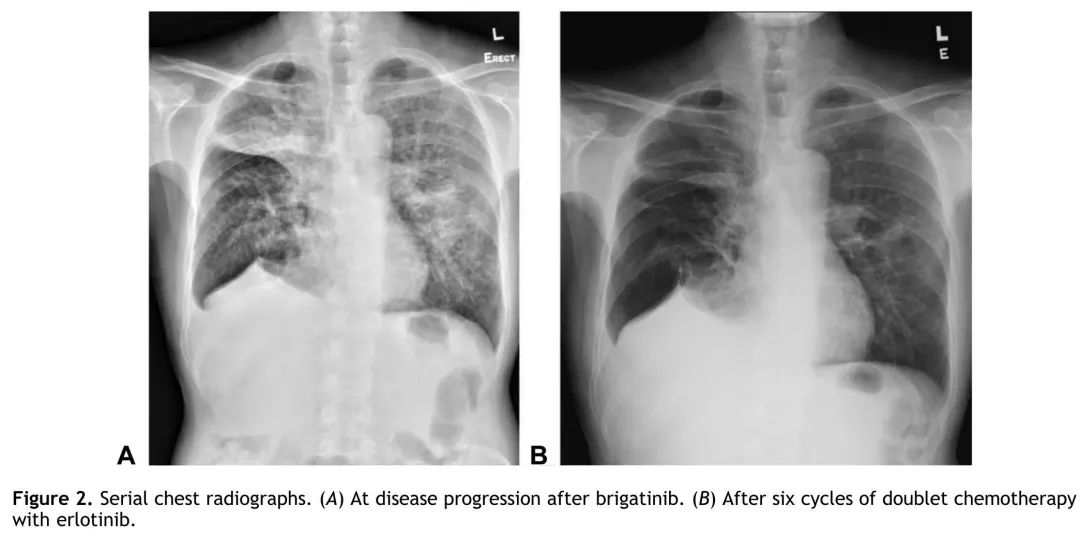
图2. 患者的胸部X光片系列。
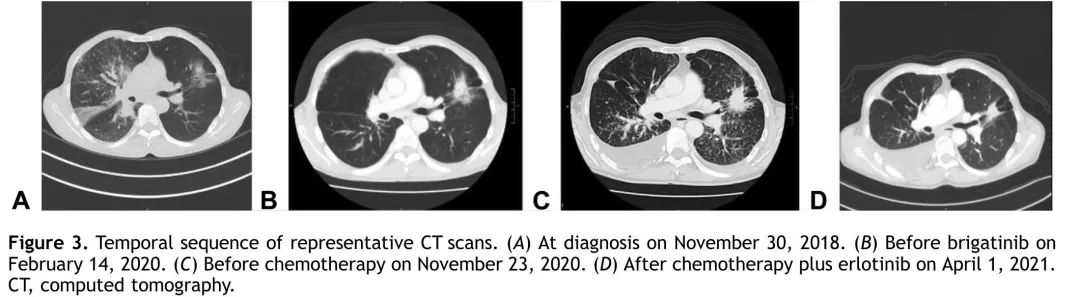
图3. 患者的影像学图像。
讨 论
本文报道了1例罕见病例,由于2种ALK抑制剂治疗ALK重排的转移性肺癌失败后,出现EGFR突变。在亚洲人群中,EGFR和ALK是NSCLC中最常见的2种可操作的驱动突变。既往文献报道在1059例多灶性肺腺癌患者中,有4.71%的患者同时携带EGFR和ALK突变。在单灶肺腺癌患者中,EGFR/ALK共突变的发生率为0.83%。
本文患者最初确诊为转移性肺腺癌,仅伴有ALK重排。然而,经过两线ALK靶向治疗后,患者疾病进展,再次活检时未发现ALK重排,却新检测到EGFR L858R突变。整个临床过程提示存在两个具有不同分子谱的独立肿瘤克隆,最初以ALK重排为主。在接受ALK靶向治疗后,最初次要EGFR驱动克隆被选择过度生长,导致随后的疾病进展。这一现象鲜有报道,但在选择最合适的治疗方案具有临床意义。使用第二代ALK抑制剂时,疾病进展通常与获得性耐药ALK突变(例如G1202R)相关,这些突变可能仅对第三代抑制剂洛拉替尼敏感。本文病例报告指出,在获得性耐药时出现了不同的致癌驱动因素(最初可能以次要克隆的形式存在),这将进一步证明在使用ALK抑制剂期间,当疾病进展时,对肿瘤进行再活检的必要性。这不仅可以提供有关ALK抑制剂的已知耐药机制的信息,而且还可能揭示意想不到的发现,如另一种驱动突变(在没有原始ALK重排的情况下),例如在本病例中,这具有重要的治疗意义。与其改用另一种ALK抑制剂,全身化疗联合或不联合其他靶向治疗将是更合理的方法。以本文患者为例,全身化疗可能控制残留的ALK驱动的肿瘤克隆,而在EGFR驱动的肺腺癌中,EGFR酪氨酸激酶抑制剂联合化疗比酪氨酸激酶抑制剂单药治疗具有更好的疾病控制率和无进展生存期。
有趣的是,本文患者在克唑替尼失败后接受布格替尼作为二线治疗,布格替尼对EGFR和ALK突变体具有双重抑制活性。在体外和体内实验中,布格替尼也被发现对携带EGFR三重突变(C797S/T790M/激活突变)的肺癌有效。尽管如此,文中布格替尼治疗时,发现EGFR突变体致敏的肿瘤生长不受控制,可能表明布格替尼单药治疗EGFR突变型肺腺癌缺乏临床活性。这也与既往报道一致,即EGFR突变型肺癌的临床有效治疗策略是抗EGFR单克隆抗体联合布格替尼,而不是使用布格替尼单药治疗。
本文患者最初确诊为携带ALK重排的转移性肺腺癌,在接受ALK靶向治疗后发生疾病进展,再活检后,确诊为携带EGFR L858R突变(无共存的ALK重排)转移性肺腺癌。该病例罕见且具有临床意义。应提倡组织再活检,以研究靶向治疗的获得性耐药,这具有诊断和治疗意义。
参考文献:
Leung JKC, Kwok WC, Leung ACF, Tsui P, Ho JCM. Emerging EGFR-mutated subclones in a patient with metastatic ALK-rearranged lung adenocarcinoma treated with ALK-targeted therapy: a case report. JTO Clin Res Rep. 2023;4:100542.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言