Nature:利用表位编辑实现靶向急性髓系白血病的免疫治疗
2023-10-13 儿童肿瘤前沿 儿童肿瘤前沿 发表于陕西省
研究团队通过对表达于 AML 肿瘤细胞以及正常造血细胞表面的分子进行表位编辑,使这些在免疫治疗过程中可能产生毒性风险,且影响正常造血重建的蛋白变成了针对 AML 治疗的潜在靶点。
急性髓细胞白血病(AML), 与正常造血干细胞或分化的髓系细胞共享大部分表面标记物,因此靶向治疗可能导致髓系正常细胞减少和抑制造血重建。另一方面,AML 的肿瘤异质性和可塑性,可能需要同时靶向多个表面抗原进行治疗,加剧了累计毒性风险。这些都限制了 CAR-T、双特异性抗体和偶联抗体药物等治疗手段在 AML 中的应用。
目前正在研发的一系列针对 AML 的免疫治疗方法均仅限于在异基因造血干细胞移植(HSCT)前使用,以到达清除残留 AML 肿瘤细胞的目的。另有研究表明,通过 CRISPR-Cas 基因敲除或外显子跳跃敲除 HSCT 供体造血干细胞的 CD33,可以降低靶向 CD33 治疗的副反应。该方法目前正在进行临床试验(NCT04849910)。尽管上述研究为 CD33 分子在非人灵长类动物的移植和髓系分化过程中的非必须性功能提供了证据,但敲除 CD33 基因对人髓系细胞功能的长期影响仍不清楚。此外,靶向非必需基因进行的免疫治疗也有可能促进肿瘤细胞通过抗原丢失或下调产生逃逸,如 CD19 CAR-T 细胞治疗后的 CD19 阴性复发或半相合 HSCT 后的 HLA 丢失。
近日,Genovese 教授团队在 Nature 上发表了题为 Epitope editing enables targeted immunotherapy of acute myeloid leukaemia 的研究论文。该文章介绍了一种利用表位基因编辑技术解决在急性髓系白血病免疫治疗中缺乏肿瘤特异性抗原的局限性。本研究中,Genovese教授团队展示了在 HSPCs 中对 FMS 样酪氨酸激酶3(FLT3,CD135)、KIT(CD117)和 IL-3 受体α亚单位(IL-3RA, CD123)的靶向表位进行精确编辑,可在不进行基因敲除的情况下使靶分子丧失抗体结合活性,从而保留生理蛋白质的表达、调控和细胞内信号传导。更重要的是,这种策略使得能够靶向一个或多个对白血病肿瘤细胞存活至关重要的基因,在获得显著的抗白血病疗效的同时将靶向/脱靶毒性风险最小化。

利用碱基编辑制备隐形受体
研究团队选择了 FLT3、KIT 和 CD123 三个靶点以及靶向上述靶点的三个单克隆抗体,利用碱基编辑技术对上述三个靶点基因进行编辑,制备隐形受体。
之后,团队评估了编辑操作是否会改变受体功能。使用荧光标记的 FLT3L、SCF 和 IL-3 分析表明,在所有测试浓度下,与野生型或改造的受体相比,配体亲和力相似(图1h)。此外,在所有测试浓度下,野生型和突变体的激活水平类似。最后,为了确认配体诱导的增殖反应是否受影响,研究团队利用 BaF3 细胞进行了激酶互补实验,野生型和表位工程改造的受体对细胞增殖的恢复能力具有相似且剂量依赖活性。研究表明,通过选择适当的 gRNA 和碱基编辑酶的组合,可以实现功能性 FLT3、KIT 和 CD123 受体的表位编辑,并获得了较高的编辑效率。
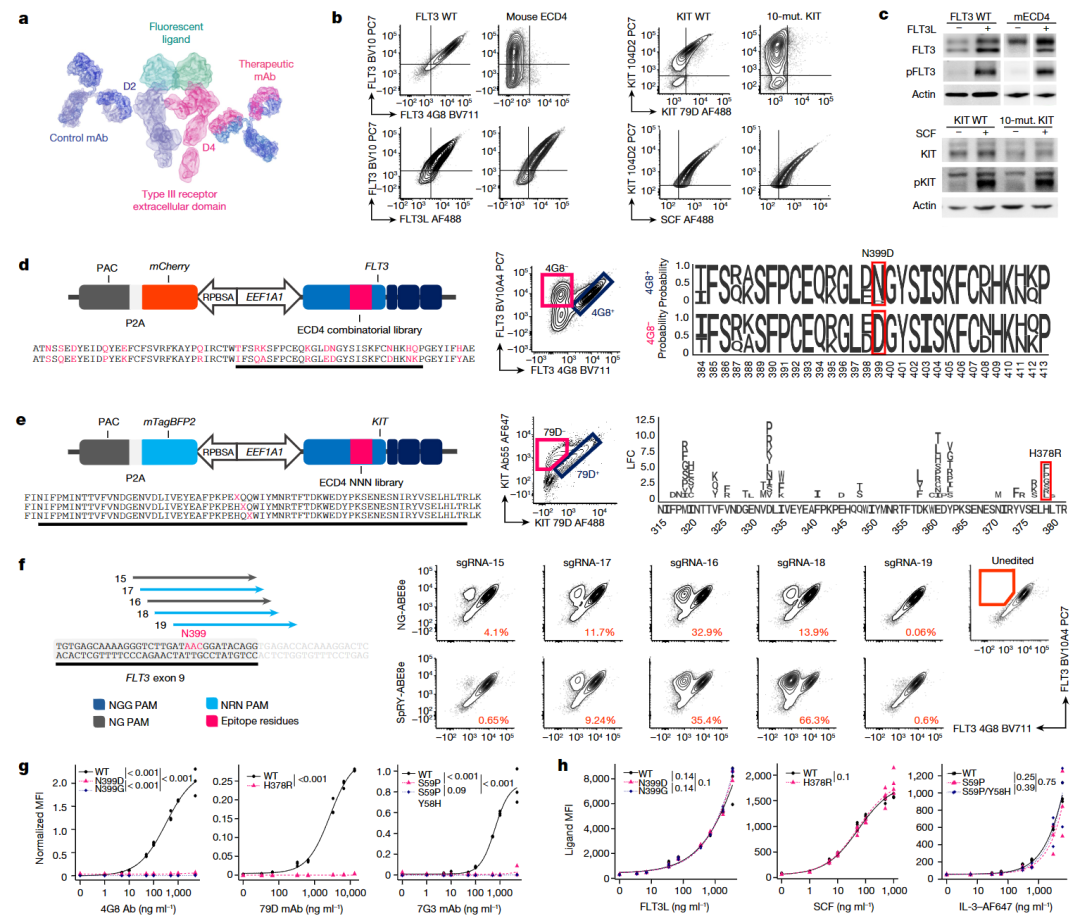
图1. 碱基编辑可实现表位基因工程化修饰
隐形受体对CAR-T细胞有抵抗力
最新的临床前研究表明,基于 4G816、Fab-79D15 或 CSL36212,35 克隆衍生的 CAR-T 细胞对 AML 具有良好的疗效。为评估表位工程化细胞对 CAR-T 细胞疗法的抵抗能力,研究人员将 4G8、Fab-79D 和 CSL362 单链可变片段克隆到第二代 CAR 分子中。通过与 K562 靶细胞进行体外共培养杀伤实验分析表明,尽管大多数表达未改造的 FLT3、KIT 或 CD123 的细胞被 CAR-T 清除,但表达表位工程化突变体的细胞对 CAR-T 介导的杀伤具有抵抗性,并且在实验结束时仍然可被检测到。
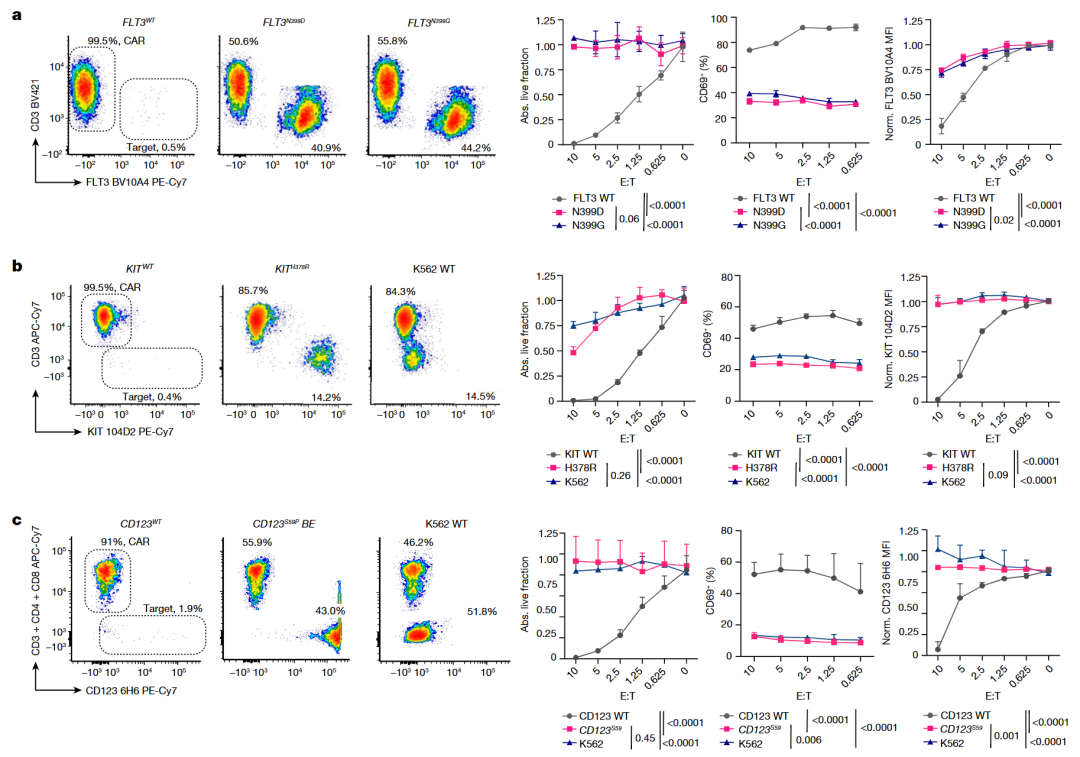
图2. 表位基因工程改造突变体对 CAR-T 细胞的杀伤具有抵抗性
对人 HSPC 的高效表位编辑
为了有效地将上述突变体受体引入人 HSPCs,团队在基于共电转导 sgRNAs 和体外转录的(IVT)SpRY-ABE8e mRNA 的外周血 CD34+ 细胞上优化了一种基因编辑方案。在优化 mRNA IVT、培养、电转导条件和编辑时间点后,在 FLT3-18、KIT-Y 和 CD123-R sgRNAs 的窗口内实现了目标腺嘌呤的编辑效率高达86.6%、78.6%和78.9%。通过 ABE 可以高效地制备表位工程化 HSPCs,并且对靶向免疫治疗具有良好的耐药性。
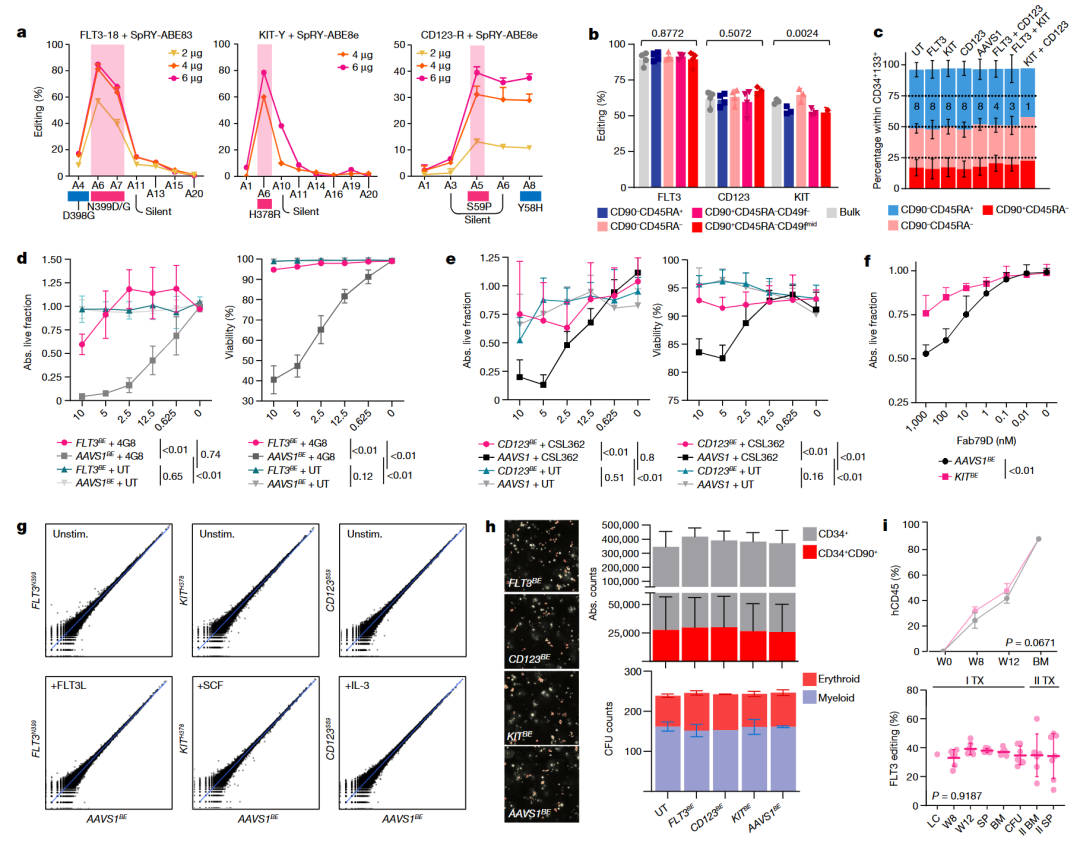
图3. 表位编辑不影响HSPC的干性和分化功能
表位编辑保留HSPC功能
为评估与表位编辑相关的转录变化,团队对编辑了 FLT3、CD123、KIT 或 AAVS1 的 CD34+ HSPCs 进行了 RNA 测序分析,这些细胞在相应的配体刺激下进行了刺激或未刺激的处理。发现无论编辑条件如何,CD34+ HSPCs 向粒细胞、巨噬细胞、经典树突状细胞、粒细胞和巨核细胞系的体外分化都是相似的,并且不会导致编辑细胞的逆选择。总之,这些数据证实了 HSPCs 中的表位编辑不会影响受体信号传导、干细胞分化能力以及其特定细胞系的功能性。
表位编辑的脱靶效应
由于使用 SpRY-Cas9 可能导致潜在的离靶效应,研究人员通过结合全基因组无偏向靶点鉴定(GUIDE-seq)和离靶预测的计算机模拟进行了特异性分析。结果显示 FLT3、CD123 和 KIT 表位编辑在 CD34+ HSPCs 中具有安全的遗传毒性特征。
FLT3BE 在体内具有 4G8 CAR 抵抗性
为评估 FLT3 CAR T 细胞是否能有效清除 AML,同时保留 FLT3 编辑造血功能,团队将 CD34+ HSPCs(FLT3BE 或 AAVS1BE)和人源 AML 细胞系移植(PDX-1,具有 MLL-AF9 和 FLT3-ITD)依次移植到 NBSGW 小鼠中建立肿瘤模型,该模型经过报告基因转导以便在混合造血系统中进行检测。总体而言,在 NBSGW 模型中,FLT3 阳性的 CAR-T 细胞优先清除B细胞和祖细胞亚群(GMPs、LMPPs),而 FLT3N399 表位编辑对这些亚群提供了保护。
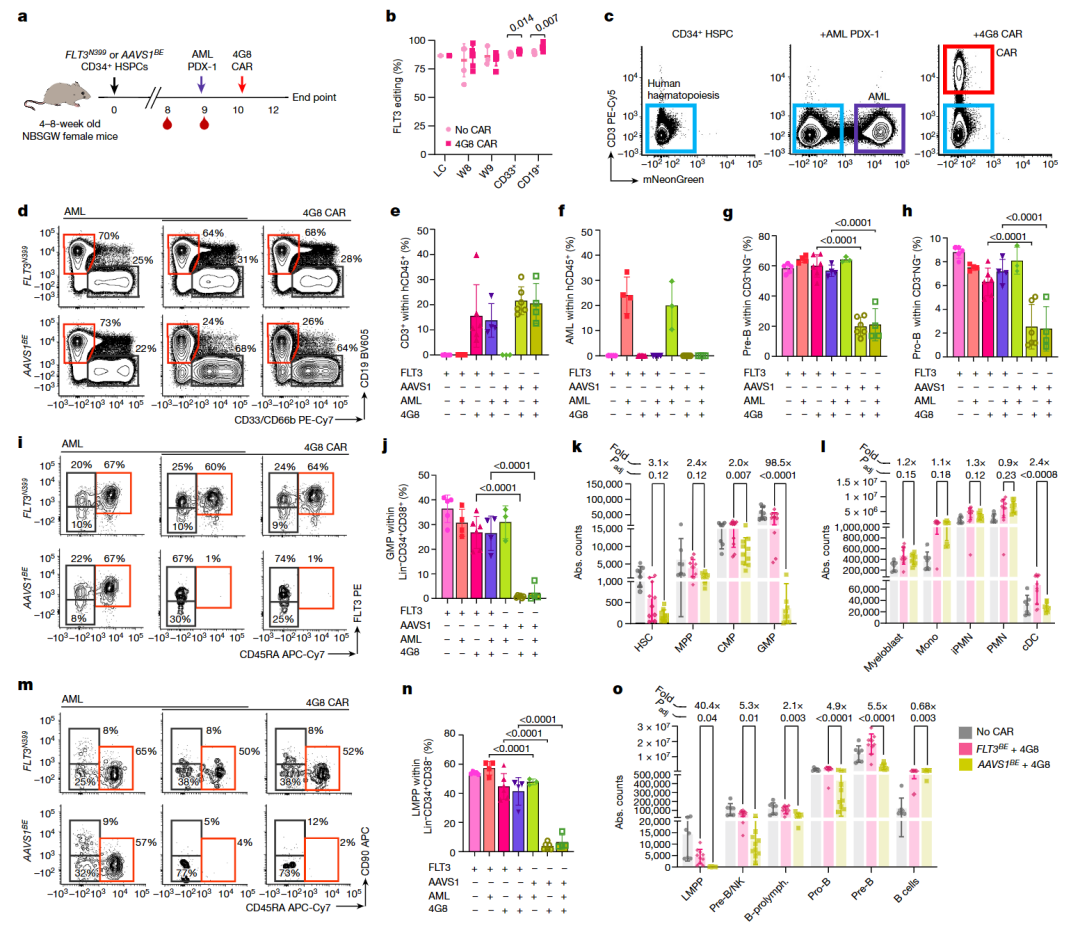
图4. 4G8-CAR 清除AML PDX,同时保留 FLT3N399 HSPC 的子代细胞
CD123BE造血系统对CD123 CAR-T的抵抗性
与 FLT3 编辑类似,研究人员将 CD123S59 HSPCs 移植到 NBSGW 小鼠中,并证明其移植存活和多系列再生能力与 AAVS1BE HSPCs 相似,且具有高比例和稳定的编辑细胞。数据显示,CD123 CAR-T细胞对CD123S59表位编辑的细胞造血系统的靶向毒性减少,否则会导致髓系亚群和树突状细胞的减少以及造血细胞绝对计数的总体降低。
多重编辑可有效清除AML肿瘤
研究人员推测,编辑两个或更多表位有可能通过同时靶向多个 AML 抗原来获得更有效的免疫治疗效果。为了获得对多种 CAR-T 细胞疗法的保护的概念验证,团队在双报告基因或三报告基因的 K562 细胞上共同编辑了2个(FLT3和CD123)或3个(FLT3、KIT和CD123)靶点,并将分选的单编辑、双编辑或三编辑细胞与双特异性或三特异性 CAR-T 细胞共培养。2天后,只有双表位或三表位编辑的细胞在双特异性或三特异性 CAR 介导的杀伤中存活下来。
为了获得确凿的证据,证明双重编辑的 HSPCs 对联合 CAR-T 细胞疗法具有抵抗性,团队将双重 FLT3N399CD123S59 表位编辑的 HSPCs 或 AAVS1BE 对照移植细胞到 NBSGW 小鼠中。在确认多系移植成功并注射 AML PDX-2 细胞后,研究人员用 4G8 和 CSL362 CAR-T 细胞(1:1共同输注)治疗小鼠(图5d),双重 CAR-T 细胞回输能够完全清除 BM 和脾脏中的 AML 细胞(图5d,e)。FLT3N399CD123S59 编辑的细胞持续存活直到实验终点,并且在淋巴细胞和髓系细胞中均能检测到(图5f)。总之,这些数据证明了多重表位编辑可以在 HSPCs 中高效实现,并且能够实现具有减少多重靶向/肿瘤造血毒性的强效多靶点免疫疗法的概念验证。
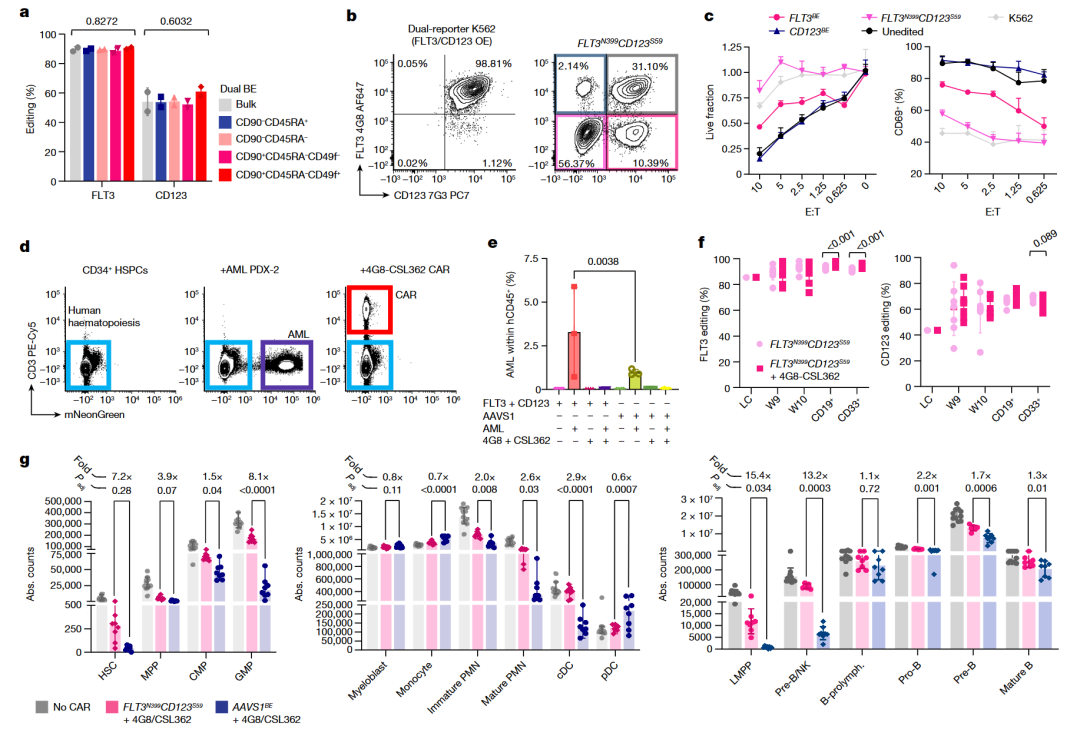
图5. FLT3/CD123 双表位编辑可实现更有效的 AML免疫效果
综上所述,研究团队通过对表达于 AML 肿瘤细胞以及正常造血细胞表面的分子进行表位编辑(FLT3,KIT,CD123),使这些在免疫治疗过程中可能产生毒性风险,且影响正常造血重建的蛋白变成了针对 AML 治疗的潜在靶点。利用 CAR-T 和抗体进行靶向治疗时,可以有效的清除表达上述靶点的肿瘤细胞,但是不影响表达上述靶点的正常细胞,同时还可以实施多靶点协同治疗,有效的克服了肿瘤免疫治疗药物在治疗AML过程中对正常细胞产生的免疫毒性。
另一方面,经过该技术修饰后的造血细胞在治疗后不受免疫治疗药物的影响,其获得的抵抗性可以有效重建造血系统,更有利于治疗后正常免疫系统的重建,进而降低复发的风险。此外,如果表位编辑与其他治疗性碱基编辑方法结合,通过输注单克隆抗体、抗体-药物偶联物或双特异性T细胞结合剂,可以在体内逐渐富集基因修饰的自体细胞。总之,当靶向/非肿瘤毒性是成功临床转化的关键限制因素时,HSPCs 的表位编辑可以实现更安全、更有效的免疫治疗。
DOI: 10.1038/s41586-023-06496-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











