Nature Metabolism:复旦大学汤其群/上海体育学院郭亮揭示促进脂肪分解的半胱氨酸双加氧酶的全新调控机制
2022-10-19 iNature iNature
这项研究发现了Cdo1在控制肥胖中的关键作用,并揭示了一个意想不到的涉及Cdo1的脂肪分解的转录调控机制。
脂肪组织可以大致分为三种类型:白色脂肪组织(white adipose tissue, WAT)、棕色脂肪组织(brown adipose tissue, BAT) 和米色脂肪组织。WAT以TGs的形式储存能量。BAT由多室脂滴和大量含有解偶联蛋白-1 (uncoupling protein-1, UCP1)的线粒体组成,增加了产生热量的能量消耗。大型哺乳动物在婴儿期后往往会失去大量的BAT。米色脂肪细胞是一簇UCP1阳性的多房脂肪细胞,可由寒冷暴露或运动诱导,人类有大量的这种细胞。棕色和米色脂肪细胞都能帮助生物体增加能量消耗。因此,促进棕色和米色脂肪细胞的活性和数量可能有助于对抗肥胖。
脂肪分解是指TGs被水解成甘油和游离脂肪酸的过程。它可以分为三个步骤。首先,TGs被脂肪甘油三酯脂肪酶(adipose triglyceride lipase, ATGL)分解为二酰基甘油(diacylglycerol, DAG)和游离脂肪酸。然后,DAG被激素敏感脂肪酶(hormone-sensitive lipase, HSL)水解为单酰甘油(monoacylglycerol, MAG)和游离脂肪酸(FFAs)。最后,MAG被转化为甘油和FFAs。在脂聚酶中,ATGL是脂分解的限速酶。越来越多的证据表明,过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ, PPARγ)在脂肪组织中富集。它是脂肪细胞分化的关键调控因子,参与ATGL和HSL的转激活。

2022年10月17日,复旦大学汤其群团队与上海体育学院郭亮团队合作在Nature Metabolism 杂志在线发表题为“Cdo1 promotes PPARγ-mediated adipose tissue lipolysis in male mice”的研究论文,该研究发现Cdo1促进脂肪组织中的脂肪分解。小鼠脂肪特异性敲除Cdo1会损害能量消耗、耐寒性和脂肪分解,加剧饮食诱导肥胖(diet-induced obesity, DIO),并降低编码ATGL和HSL的关键脂聚基因的脂肪表达,但对脂肪牛磺酸水平影响不大。白色脂肪特异性过表达ATGL和HSL会减弱脂肪Cdo1缺陷促进DIO的作用。因此,这项研究发现了Cdo1在调节脂肪分解中的一个意想不到的重要作用。
该研究采用脂肪组织特异性敲除Cdo1 (Cdo1AKO)和脂肪特异性过表达Cdo1 (Cdo1TG)的雄性小鼠来确定脂肪Cdo1的功能作用。结果表明,Cdo1AKO小鼠产热能力受损,能量消耗下降,并表现出更严重的DIO和肥胖相关疾病。RNA测序分析显示,高脂饲料(high-fat diet, HFD)喂养的Cdo1AKO小鼠腹股沟WAT中脂肪分解途径相关基因表达水平显著降低。
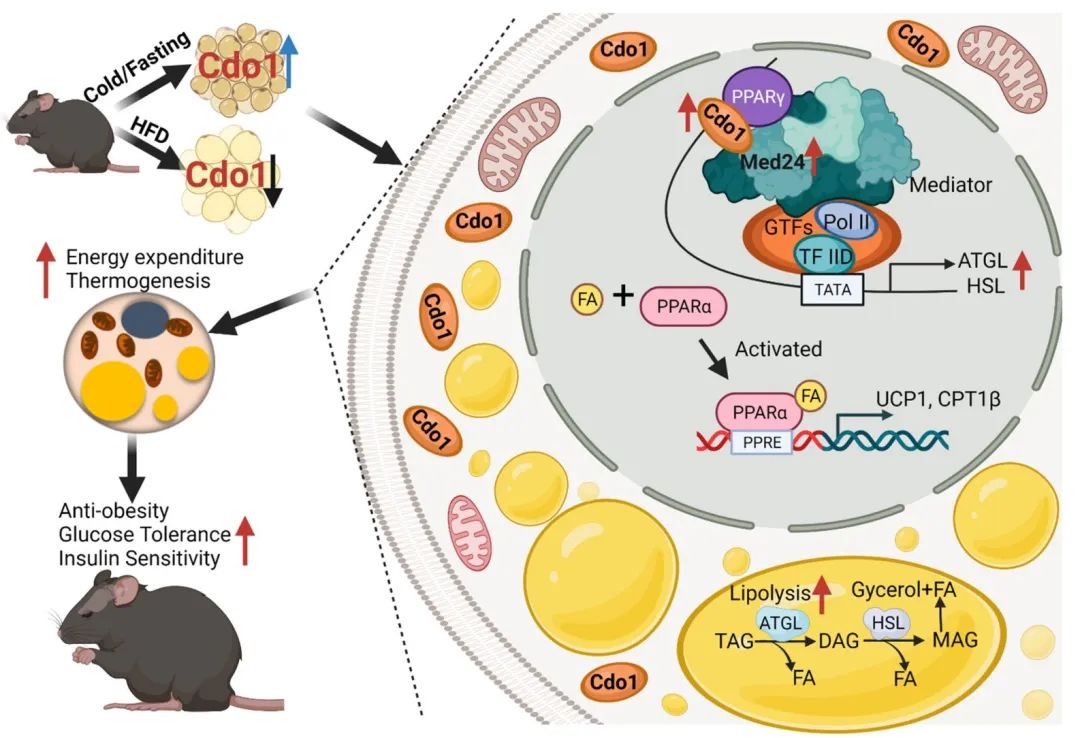
脂肪Cdo1介导的脂肪分解的机制模型(图源自Nature Metabolism )
有趣的是,Cdo1被发现与PPARγ相互作用,促进中介复合体的核心亚基Med24的募集到ATGL和HSL基因启动子上,从而激活它们的表达。腺相关病毒(AAV)介导的ATGL和HSL脂肪特异性过表达消除了脂肪组织中Cdo1消融介导的观察到的表型。相反,脂肪特异性过表达Cdo1促进小鼠的耐寒性、能量消耗、ATGL和HSL的表达和脂肪组织的脂肪分解,改善肥胖和相关代谢障碍。
综上所述,这项研究发现了Cdo1在控制肥胖中的关键作用,并揭示了一个意想不到的涉及Cdo1的脂肪分解的转录调控机制。
原文链接:
https://www.nature.com/articles/s42255-022-00644-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







