晚期肺癌检出BRCA突变,使用铂类化疗和PARP抑制剂疗效如何?
2023-11-04 苏州绘真医学 苏州绘真医学 发表于上海
本研究旨在评估在哈达萨医疗中心(HMC)接受治疗的携带BRCA突变的NSCLC患者的特征和临床结局。
BRCA突变在NSCLC中的致癌作用和临床相关性尚不清楚。本研究旨在评估在哈达萨医疗中心(HMC)接受治疗的携带BRCA突变的NSCLC患者的特征和临床结局。回顾性评估了所有接受二代测序(NGS)并发现具有体细胞致病性BRCA突变(p-BRCA)的晚期NSCLC患者。同年龄、分期、性别、吸烟、PD-L1和驱动突变匹配的BRCA野生型(wt-BRCA)NSCLC患者的临床结局进行比较。回顾了2015年至2022年期间598例进行NGS检测的晚期NSCLC患者,发现26例携带p-BRCA,其中17例(65.4%)携带胚系BRCA突变,占HMC所有BRCA携带者的1%。中位诊断年龄为67岁(40-78岁),13例患者(50%)有吸烟史,9例患者(34.6%)有其他驱动突变(EGFR,ALK,BRAF,MET或ERBB2)。p-BRCA组一线铂类化疗的客观缓解率和中位无进展生存期(PFS)分别为72.2%和16个月(CI 95%,5-22),而wt-BRCA对照组为47.4%和7个月(CI 95%,5-9),PFS HR为0.41(CI 95%,0.17-0.97)。p-BRCA组中6例患者接受后线PARPi治疗,4例患者(66%)获得持久缓解。在该队列中,携带p-BRCA的NSCLC患者表现出对PARPi的高度敏感性和对铂类药物的持久反应,提示BRCA突变在 NSCLC中起着一定的致癌作用。研究结果支持开展PARPi治疗p-BRCA NSCLC的前瞻性试验。
研究背景
抑癌基因BRCA1/2对于DNA双链断裂的同源重组修复很重要。BRCA1/2致病性变异(PV)携带者发生BRCA相关恶性肿瘤,包括乳腺癌、卵巢癌、胰腺癌和前列腺癌的风险增加。携带BRCA1/2致病性突变的肿瘤对聚腺苷二磷酸核糖聚合酶抑制剂(PARPi)和铂类化疗(PBC)高度敏感。
局部晚期和转移性非小细胞肺癌(NSCLC)具有侵袭性,5年总生存率(OS)低于10%。在约2%的NSCLC病例中发现体细胞致病性或可能致病性BRCA1/2突变(p-BRCA),其中大多数与BRCA PV携带者无关。此外,只有约1%的BRCA携带者发生NSCLC,与一般人群的发病率相似。大多数p-BRCA NSCLC患者有吸烟史,其他恶性肿瘤病史有限,诊断时处于转移性或晚期,组织学类型为腺癌。PBC仍然是NSCLC一线治疗的基础,没有预测NSCLC对PBC反应的标志物。PARPi对NSCLC的疗效有限。因此,在NSCLC中,p-BRCA对肿瘤发生发展的作用和对治疗反应的预测作用尚不清楚,对于新诊断的NSCLC病例,BRCA1/2突变检测不被认为是必须的分子检测。
我们之前报道了一项病例系列研究,纳入了10例BRCA1/2胚系或体细胞突变的晚期NSCLC患者,这些患者对PBC的敏感性较高,总生存期较长。本研究旨在进一步评估在我中心接受治疗的p-BRCA NSCLC患者的特征和临床结局。本研究扩展队列包括26例p-BRCA NSCLC患者,更详细地描述了其遗传特征和临床结局。重要的是,我们发现这些患者表现出对PARPi的高度敏感性和对PBC的持久反应,提示BRCA突变至少在一部分患者中有致癌作用。
研究结果
回顾性评估了2015年1月至2022年12月期间在哈达萨医疗中心(HMC)接受治疗,进行了肿瘤组织或液体ctDNA NGS检测(Foundation-one©等)并发现p-BRCA的局部晚期(IIIB期或IIIC期)或转移性NSCLC患者。分析仅纳入了根据ClinVar或Varsom分类为致病性或可能致病性BRCA1/2突变,接受至少3个月治疗,随访至少1年的存活患者或更短时间的死亡患者。如果患者独立胚系检测检出PV或ctDNA检测显示突变丰度(VAF%)≥40%,则确定为BRCA1/2携带者。从患者记录中获取人口统计学特征、个人和家族病史、病理和遗传结果以及治疗和临床结局数据。
患者特征
回顾了2015年至2022年期间进行组织(513例患者)或ctDNA(85例患者)NGS检测的598例局部晚期或转移性NSCLC患者。36例患者(6.0%)携带p-BRCA。其中,26例患者接受了至少3个月的治疗,有足够的≥1年(存活患者)或更短(死亡患者)的随访数据,被纳入最终分析。17例患者(65.4%)确认为相应胚系BRCA1/2 PV携带者,约占HMC所有登记的BRCA1/2携带者的1%(17/1641),其中14例(53.8%)为经典德系犹太人PV(BRCA2 617delT,BRCA1 185delAG或BRCA1 5382insC)携带者。
诊断时的中位年龄为67岁(范围40-78),只有13例患者(50%)有吸烟史,9例患者(34.6%)有其他恶性肿瘤病史,主要是乳腺癌。24例患者(92.3%)病理显示腺癌,9例患者(34.6%)存在其他可靶向驱动突变(EGFR,ALK,BRAF,MET或ERBB2)。2例BRCA携带者(7.7%)存在额外的BRCA1/2体细胞致病性突变。
从598例进行NGS检测的NSCLC患者中,根据诊断年龄、诊断分期、性别、吸烟状况、PD-L1组和主要驱动突变,找到了与p-BRCA组匹配的26例wt-BRCA患者(表1)。wt-BRCA组的中位诊断年龄为68.5岁(范围40-79),13例患者有吸烟史,只有3例患者(88.5)有其他恶性肿瘤病史。25例患者(96.2%)病理显示腺癌,9例患者(34.6%)存在其他可靶向驱动突变(EGFR,ALK,BRAF,MET或ERBB2)(表1)。
表1. 2015年1月至2022年12月,在哈达萨医疗中心接受治疗的BRCA1/2体细胞致病性突变(p-BRCA)局部晚期或转移性非小细胞肺癌患者,以及匹配的(根据年龄、分期、性别、吸烟状况、PD-L1和其他驱动突变)BRCA野生型(wt-BRCA)对照组的临床特征。
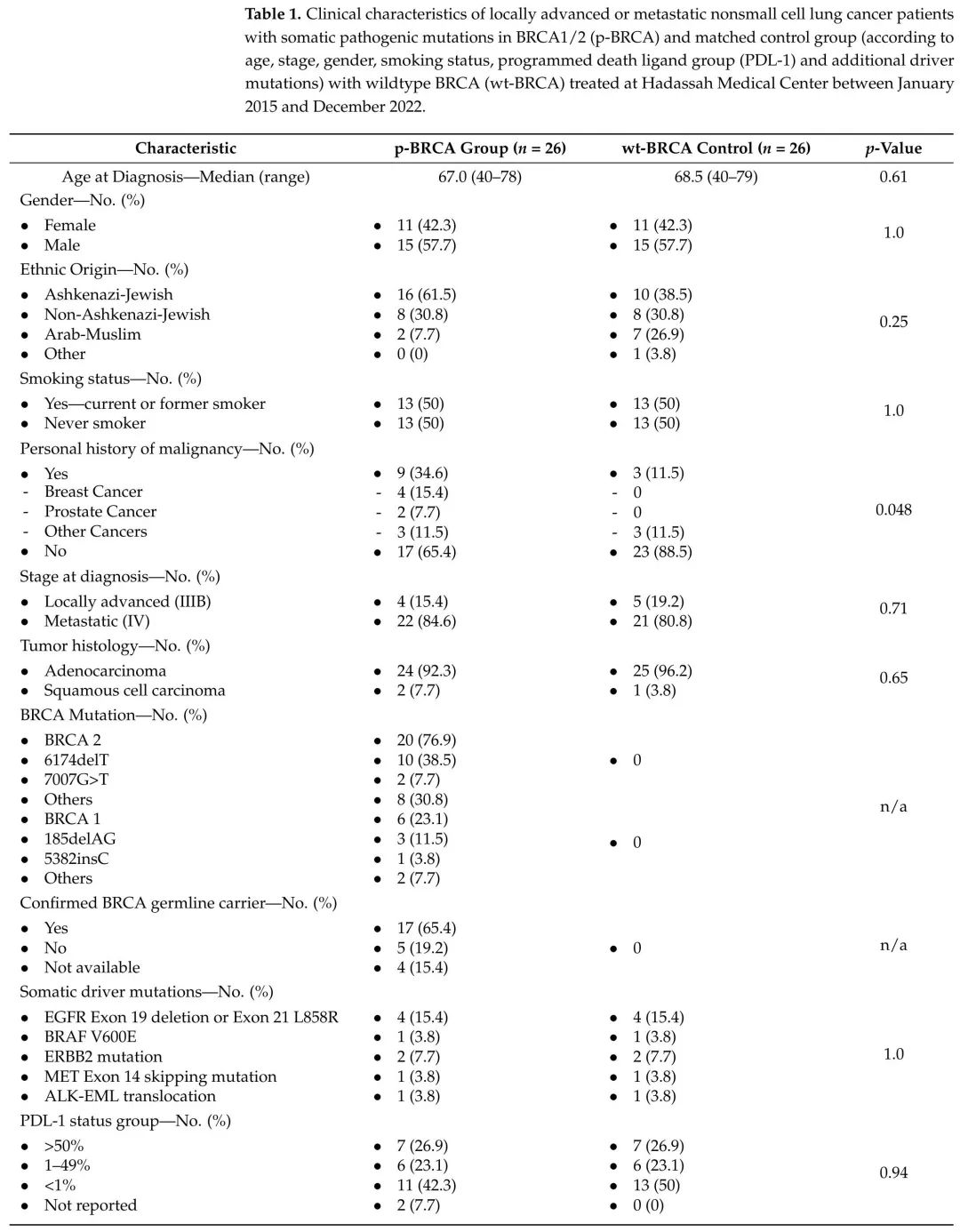
治疗和临床结局
在p-BRCA组和wt-BRCA组中,一线治疗的年龄、分期、性别、吸烟、PD-L1状态、驱动突变和肿瘤组织学是平衡的。局部晚期疾病(IIIB 期)患者均接受PBC同步根治性放疗。每组中有6例患者(23.1%)接受了一线EGFR、ALK或BRAF突变靶向治疗。p-BRCA组10例患者(42.3%)、wt-BRCA组14例患者(53.8%)接受了一线免疫联合PBC治疗(表1)。
p-BRCA组中18例患者(69.3%)无EGFR、ALK或BRAF突变,接受一线PBC治疗,客观缓解率(ORR)为72.2%,中位PFS为16个月(CI 95% 5-22),而在wt-BRCA对照组中,ORR为47.4%,中位PFS为7个月(CI 95%,5–9),PFS HR为0.41(CI 95% 0.17–0.97,p = 0.04)(表2和图1)。

图1. BRCA1/2致病性突变(p-BRCA)局部晚期或转移性非小细胞肺癌患者vs匹配的BRCA野生型(wt-BRCA)对照组的铂类化疗无进展生存期、
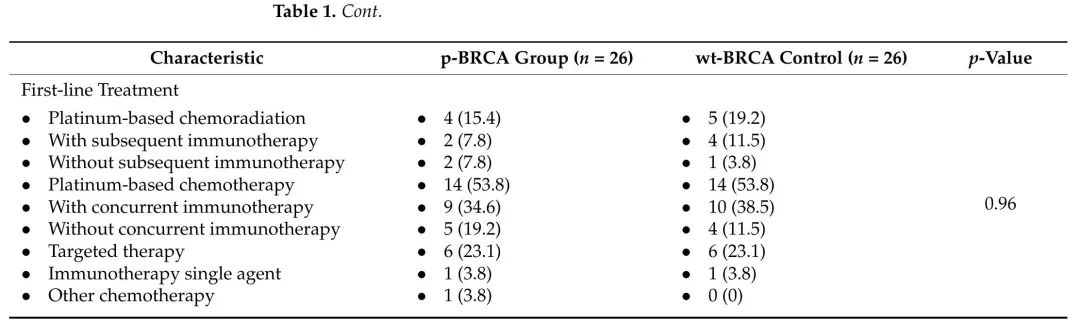
表2. 2015年1月至2022年12月,在哈达萨医疗中心接受一线铂类化疗(PBC)的BRCA1/2体细胞致病性突变(p-BRCA)局部晚期或转移性非小细胞肺癌患者,以及匹配的BRCA野生型(wt-BRCA)对照组的临床特征、最佳肿瘤反应和中位无进展生存期。值得注意的是,所有接受一线PBC治疗的患者都没有ALK、EGFR或BRAF突变。
p-BRCA组中6例患者(23.1%)接受了二线或三线PARPi治疗,4例患者(66.6%)获得客观缓解,中位PFS为13个月(范围6-36),2例患者获得3年的持久缓解(图2)。这6例患者的中位年龄为65.5岁(范围54-75),均患有腺癌,没有其他驱动突变,在PBC后均出现疾病进展,其中3例患者在PARPi治疗前有中枢神经系统进展。
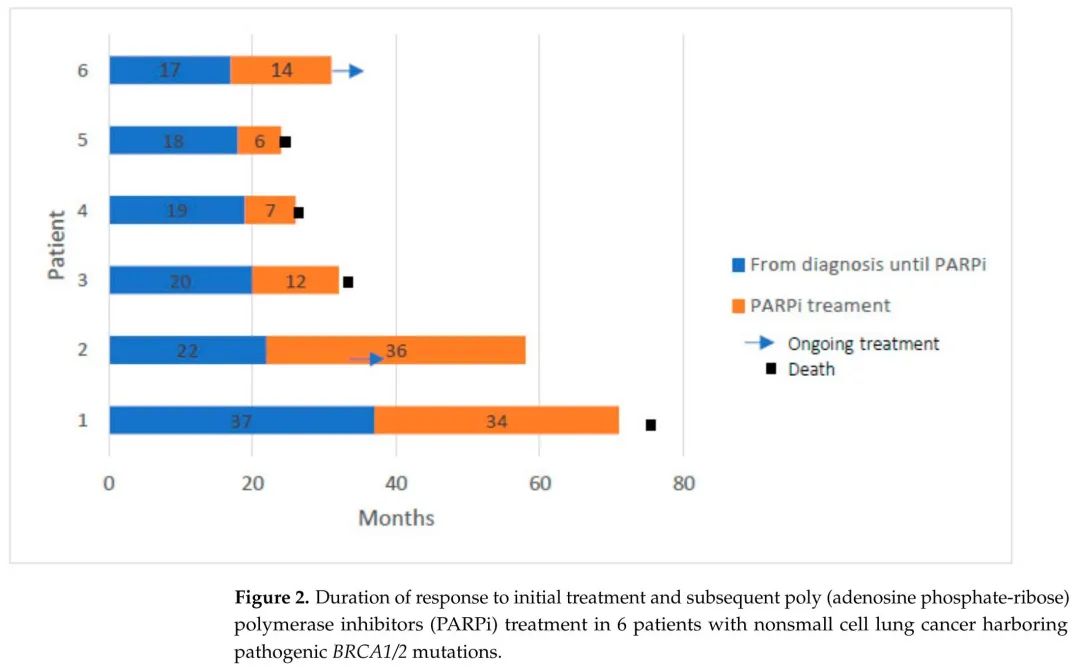
图2. 6例携带致病性BRCA1/2突变的非小细胞肺癌患者初始治疗和随后PARPi治疗的缓解持续时间
p-BRCA组的中位OS为22.5个月(CI 95% 12-34),而wt-BRCA组为13.0个月(CI 95% 12-14),OS HR为0.81(CI 95% 0.39–2.11)。诊断3年后,p-BRCA组中有8例患者(30.8%)存活,而wt-BRCA组中有3例患者(11.5%)存活(图3)。
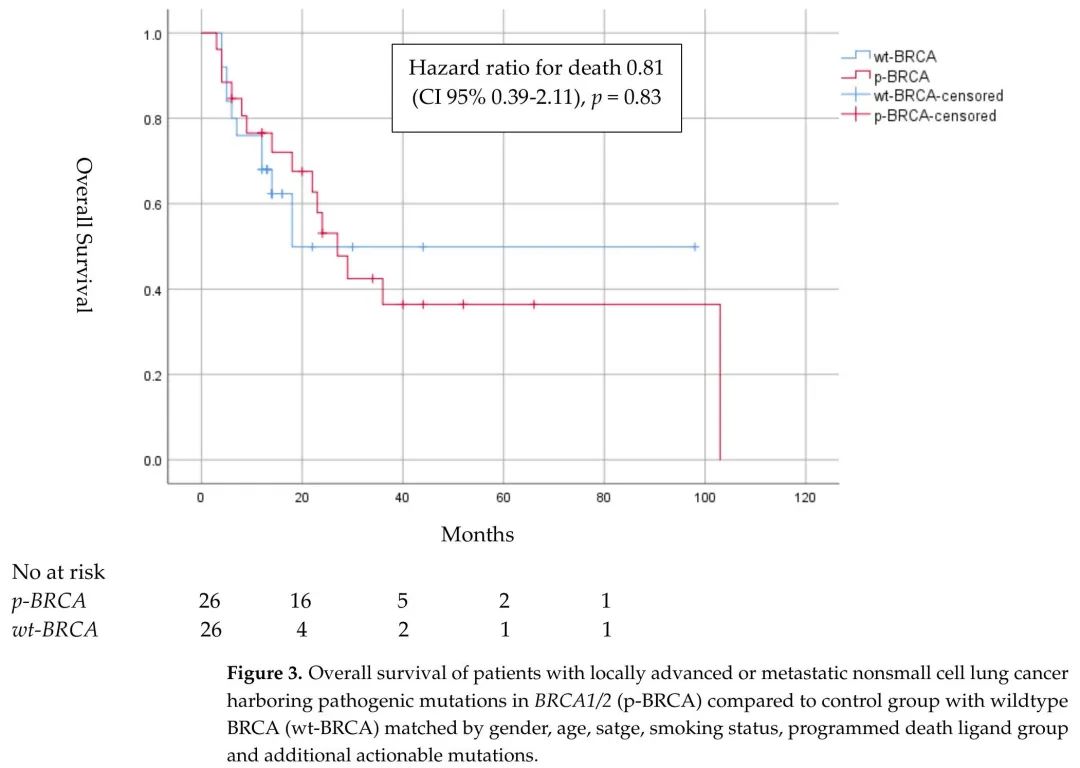
图3. BRCA1/2致病性突变(p-BRCA)局部晚期或转移性非小细胞肺癌患者vs匹配的BRCA野生型(wt-BRCA)对照组的总生存期
讨 论
本研究分析了26例BRCA1/2突变NSCLC患者的临床和遗传特征,发现其对PBC和PARPi的敏感性较高。在我们的数据库中,p-BRCA NSCLC患者在所有NSCLC患者中的占比大约是大规模分子研究和cBioPortal数据库报告的3倍。这可能是由于我中心德系犹太人人群比例较高,德系犹太人人群的携带者比例约为2.5%。本研究中,53.8%的患者是经典德系犹太人PV携带者,本研究中NSCLC患者p-BRCA频率与最近发表的445例在不同的以色列中心接受治疗的NSCLC患者队列相似。HMC的BRCA携带者中只有1%发生NSCLC,加上诊断年龄相对较大(中位67岁),这与既往研究结果一致,提示BRCA携带者发生NSCLC的风险并未增加。然而,值得注意的是,在我们的队列中,较高比例(13/26)的患者为非吸烟者,其中大多数是BRCA携带者,这与先前的研究结果有很大不同,先前的研究显示,大多数p-BRCA NSCLC患者是吸烟者和非BRCA携带者。因此,一般人群患肺癌的相对风险主要受吸烟的影响,本研究结果提示,BRCA突变可能在NSCLC的发生发展中起一定作用,也许对非吸烟者更重要。
值得注意的是,本研究中,9例患者(34.6%)具有致癌驱动突变。在约15-20%的NSCLC患者中发现致癌驱动突变,在非吸烟晚期腺癌中这一比例更高。在高达50%的携带驱动突变的NSCLC病例中,尤其是EGFR突变肿瘤中,抑癌基因如TP53、RB1、LKB1或BRCA1/2共突变被描述为早期克隆选择的表现。因此,本研究中致癌驱动突变的患者比例相对较高,可归因于以下事实:4例患者(15.4%)具有致癌驱动突变,具有de-novo体细胞致病性BRCA共突变,不是BRCA携带者,以及诊断时非吸烟晚期腺癌患者比例较高。抑癌基因共突变会影响肿瘤增殖和微环境,并导致对靶向治疗的获得性耐药,造成携带驱动突变和TSG共突变的NSCLC预后相对较差。然而,在我们队列中,p-BRCA组中6例携带EGFR、ALK或BRAF驱动突变的患者接受了一线靶向治疗,均对治疗有反应,PFS为23个月(范围12-30),这对体细胞BRCA突变是否会影响对靶向治疗的反应提出了疑问。
为了分析p-BRCA NSCLC患者对PBC的反应和生存状况,我们仔细筛选了一组具有相似临床和病理特征的wt-BRCA患者。p-BRCA患者PBC治疗的PFS和缓解率显著优于wt-BRCA对照组[中位PFS:16个月(CI 95% 5-22)vs 7个月(CI 95%,5-9),HR 0.41(CI 95% 0.17–0.97,p = 0.04);ORR:72.2% vs 47.4%(p = 0.12)]和一线铂类化疗联合免疫治疗相关试验结果,如Keynote-189(ORR 47.6%,中位PFS 8.8个月)和9LA(ORR 38%,中位PFS 6.7个月)。值得注意的是,PD-L1状态和一线联合免疫治疗情况在两组之间较平衡,因此免疫治疗的混杂效应较小,因为将免疫治疗加入一线PBC治疗,与PD-L1状态相关,对ORR和PFS均有显著影响。
重要的是,p-BRCA组中6例患者接受了后线PARPi治疗,4例患者肿瘤缓解,2例患者获得约3年的持久缓解。值得注意的是,这6例患者一线PBC治疗的PFS较长,缓解率较高,这与最近发表的PIN研究一致,该研究中,对一线PBC有反应的NSCLC患者获益于PARPi维持治疗。p-BRCA组和wt-BRCA组的中位OS差异明显但不具有统计学意义,可能是由于样本量较小,异质性队列中很多患者接受了一线ALK、EGFR或BRAF靶向治疗,且一半的患者在数据分析时仍然活着。
一个重要的问题是,在NSCLC病例中,BRCA突变是否在肿瘤发生发展中起作用,作为致癌驱动因素。在BRCA相关恶性肿瘤中,肿瘤的发生取决于双等位基因失活、额外的体细胞突变或杂合性缺失(LOH),可以通过同源重组缺陷特征(HRD)来评估。这些改变可以预测肿瘤对PBC和PARPi的敏感性(通过合成致死)。这种HRD表型不被认为是非BRCA相关恶性肿瘤的典型特征,提示在这些肿瘤中,BRCA具有中性致癌作用。然而,最近对两个大型泛癌数据库(Foundation©和TCGA©)的分析显示,至少20-25%的BRCA突变NSCLC患者,以及2例铂类化疗引起BRCA回复突变的患者,存在LOH和HRD表型,提示在NSCLC中,BRCA突变至少具有部分致癌作用。此外,野生型BRCA等位基因的表观遗传沉默可能对肿瘤的发生及其对治疗的反应有功能意义,如最近BRCA携带者血液特异性micro-mRNA谱研究所示,提示一个BRCA等位基因缺陷也可能足以诱导肿瘤发生。
在我们的队列中,p-BRCA患者表现出对PBC和PARPi较高的敏感性,这支持了这样的假设:至少在某些NSCLC病例中,BRCA突变起着致癌作用,并且可以预测对这些治疗的反应。这些结果也与最近Tschernichovsky等人发表的研究一致,该研究显示,与机构队列相比,7例携带BRCA突变的NSCLC患者一线治疗PFS较长。我们队列中,2例BRCA携带者具有额外的体细胞BRCA突变,肿瘤组织样本进一步HRD检测,特别是在对PBC和PARPi敏感的患者中,可能揭示BRCA突变在NSCLC中的作用。此外,HRD检测的更广泛可及性提示,该检测可能有助于选择p-BRCA NSCLC患者进行PARPi治疗,PARPi治疗p-BRCA NSCLC的前瞻性试验似乎是有必要的。
本研究有几个局限性。由于样本量小和回顾性设计,在解释研究结果时需谨慎。虽然p-BRCA和wt-BRCA组在人口统计学、预测因素和治疗类型方面较平衡,但缺乏其他重要因素,如体能状态,这些因素可能影响结果。最后,分子检测依赖于多种商业panel和方法(ctDNA和肿瘤组织)。另一方面,使用经过验证的数据库仔细确定变异致病性,并使用独立的胚系检测或高ctDNA VAF%确定携带者状态。
在该队列中,p-BRCA NSCLC患者表现出对PARPi的高度敏感性和对PBC的持久反应。此外,这些患者具有独特的临床特征,包括非吸烟者和具有其他驱动突变的患者比例较高。虽然样本量小,具有局限性,但研究结果表明,BRCA突变在NSCLC中起致癌作用,可以预测对PBC和PARPi的反应。这些结果支持开展前瞻性试验,对NSCLC患者使用NGS panel检测BRCA1/2突变,对p-BRCA患者和发生NSCLC的BRCA携带者予以PBC和PARPi治疗。需要进一步的分子检测,特别是HRD特征,来确定p-BRCA在NSCLC中的确切致癌作用。
参考文献:
Arnon J, Tabi M, Rottenberg Y, Zick A, Blumenfeld P, Hamburger T, Pikarsky E, Avraham E, Levine L, Popovtzer A, Yablonski-Peretz T, Kadouri L, Nechushtan H. Clinical Characteristics, Response to Platinum-Based Chemotherapy and Poly (Adenosine Phosphate-Ribose) Polymerase Inhibitors in Advanced Lung Cancer Patients Harboring BRCA Mutations. Cancers (Basel). 2023 Sep 26;15(19):4733. doi: 10.3390/cancers15194733. PMID: 37835426; PMCID: PMC10571558.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言