Cell Reports (8.8): 人们爱吃“高糖高油”的原因找到了!糖吃多了,会增加对脂肪的渴望,反之亦然
2024-02-07 网络 网络 发表于上海
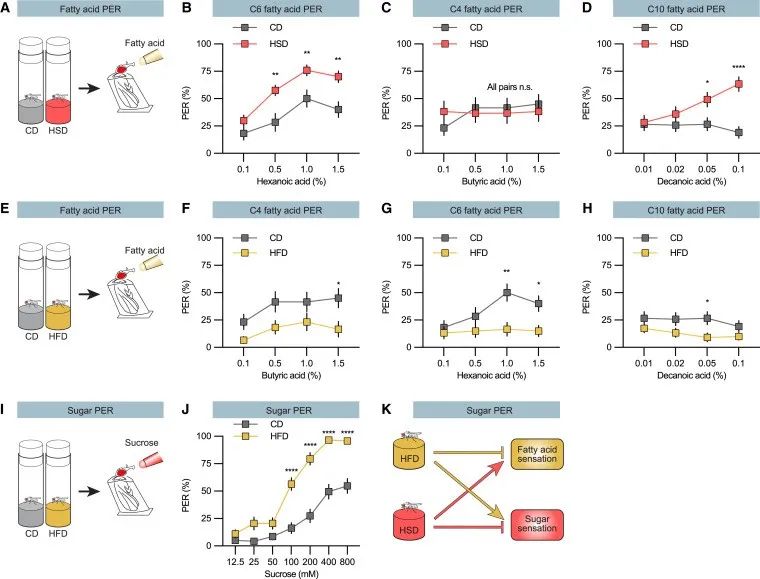
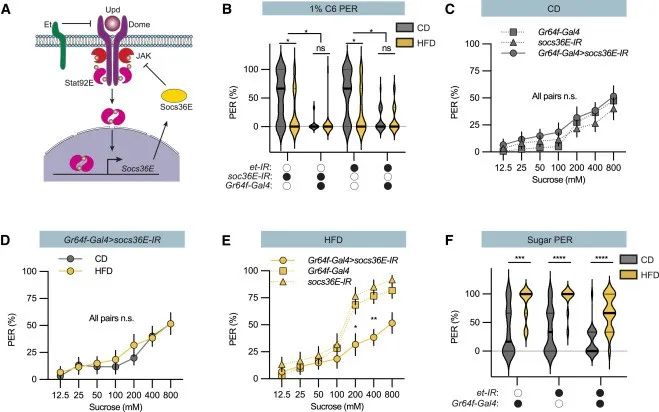
近日,瑞典于默奥大学的研究人员在Cell子刊Cell Reports(8.8)上发表研究成果,以果蝇为研究对象,表明摄入的糖和脂肪会调节味觉——过度糖分摄入会抑制对甜食的渴望,增加脂肪的摄入;反之亦然


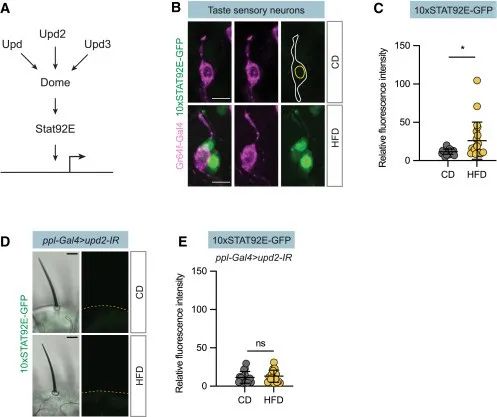
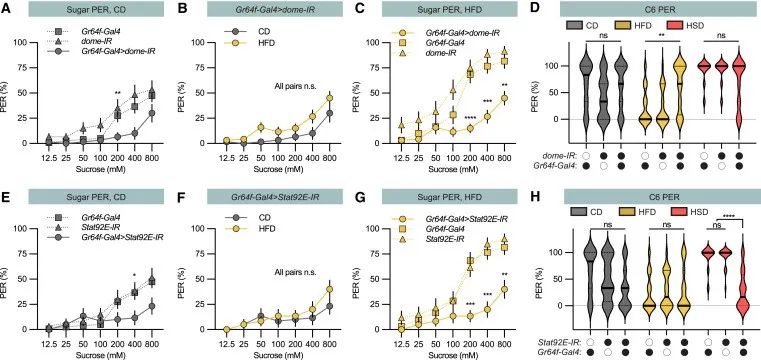
接下来,作者研究了Upd2是否也调节甜味感知,发现:Upd2敲除果蝇拥有100%的膳食糖PER反应,即其也可以调节甜味感知。此外,作者还发现,Upd2的调节作用与脂肪体是否成熟无关。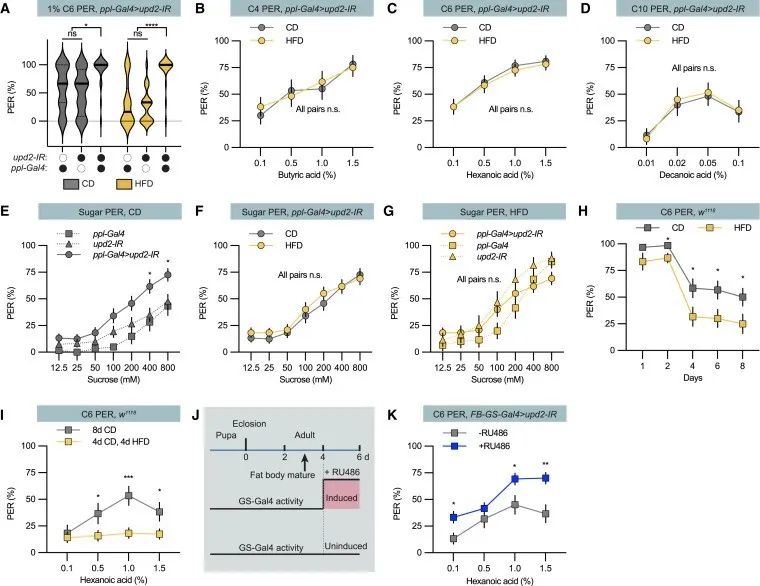

参考文献:
[1] Zhao Y, Johansson E, Duan J, Han Z, Alenius M. Fat- and sugar-induced signals regulate sweet and fat taste perception in Drosophila. Cell Rep. 2023 Nov 28;42(11):113387. doi: 10.1016/j.celrep.2023.113387. Epub 2023 Nov 6. PMID: 37934669.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







