带你了解双抗ADC
2024-05-21 小药说药 小药说药 发表于上海
在过去的十年里,ADC在治疗实体瘤和血液肿瘤方面逐渐成熟,成为抗肿瘤药物研究的一个革命性领域。
前言
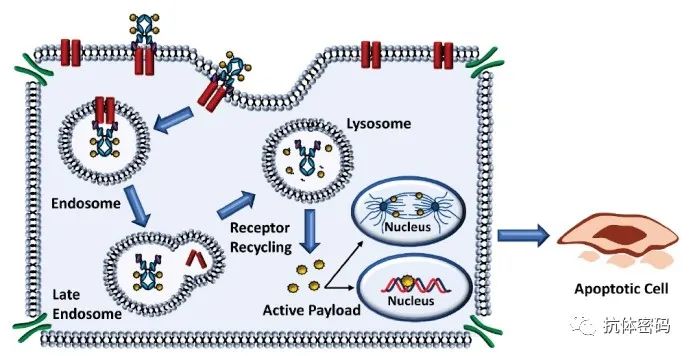
抗体偶联药物(ADC)包括抗体、连接子和细胞毒性有效载荷。与传统化疗相比,ADC靶向肿瘤有望减轻全身毒性作用,提供更广泛的治疗窗口和更高的治疗指数。在过去的十年里,ADC在治疗实体瘤和血液肿瘤方面逐渐成熟,成为抗肿瘤药物研究的一个革命性领域。
虽然ADC的发展取得了显著的成功,但意外毒性和耐药性的出现带来了巨大的挑战。各种因素导致了普遍存在的临床困境,特别是实体瘤。这些因素包括:(1)实体瘤的异质性限制了靶向单一抗原的临床疗效;(2) 治疗压力诱导抗原下调、表位突变和旁路通路的激活,导致显著的ADC耐药性;(3) 正常组织中的靶抗原表达、连接子不稳定性和其他变量等因素导致脱靶毒性;(4) 靶抗原对内化的抗性妨碍了足够治疗效果。因此,抗体、连接子和有效载荷的优化成为下一代ADC面临的挑战。
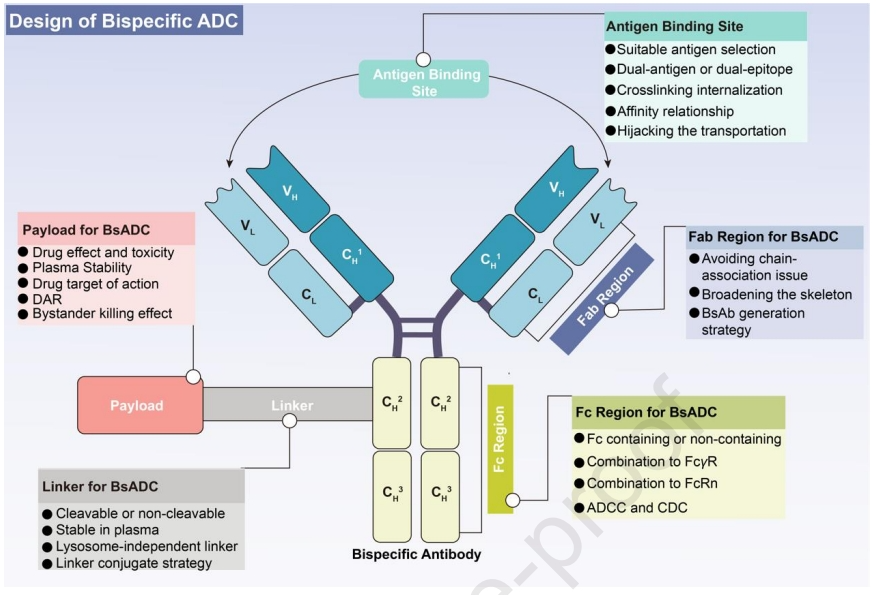
解决上述临床挑战的一种前瞻性方法是将双特异性抗体(BsAbs)与连接子-有效载荷复合物进行偶联,从而产生了双特异性抗体偶联药物(BsADCs)。与传统的ADC相比,BsADCs独特的双表位/靶点结合模式不仅能够与实体瘤中共表达的抗原结合以增强选择性,而且还显著改善内化。这些独特的优势使BsADC成为下一代ADC领域的一支重要力量。目前,至少10种以上的BsADC正在进行临床试验。BsADCs的设计不仅仅是“1+1=2”,其结合模式的改变影响整体疗效,包括了BsAbs、连接子和有效载荷的全面协调和优化。
BsADC的设计
目前已知BsADC 的靶点主要集中在HER2、EGFR和c-MET上。ADC的各个成分,包括抗体、连接子和有效载荷都需要独立的优化,对这些关键成分中的任何一个进行微小的修改都会导致临床特征的实质性改变。因此,在设计未来的BsADCs时,抗体、连接子-有效载荷复合物的优化和偶联策略应被视为相互连接的网络,需要一种整体的方法。
双特异性抗体
构建BsADCs的首要考虑因素在于明智地选择合适的靶标组合。靶点选择是ADC成功开发的基本前提,对最终治疗窗口和全身毒性产生关键影响。鉴于传统ADC面临的普遍脱靶毒性和临床耐药性的挑战,以下标准有助于指导靶点选择:
(1) 传统的靶点选择在于良好的内化特性、在正常组织上相对低的表达和在肿瘤上的高表达。(2) 鉴于实体瘤的异质性,必须确定各种肿瘤亚型和位点中靶点的表达水平,从而促进量身定制的药物递送的最佳实施,而不是依赖于单一的“灵丹妙药”。(3) 由于BsADCs独特的双重靶向特性,全面考虑抗原组合的深层效应至关重要。这包括内化、再循环、周转率、溶酶体降解和固有机制等因素。这些因素的整合对于BsADC的有效设计是必不可少的。
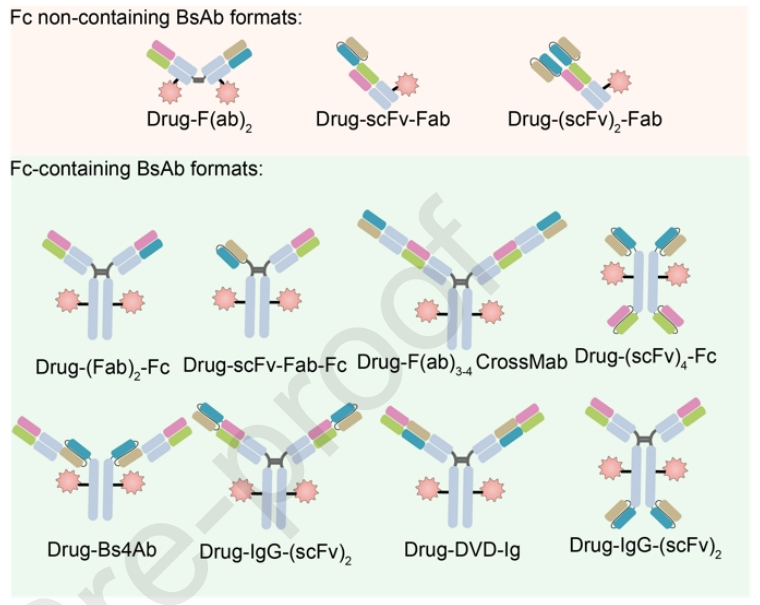
此外,BsADCs的主要分类标准之一是它们是否包含Fc区。不含Fc的BsADCs的设计面临着低稳定性、聚集问题和缺乏偶联位点等挑战。另一方面,含有Fc的BsADCs带来了额外的优势,如ADCC、CDC、免疫吞噬作用和细胞因子释放,这些共同有助于肿瘤杀伤。总之,Fc区构建的策略包括:(1)Fc工程化修饰,如Fc区域的氨基酸突变和糖基化修饰,这些方法可以帮助减轻与FcγR结合引起的脱靶毒性;(2) 保留ADCC和CDC:双靶结合模式有利于六聚体的形成,可以增强ADCC和CDC的作用,提高肿瘤的杀伤效果;(3) 保留FcRn结合或应用抗体工程有助于提高半衰期和安全性。
连接子
BsADCs中的连接子是抗体和细胞毒性有效载荷之间的关键连接,在有效载荷释放和药物稳定性中发挥着至关重要的作用。理想的连接子应在血浆中表现出稳定性,同时促进肿瘤中的有效释放。目前,ADC中的连接子可分为可裂解和不可裂解连接子。
不可裂解的连接体在血浆中具有高稳定性,只能在溶酶体中降解以释放有效载荷。这种类型的连接子导致较低的脱靶毒性、增加的血浆半衰期和增强的安全性。然而,潜在的耐药性可能源于内化和溶酶体转运的障碍。基于不可裂解连接子的BsADCs应专注于进一步优化内化,以及随后的内体转运和溶酶体降解。
与不可裂解的连接子相比,基于可裂解连接子的ADC具有更广泛的应用。可裂解连接子的主要挑战在于非特异性释放引起的脱靶毒性。为了设计溶酶体非依赖性BsADCs,某些可裂解的连接子(如Val-Cit连接子)可以有效促进早期和晚期内体的有效载荷释放。此外,近年来提出非内化ADC,化学或酶促切割在细胞外触发,可以靶向TME和血管系统中的抗原,激活旁观者杀伤效应。
有效载荷
细胞毒性有效载荷在很大程度上决定了整体抗肿瘤效果和潜在的不良反应。考虑到ADC的低渗透性,ADC的理想有效载荷需要在纳摩尔至皮摩尔水平上表现出高药效。此外,这些有效载荷应具有足够的血浆稳定性、低免疫原性和适当的水溶性。最后,有效载荷应具有与抗体偶联的可用基团。
BsADCs中有效载荷的旁观者杀伤效应是一个值得讨论的关键方面。旁观者杀伤效应是指有效载荷在释放后杀死相邻非靶向细胞的能力。对于ADC的PK/PD特性来说,这是一把双刃剑。虽然旁观者杀伤效应可以提高ADC在异质性肿瘤环境中的整体疗效,但它也会在肿瘤周围的正常组织中造成脱靶杀伤的风险。这种效应依赖于可裂解的连接子和疏水性有效载荷。如果其中一种靶抗原在正常组织(如c-Met)中具有一定水平的表达,BsADCs应避免施加具有旁观者效应的有效载荷。总之,BsADCs的旁观者杀伤作用有望克服肿瘤异质性、肿瘤屏障和较差的内化。然而,与脱靶效应相关的潜在安全问题需要仔细考虑。
此外,新型药物有效载荷对BsADC的开发至关重要。新出现的有效载荷,如PROTAC、铁死亡诱导物、寡核苷酸等,有助于BsADC领域药物选择的扩展。新药的开发可以显著丰富BsADCs领域的选择性药物类型。
靶向HER2的BsADC
ZW49
ZW49基于Zanidatamab,利用链间二硫键半胱氨酸和蛋白酶可裂解连接子,偶联N-酰基磺酰胺auristatin,使其具有良好的耐受性。ZW49的双特异性抗体性质有助于更好的内化,其Fc区赋予ADCC、ADCP和CDC效应。该设计解决了表达HER2患者的几个未满足的临床需求。
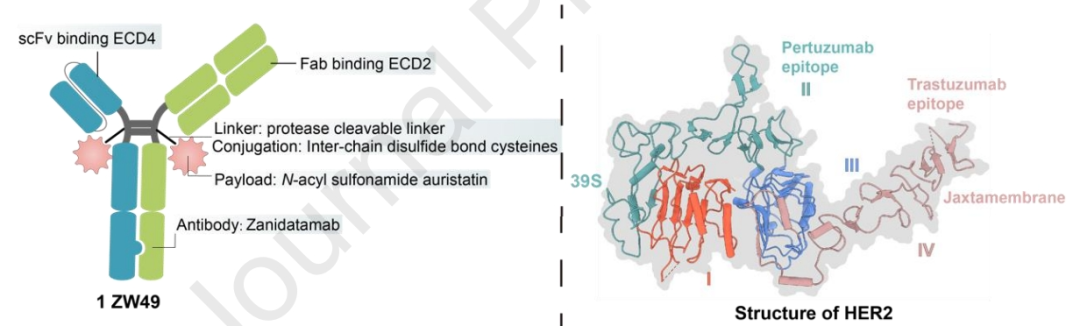
临床前数据表明,ZW49在不损害HER2亲和力的情况下表现出强大的肿瘤杀伤作用和良好的耐受性。目前,ZW49正在进行一期临床试验。截至2022年9月,披露的临床试验数据显示,在表达HER2的晚期实体瘤患者中的客观响应率(ORR)为31%,而其眼部毒性特征不容忽视(角膜炎为42%)。
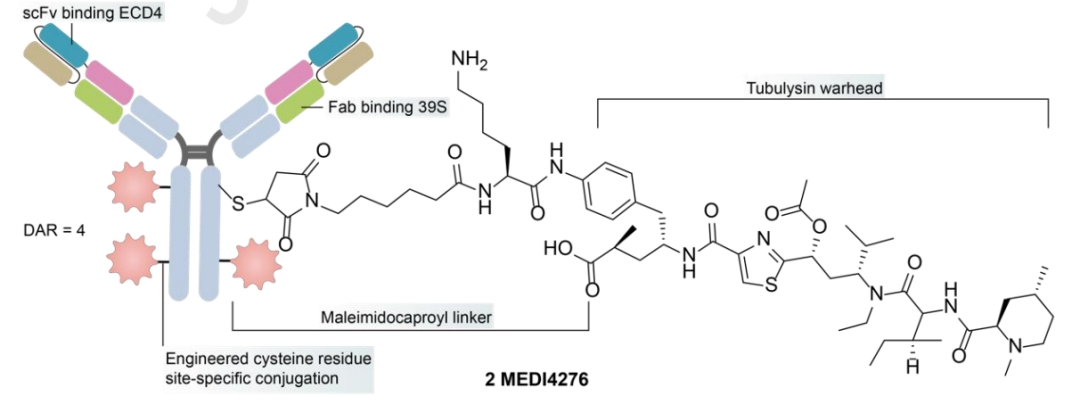
MEDI4276
MEDI4276是一种将曲妥珠单抗的scFv与另一种抗HER2 IgG1抗体39S的N末端融合的四价HER2靶向ADC。MEDI4276在治疗难治性HER2+癌症的小鼠异种移植物模型中显示出显著的活性,但在临床测试时并未表现出良好的疗效-安全性平衡。在乳腺癌的患者中,总体ORR较低(9.4%),最大耐受剂量(MTD)确定为0.75 mg/kg每3周一次。与ZW49的安全性相比,MEDI4276的较低MTD可能受到其价态、有效载荷和抗体配置的影响,这表明需要进一步优化。
靶向HER2◊CD63的BsADC
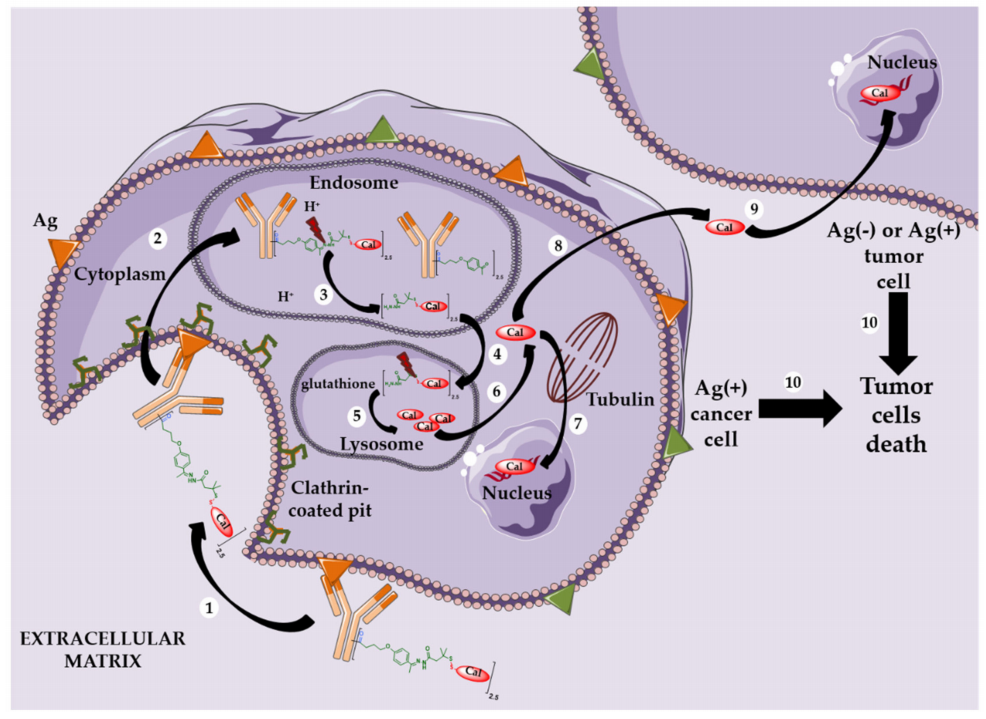
CD63是四次跨膜蛋白超家族的成员,表现出广泛但并不普遍的表达。它主要定位于细胞表面、晚期内体和溶酶体。CD63在这些细胞区室中的存在使其成为BsADCs的潜在靶点,旨在增强内化和溶酶体转运,最终改善药物递送和治疗效果。
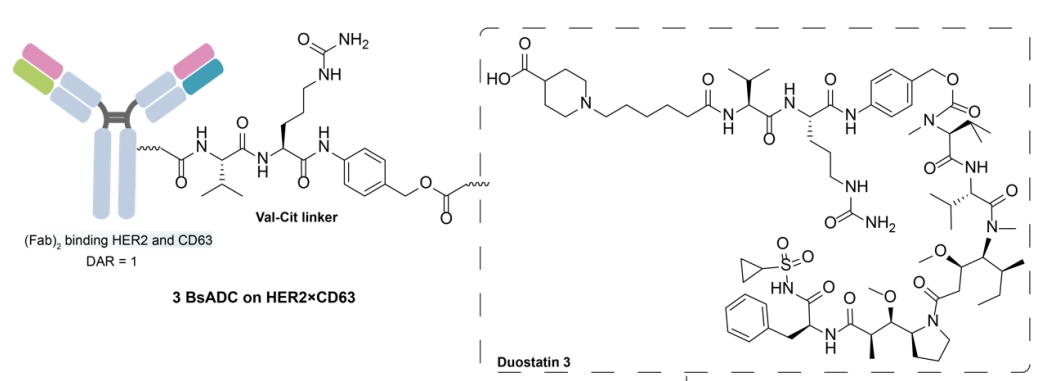
通过将CD63低亲和力突变臂与来自HER2抗体的另一个Fab臂结合,产生了靶向HER2×CD63的BsAb。该设计利用抗体依赖性受体交联来增强HER2的有效内化并促进溶酶体共定位。随后,Her2×CD63 BsAb通过VC连接子与抗有丝分裂有效载荷duostatin-3偶联。然而,该BsADC在低HER2肿瘤中观察到的疗效不足,表明有必要进一步优化,包括DAR的潜在增强和解决肿瘤异质性。
靶向HER2◊PRLR的BsADC
催乳素受体(PRLR)作为恶性乳腺上皮中的过表达靶点,可以通过自身泛素化和刺激AP2复合物的募集,有效地介导网格蛋白依赖性的初始内化和溶酶体运输。

通过利用“KIH”的方法,设计了具有HER2臂和PRLR臂的BsAb。BsADC通过表面赖氨酸将不可裂解的连接子(SMCC)与DM1偶联,平均DAR为3.324。与高表达的HER2相比,细胞表面较低表达的PRLR足以导致组成型内化和随后的溶酶体降解。这表明,即使在低表达的情况下,高周转表面靶标也可以介导良好的内化和溶酶体降解,以提高BsADCs的功效。
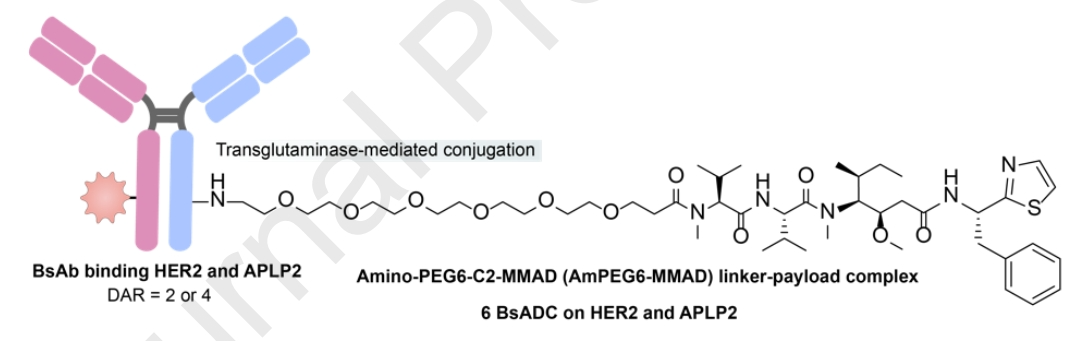
靶向HER2◊APLP2的BsADC
APLP2的细胞内尾部包含重叠的基于酪氨酸的NPXY和YXXæ基序。在网格蛋白介导的内吞作用后,APLP2可以与AP-2结合,介导有效的内化并直接导致溶酶体降解。
靶向EGFR的BsADC
EGFR是ERBB受体酪氨酸激酶家族的一员,在调节上皮恶性肿瘤的基本功能方面发挥着关键作用,然而,由于治疗压力诱导的获得性基因组改变,靶向EGFR单抗和TKI往往导致临床耐药性的出现。BsADCs有望解决抗EGFR耐药性机制,包括致敏突变和旁路通路的激活。
靶向EGFR双表位的BsADC
为了缓解耐药性的出现,人们开发了一种针对EGFR两个不同表位的双特异性抗体。这种双特异性抗体是通过融合EGFR上非重叠表位(9G8和7D12)特异性的纳米抗体而设计的。
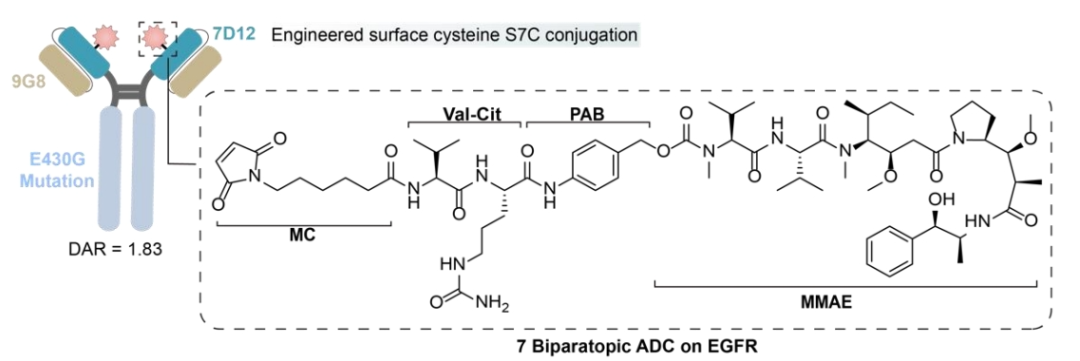
其中7D12破坏了EGFR信号级联,而9G8稳定了EGFR-ECD的束缚构象,在空间上防止了二聚化。此外,7D12和9G8对不同的EGFR突变细胞系表现出效力,对表达野生型EGFR或表现出西妥昔单抗耐药性突变的NIH-3T3细胞诱导更有效的CDC效应。
靶向EGFR和其它抗原的BsADCs
BL-B01D1 是中国首个进入I期临床的双抗ADC,靶向EGFR和HER3,接头采用其自有的Ac接头,相较于Mc接头具有更好的稳定性,亲水性更好,不易聚集;毒素为自有的喜树碱类似物ED04。其I期临床用药安全性较好,未出现药物相关的患者死亡情况。在安全性较好的10例可评估的NSCLC末线患者中,ORR为60%,DCR为90%。
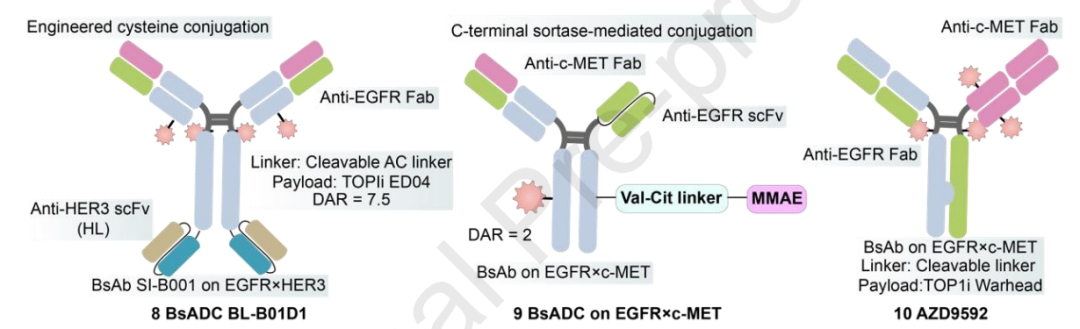
目前,已经报道了几种靶向c-MET和EGFR的BsAb,证明其在抑制肿瘤增殖和转移方面具有协同作用。在BsADCs的设计中,仔细选择合适的表位组合对于避免c-MET的完全或部分搅动至关重要。AZD9592是阿斯利康开发的EGFR/c-Met ADC,通过可连接linker偶联新型拓扑异构酶1载荷,主要解决奥希替尼耐药。相较于EGFR,AZD9592 对 c-MET 具有更高的亲和力,目的是减少由EGFR驱动的正常组织毒性。在PDX及耐药模型中,单药或联用奥希替尼均展现出良好的抗肿瘤活性。
1231是Sutro和默克子公司EMD Serono合作开发的MUC1/EGFR双抗ADC,采用非天然氨基酸定点偶联技术,通过可裂解VC连接子偶联hemiasterlin衍生物(微管抑制剂),DAR为4。临床前研究显示,在ESCC和NSCLC患者衍生的异种移植模型中具有很强的抗肿瘤活性。
靶向MET的BsADC
肝细胞生长因子(HGF)-间充质上皮转化因子(MET)途径在癌症从开始到转移的各种类型和阶段的发展中发挥着重要作用。MET的上调和扩增被认为是抗EGFR治疗期间的主要逃逸途径。C-MET可以与EGFR发生交叉反应,对EGFR靶向治疗产生耐药性,使抑制C-MET成为克服EGFR耐药性的可行策略。
与传统的MET靶向ADC相比,双表位MET×MET-BsADC的设计提供了克服现有挑战的创新解决方案。MET双抗原抗体具有形成2:2抗原-抗体复合物的能力,促进有效的MET内化和溶酶体转运。通过将Maytansinoid有效载荷M114经由蛋白酶可裂解的连接子与靶向MET的BsAb表面赖氨酸偶联,REGN5093-M114产生了DAR为3.12的BsADC。
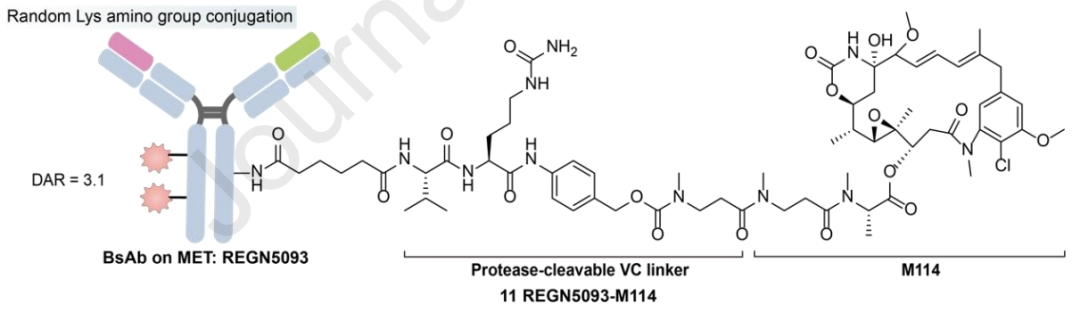
临床前数据表明,REGN5093-M114显著抑制MET过表达的NSCLC细胞的增殖。其目前已启动一项I期、剂量递增和剂量扩展研究,以评估成年MET-过表达晚期癌症患者中REGN5093-M114的安全性和有效性(NCT04982224)。
新型ADC
BsADCs显著扩展了潜在靶点和支架的范围,超出了传统范式。事实上,BsADCs提供了一种有效的手段来促进非内化抗原转化为内化抗原。例如,利用以快速内化为特征的EphA2和活化的白细胞粘附分子(ALCAM)(一种非内化或缓慢内化的抗原)来产生BsAb。有趣的是,当细胞表面EphA2与ALCAM的比率超过0.2的阈值时,双特异性抗体表现出有效的内化。相反,当比率低于这一阈值时,内化受到阻碍。
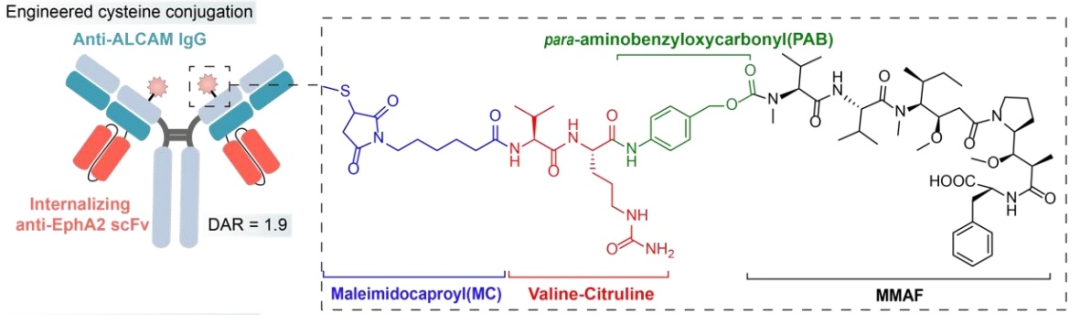
MC-VC-pab-MMAF有效载荷复合物通过半胱氨酸残基位点特异性偶联。在BsADCs的双特异性结合的背景下,内化效应可以通过同时靶向相邻抗原而受到显著影响,这取决于它们的表达比率。这种能力拓宽了抗原选择的范围,可以用于设计BsADCs内化较差的类型。这种创新方法为增强某些抗原的内化潜力提供了一种微妙的策略,有助于BsADCs靶向更广泛的肿瘤抗原的多功能性和有效性。
各种新技术的引入彻底改变了BsADC的生成,呈现出明显的优势。另一个显著的进展是PEG偶联的BsADC(P-BsADC),其不仅确保了均匀的偶联产生,而且由于其小分子量和不存在Fc片段,表现出高的内吞效率、组织渗透和降低的毒性。
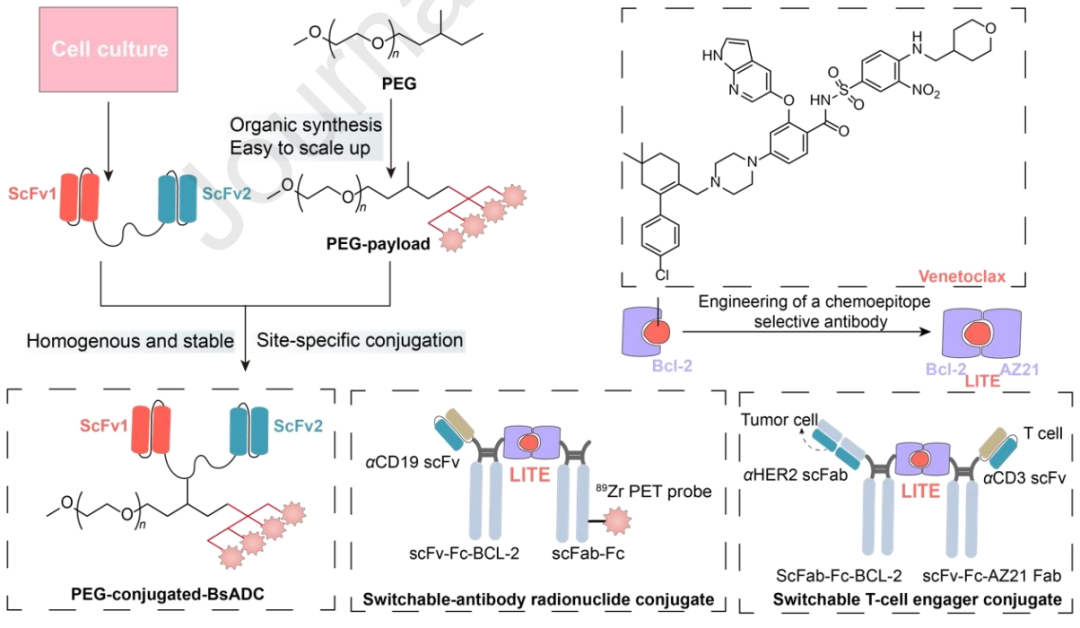
此外,配体诱导的多个抗体结构域的瞬时结合(LITE)是一项尖端技术,它将生物药物的半衰期延长优势与小分子相关活性的精确时间控制相结合。这些创新策略在实现治疗效果的同时最大限度地减少脱靶效应方面前景广阔,代表着BsADC技术发展的重要一步。
BsADC面临的挑战
BsADC代表了一种融合ADC和BsAbs优势的新型治疗类别。然而,其面临的挑战依然存在,主要归因于实体瘤的复杂性,包括异质性、组织学障碍和渗透性差等。必须完善BsADC的设计策略以克服这些挑战。
拓宽抗体骨架
BsADCs目前的靶点选择仍然有些有限,主要集中在HER2、c-MET和EGFR上。然而,双特异性策略有可能扩大靶点的范围,包括那些内化不良或低表达的靶点。考虑到BsAbs类型的多样性,进一步丰富BsADCs的抗原选择可以使抗肿瘤机制多样化。有希望的途径包括基于T细胞参与或PD-L1靶向BsAbs的免疫调节BsADCs。
清除不均匀的偶联
通过基于官能团的有效载荷的随机化学耦合来构建BsADCs具有异质偶联的风险。这种异质性可能会破坏双特异性结合模式,并改变BsADCs的物理和PK特性。位点特异性结合策略可以产生具有均匀DAR的BsADCs,同质DAR不仅提高了药物递送的准确性,还确保了治疗反应的一致性,使其成为BsADCs设计和开发的关键考虑因素。需要强调的是,位点特异性结合的基础在于仔细选择结合位点,这是影响ADC药物疗效的关键因素。
明确两个靶标之间的参数
BsADCs的多价结合模式和参数施加了相互的限制和依赖性。两个目标之间的设计考虑需要仔细检查,特别是在亲和力大小、表达和价态的变化方面。双特异性结合模式不仅通过价相互影响,而且通过交叉臂结合影响整体内化。除了亲和力之外,癌细胞系表面抗原的表达阈值在决定总体药物效果方面发挥着关键作用。解决这些关键点需要全面筛选具有不同亲和力的结合臂的组合,以实现最佳的生物活性。
转运
BsAbs可以通过将BsAb的初始特异性仅作为第二种特异性的转运模式的方法进行导航。一个例子是BsAb平台利用低亲和力转铁蛋白受体携带β-分泌酶抗体,促进有效通过血脑屏障。已经报道了靶向CD63、PRLR和APLP2的BsADCs显示出辅助转运的能力。在这些策略的基础上,设计BsADCs有望熟练地穿越生物屏障并逃避溶酶体降解。
解决潜在的安全问题
虽然BsADCs致力于增强特异性,从而减轻脱靶毒性和副作用,但以ZW49、MEDI4276和BL-B01D1为例的早期临床数据表明,其临床安全性不如预期。脱靶毒性是ADC相关毒性的主要特征。然而,仅仅依靠BsAbs可能无法充分解决减少脱靶毒性。除了抗体创新之外,围绕连接子-有效载荷复合物的关键研究也是必不可少的,包括连接子稳定性、同质偶联策略、DAR和旁观者杀伤效应的考虑。
小结
总之,独特的双特异性靶向模式的出现为ADC领域带来了新的创新,标志着新一代ADC的诞生。尽管处于开发的早期阶段,BsADC提供了一种具有相当潜力的新方法。BsADC对于克服传统ADC面临的现有临床挑战和开发更精确的靶向药物具有重要意义。
除了BsADC,一系列下一代策略有望为新型ADC设计做出划时代的贡献。其中包括具有双重有效载荷的ADC、免疫调节ADC、放射性核素ADC、前体ADC、ADC联合治疗和肽-药物偶联物。未来需要评估这些策略在新型ADC设计中的应用,无论是单独的还是组合的,这将为推进该领域的发展提供了重要的前景。
参考文献:
1. Bispecific antibody drug conjugates: Making 1+1>2. Acta Pharmaceutica Sinica B. 20 January 2024
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#抗体偶联药物# #ADC# #BsADC#
12