JAMA子刊:迄今最大多癌种研究推荐同时进行组织和血浆ctDNA基因检测指导靶向治疗
2024-03-02 苏州绘真医学 苏州绘真医学 发表于上海
本文使用大型临床异质队列进行的研究结果支持这样的说法:同时进行组织和ctDNA检测对于在晚期癌症患者中检测更多可操作的变异是可行的,可在临床产生获益。
与仅基于组织的基因检测相比,同步进行基于组织和循环肿瘤DNA(ctDNA)的基因检测能否增加NCCN指南(美国国家综合癌症网络指南)相关可靶向变异的检出?在本文介绍的这项队列研究中,共纳入了 3209 名患者,这些患者同时接受了 4 种癌症检测,并获得了基于组织和ctDNA的基因检测结果。其中 45.1% 的患者检测到了基于指南的变异。在这些患者中,9.3% 的患者通过ctDNA检测发现了临床可干预的变异,但组织检测未发现;24.2% 的患者通过组织检测发现了可干预的变异,但ctDNA检测未发现;对于携带可干预变异的乳腺癌患者,20.2% 的患者通过ctDNA检测到独特的、基于指南的变异——这些独特的ctDNA检出变异大多(55.0%)位于ESR1基因中。这项研究表明,与仅进行组织检测相比,同时进行ctDNA和组织基因检测可发现更多携带基于指南的可靶向变异的患者,并且乳腺癌患者的检出率更高。

背 景
美国国家综合癌症网络(NCCN)和其他机构的临床指南建议通过对肿瘤组织进行下一代测序(NGS)以进行全面的基因检测。如果在肿瘤检测中发现可干预的基因变异,则可能确定可改善临床结果的靶向治疗方案(与非靶向治疗相比)。虽然对循环肿瘤DNA(ctDNA,一般是血液)进行基因检测也可用于识别肿瘤衍生的可干预突变,但指南建议应用的场景有限。随着ctDNA测序在临床应用中不断发展,人们认识到ctDNA检测的易用性、周转时间快、失败率低、可检测耐药突变,以及监测免疫治疗反应等潜在优势。
尽管基于组织的NGS检测仍然是大多数癌症适应证的标准,但仅对组织样本进行基因检测具有潜在的局限性。首先,基于组织的检测需要对转移性病变进行侵入性手术,而一些患者在医学上不适合进行活检。其次,样本量不足或样本质量差会使很大一部分基于组织的检测无法提供相应结果。第三,基于组织的检测可能无法捕获肿瘤内或多个病灶中存在的分子异质性,这种异质性对于亚克隆耐药突变的检测尤其重要。
单独使用基于ctDNA的检测可能会在低脱落肿瘤中产生假阴性结果,以及在未定潜能克隆造血(CHIP)中出现假阳性结果。由于存在假阴性结果的可能,如果ctDNA结果中未发现可干预的变异,NCCN肺癌指南建议此时进行基于组织的测序。此外,与基于组织的检测相比,尚无指南详细阐述ctDNA分析性能特征标准。尽管存在上述限制,但ctDNA检测快速、无创,适合检测分子异质性和耐药突变克隆演变。
与仅进行组织检测或液体活检相比,同步进行ctDNA和组织基因检测(以下称为同步检测)可能为晚期癌症患者及时做出临床治疗决策提供优势。目前不断有证据表明,正如NCCN非小细胞肺癌(NSCLC)指南所承认的那样——支持补充(同时)检测;同时检测可能会为患者带来获益。此外,近期已经在乳腺癌患者中确定了监测ESR1(OMIM 133430)耐药变异对芳香化酶抑制剂治疗反应的重要性,并强调了ctDNA检测可能会为该人群带来获益。随着靶向治疗的应用,增加了对多种实体瘤临床可干预变异的检测,然而缺乏大型临床验证性研究来证明同时检测可能会为患者带来获益。本文在不同的临床环境中对多癌症队列进行了临床验证研究,以评估接受同时检测的患者与接受单一检测的患者相比,基于NCCN指南的临床可干预变异检出率是否更高。
患者特征
完整队列由 3209 名未识别的患者记录组成,这些患者初步诊断为NSCLC(n=1302)、乳腺癌(n=660)、前列腺癌(n=324)或结直肠癌(CRC;n=923)。以及转移性疾病。患者在 2020 年 5 月至 2022 年 12 月期间接受了测序,并进行了液体和实体瘤NGS检测,并在 30 天内收集了活检样本。由仅通过 1 次或多次检测鉴定出携带至少 1 个可干预变异的患者组成的亚组(n = 1448)被称为可干预队列。结果以总体水平或指定的癌症类型分开呈现。根据研究中 4 种癌症对应的NCCN指南建议,确定了临床可干预的变异。
研究结果
组织和ctDNA NGS检测在临床可干预变异的一致性
同时接受组织和ctDNA检测的 3209 名患者(诊断为IV期疾病时的中位年龄为 65.3 岁 [2.5%-97.5%,范围 43.3-83.3 岁])组成的队列包括 1693 名女性(52.8%)和 95 名亚裔患者(3.0%)、290 名黑人或非裔美国人患者(9.0%)、179 名西班牙裔或拉丁裔患者(5.6%)、1539 名白人患者(48.0%)、97 名其他种族患者(任何自我认定的种族 3.0%),以及 1009 名种族不明的患者(31.4%)。可干预队列由 1448 名患者(45.1%)组成,他们通过单独一种检测(组织或ctDNA)或两种检测(组织和ctDNA)发现了至少 1 种临床可干预变异。检测到可干预变异的患者百分比因癌症亚型而异:从前列腺癌患者的 12.7%(41/324)到CRC患者的 61.2%(565/923)不等(图1A)。
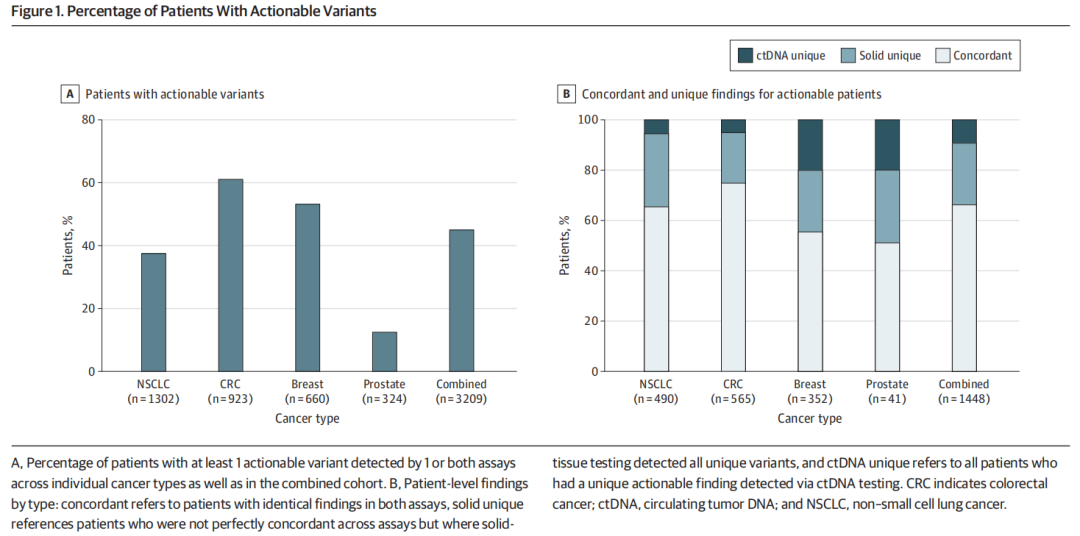
▲图1 携带可干预变异患者的百分比
在可干预队列中,ctDNA和组织NGS检测之间的一致性为 66.4%(962/1448)。不同癌症亚型的一致性不同,CRC一致性最高(75.0% [424/565]),前列腺癌最低(51.2% [21/41])(图1B)。通过检查ctDNA特异性变异发现,9.3% 的患者(135/1448)有至少 1 个仅通过ctDNA检测发现的可干预变异,分别占结直肠癌的 5.1%(29/565),非小细胞肺癌的5.5%(27/490),前列腺癌的 19.5%(8/41),乳腺癌的 20.2%(71/352)(图1B)。同样,通过检查组织样本的特异性变异发现,24.2% 的患者(351/1448)至少有 1 个仅通过组织检测发现的可干预变异(ctDNA中没有检测到其它特异性变异),分别占结直肠癌的 19.8%(112/565),非小细胞肺癌的29.0%(142/490),前列腺癌的 29.3%(12/41),乳腺癌的 24.1%(85/352)(图1B)。
肿瘤负荷和肿瘤占比与变异检测之间的关联
研究人员假设ctDNA负荷可能与ctDNA和组织NGS检测之间检测到的变异的一致率有关。ctDNA和组织样本同时检出相同变异的阳性百分比一致性(PPA)随着ctDNA负荷的增加而增加(图2A)。当ctDNA负荷为 10% 或更高时,PPA为 95.1%;当纳入所有ctDNA负荷水平时,PPA则降低至 74.3%。在所有癌症亚型个体中都观察到了PPA与肿瘤负荷之间的这种关联。
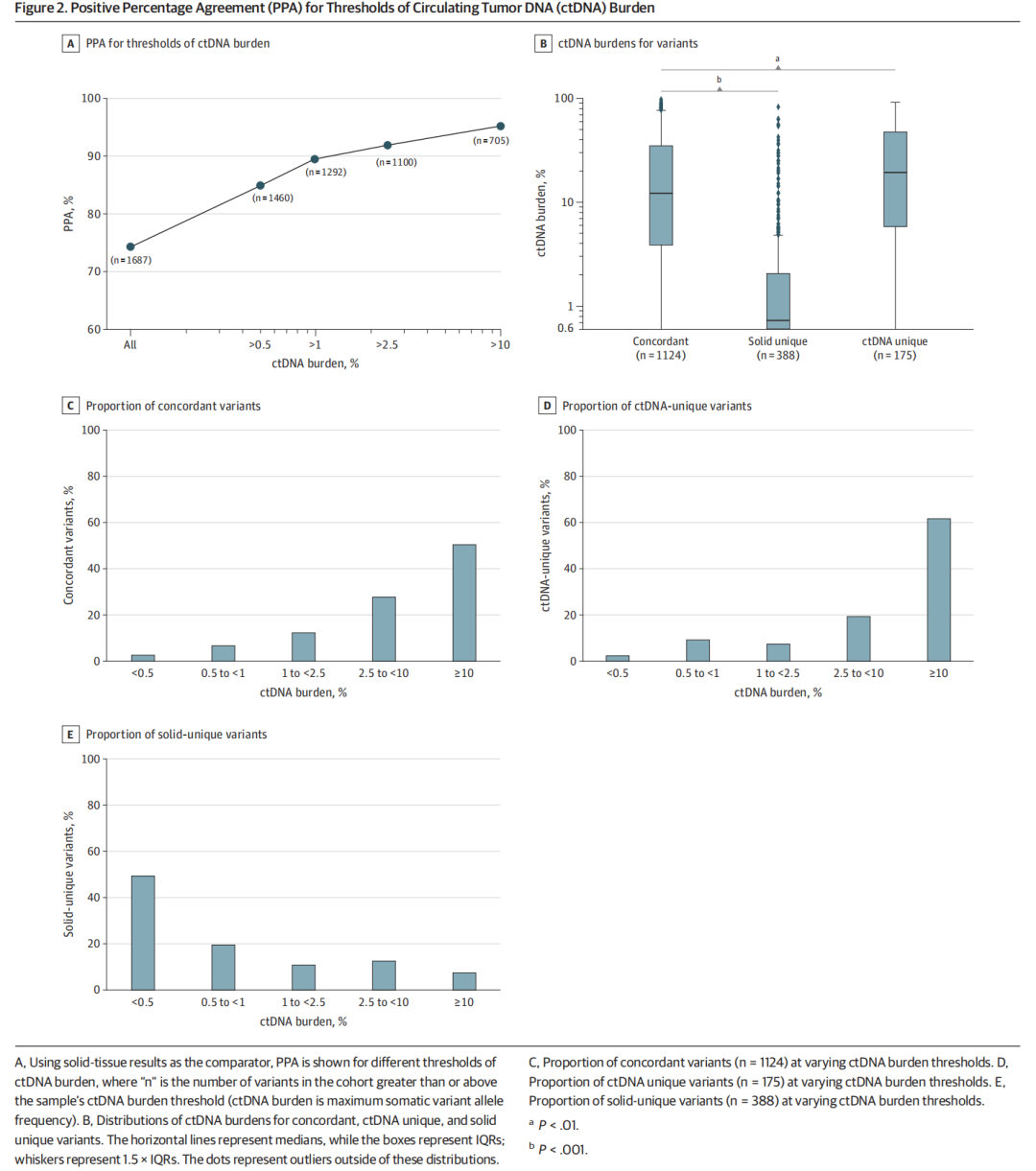
▲图2 循环肿瘤DNA(ctDNA)阈值的阳性百分比一致性(PPA)
可干预队列中检测到的变异根据其检测一致性进行分类:一致组(ctDNA和组织检测结果一致,n=1124)、ctDNA特异性组(ctDNA-unique,仅在ctDNA中检出可干预变异;n=175)或组织特异性组(solid-unique,仅在组织样本中检出可干预变异;n=388)。研究人员观察到,与组织和ctDNA结果一致的患者相比,组织检测到独特变异与较低的ctDNA负荷显著相关(U统计量,53124.5;中位组织特异性组 [0.5%] vs.中位ctDNA特异性组 [10.3%];P=5.6×10-110,Mann-Whitney检验)(图2B)。相反,与组织和ctDNA结果一致的患者相比,ctDNA特异性与更高的ctDNA负荷相关(U统计量,86384.0;中位ctDNA特异性 [16.8%] vs. 中位一致 [10.3%];P =4.8×10-3,Mann-Whitney检验)(图2B)。
对于一致组和ctDNA特异性组,研究人员观察到随着ctDNA负荷的增加,检测到的总变异比例有所增加(图2C和D):在ctDNA负荷最高的患者中(>10%;图2D),发现了超过 61.7% ctDNA特异性变异(108/175) 。相反,组织特异性变异比例随着ctDNA负荷的增加而下降,在所有组织特异性变异(192/388)中,有 49.5% 在ctDNA负荷最低的患者中检出(≤0.5%;图2E)。对每种癌症类型重复进行分析,得出了不同的特征。
研究人员观察到,在可评估队列中以及每种癌症亚型中,肿瘤纯度(tumor purity,即肿瘤占比,肿瘤细胞占所有细胞的比例)和一致性之间没有显著关联,但非小细胞肺癌除外——在非小细胞肺癌中,与一致组和组织特异性组相比,ctDNA特异性变异与较低的肿瘤纯度相关(H统计量,23.07;ctDNA特异性组、一致组和组织特异性组的中位数分别为 20%、50% 和 50%;P=3.9×10-5,Bonferroni校正的Kruskal -Wallis检测)。为了评估亚克隆性与变异检测的可能关联,研究人员比较了联合队列和每种癌症类型中的一致性变异和特异性变异的VAF。在所有癌症亚型和组织样本中,特异性变异的VAF始终低于一致性变异的VAF;组织特异性变异(U统计量,121831.0;中位组织特异性变异VAF [24.1%] vs. 中位一致性变异VAF [32.4%];P=1.13×10−12,Mann-Whitney检验)和ctDNA特异性变异(U统计量,34298.0;中位ctDNA特异性 [0.9%] 与中位一致性变异VAF [8.0%];P=1.15×10−30,Mann-Whitney检验)更有可能是亚克隆。
转移性非小细胞肺癌同步检测分析
大多数具有可干预变异的NSCLC患者有 1 个可干预的变异,其中 4.7% 的患者(23/490)携带超过 1 个可干预的变异。在NSCLC可干预队列中,一致组占 65.7%(337/513),组织特异性变异组占 29.0%(149/513),ctDNA特异性变异组占 5.3%(27/513)(图3A)。
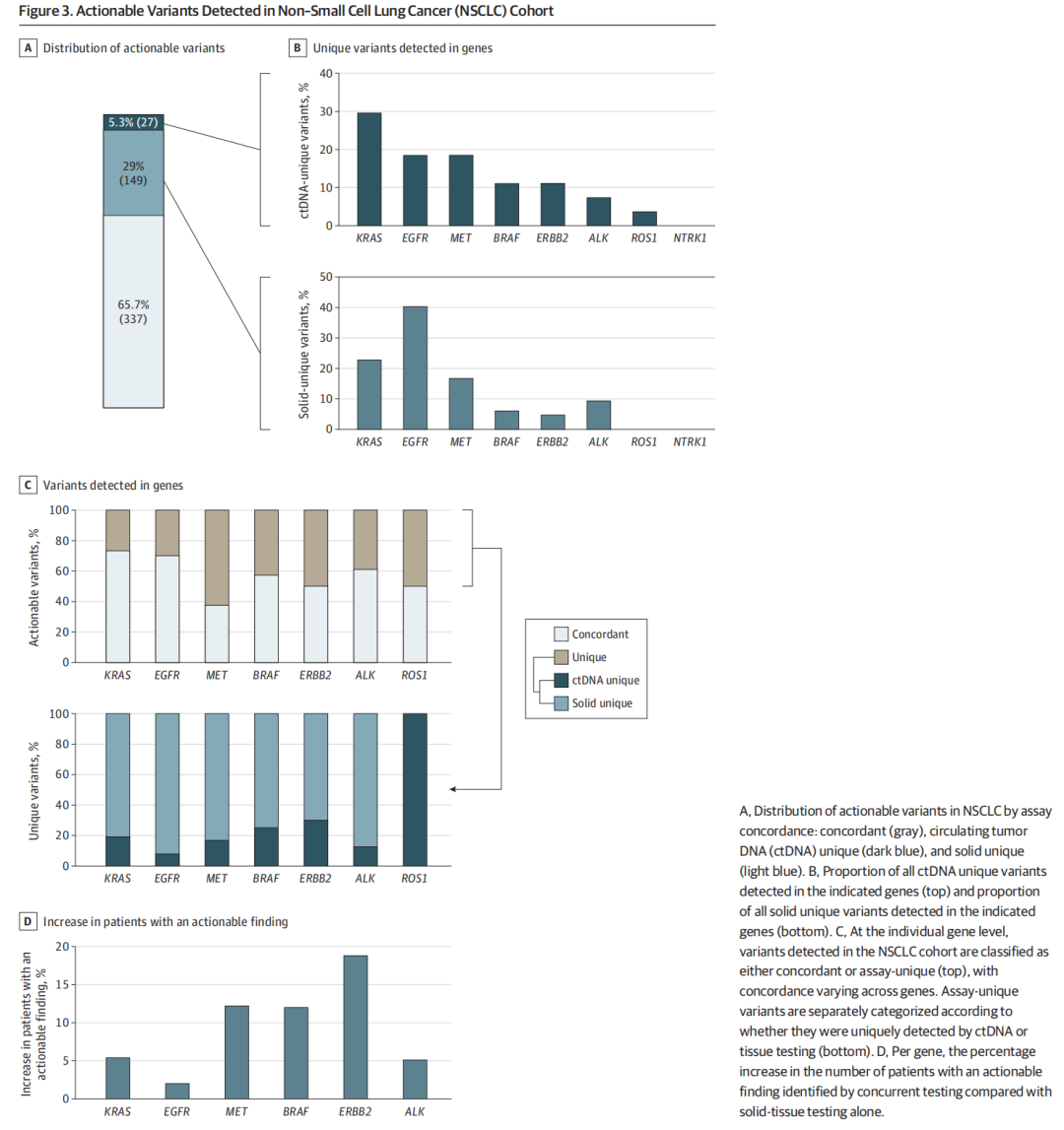
▲图3 非小细胞肺癌队列中检出的可干预变异
KRAS(OMIM 190070)变异是ctDNA特异性变异中最常见的,占 29.6%(8/27),而在组织特异性变异中,EGFR(OMIM 131550)变异是最常见的,占 40.3%(60/149)(图3B)。ctDNA与组织所检测到的特异性基因比例没有差异(ctDNA特异性 [KRAS 29.6%;EGFR 18.5%;MET 18.5%;BRAF 11.1%;ERBB2 11.1%;ALK 7.4%;ROS1 3.7%]与组织特异性 [KRAS 22.8%;EGFR 40.2%;MET 16.8%;BRAF 6.0%;ERBB2 4.7%;ALK 9.3%;ROS1 0%];P>0.05,费舍尔精确检验;图3B),尽管ctDNA特异性变异和一致性变异(一致性 [KRAS 34.2%;EGFR 44.9%;MET 5.4%;BRAF 4.7%;ERBB2 2.9%;ALK 7.4%;ROS1 0.2%];P=0.002,费舍尔精确检验)以及组织特异性变异和一致变异(χ2=22.21;P<0.001;图3B)之间存在显著差异。
接下来,研究人员检查了一致组、组织特异性组以及ctDNA特异性组的相对比例(图3C)。总体而言,不同基因的一致性之间存在显著差异(P=8.52×10-5,χ2检验)。MET基因(OMIM 164860)占比最小(37.5% [18/48],即大多数MET变异仅在一种检测中检出)。然而,除了ROS(OMIM 165020;n = 1)外,所有基因中的大多数特异性变异(>70%)均可通过组织检测发现(图3C)。
在 3 个基因中观察到多克隆变异(即患者基因中有多个致病变异),最常见的是ERBB2(OMIM 164870;5.3%)。为了解释这一点,研究人员检查了因同时检测而导致可干预基因增加患者的组织检测结果。在KRAS变异患者中,同时检测与仅进行组织检测相比,发现携带可干预KRAS变异的患者数量增加了 5.4%(8/149)(图3D),其中EGFR的患者数量增加最少(2.0 % [4/202]),ERBB2增加最多(18.8% [3/16])。
转移性乳腺癌同步检测分析
在转移性乳腺癌的可干预队列中(n=352),一致性组占 59.4%(301/507);ctDNA特异性组占 19.7%(100/507),组织特异性组占 20.9%(106/507)(图4A)。ESR1变异是ctDNA特异性变异中最常见的可干预变异(55.0% [55/100]),PIK3CA变异(OMIM 171834)占 29.0%(29/100)(图4B)。总体而言,ctDNA特异组中的可干预基因比例与组织特异性组中的可干预基因比例(P =3×10-4)和一致组中可干预基因比例(P =1×10-10)存在显著差异,而组织特异性组与一致组中可干预基因变异比例之间的差异并不明显(ctDNA特异性组 [ESR1 55%;PIK3CA 29%;BRCA2 8%;ERBB2 5%;BRCA1 3%;MSI 0%];组织特异性组[ESR1 28.3%;PIK3CA 50.9%;BRCA2 3.8%;ERBB2 13.2%;BRCA1 1.9%;MSI 1.9%];一致组[ESR1 21.3%;PIK3CA 64.1% ;BRCA2 2.3%;ERBB2 8.6%;BRCA1 3.3 %;MSI 0%])(图4B)。
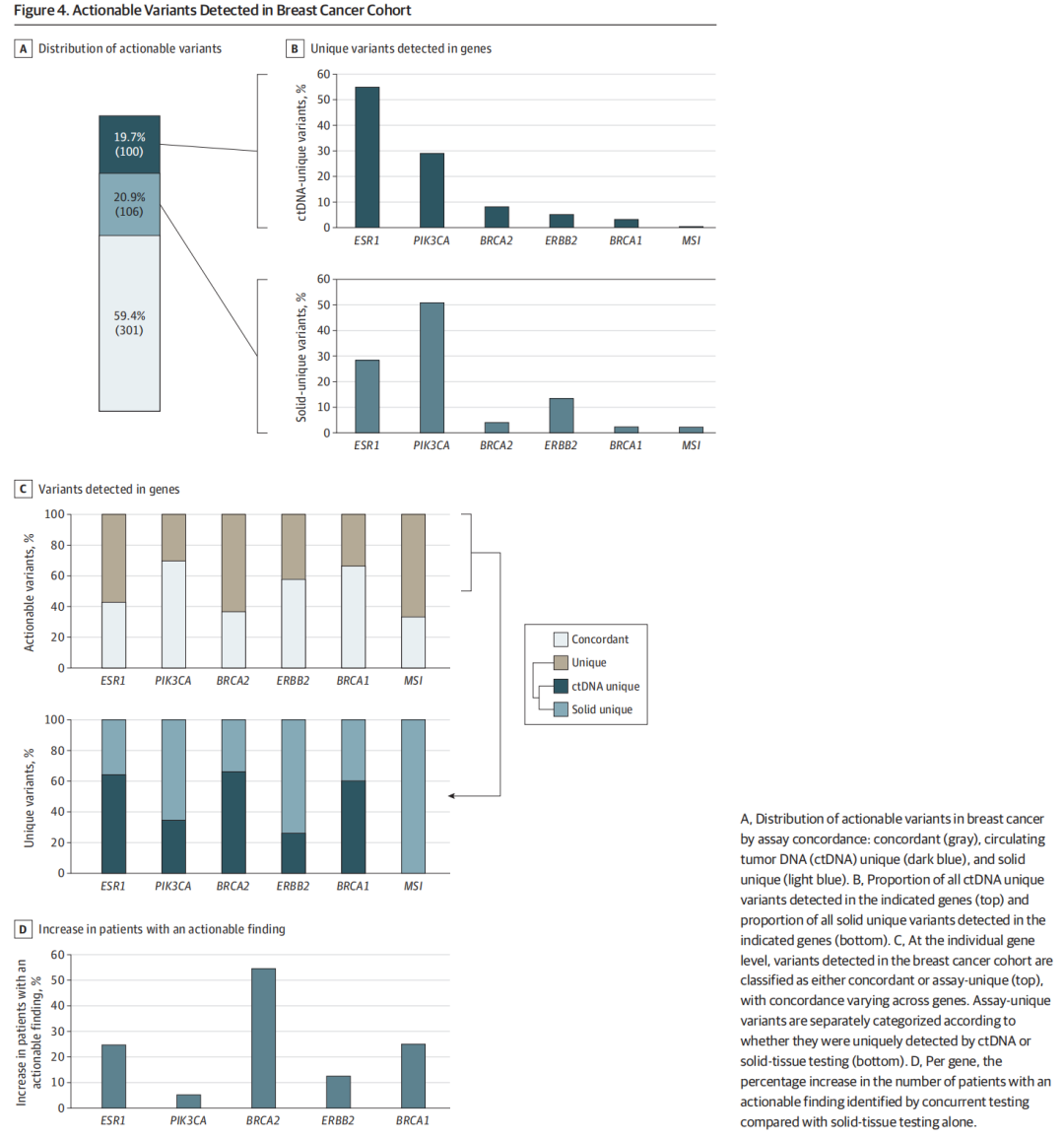
▲图4 乳腺癌队列中检出的可干预变异
接下来研究人员检查了基因内的一致性,发现在不同基因中存在显著差异(χ2=34.62;P=1.8×10-6),其中PIK3CA显示出最高的一致性(69.9% [193/276])(图4C)。相比之下,73.6% 的检测独特ERBB2变异(14/19)是通过组织测试检测到的(图4C)。研究人员还关注了每种检测方法在基因水平上检测到的独特变异,发现基因检出率存在差异,所有ESR1变异中有 64.7%(55/85)是通过与ctDNA检测相关的方法单独检测到的(图4C)。相比之下,所有ERBB2变异(14/19)中有 73.6% 是仅通过与组织检测相关方法检测到的(图4C)。
总体而言,与非小细胞肺癌相比,晚期乳腺癌的变异检测与多克隆性和患者级别之间的关联性更大,特别是在ESR1和PIK3CA基因中。对于ESR1,由于同时检测,发现携带可干预变异的患者数量增加了 24.7%(23/93),其中PIK3CA的患者数量增幅最小(5.2% [12/233]),BRCA2(OMIM 600185)增幅最大(54.5% [6/11])(图4D)。
在可干预的转移性乳腺癌患者队列中,65.1%(229/352)为激素受体(HR)阳性、ERBB2阴性,共有 73.8%(260/352)HR阳性(无论ERBB2状态,图5A)。在HR阳性乳腺癌患者中,ESR1变异已被证明是一种可干预的生物标志物。相较于组织特异性ESR1变异,具有高ctDNA负荷的患者更有可能携带ctDNA特异性(U统计量,1331.5;中位ctDNA特异性 [26.9%] vs. 中位组织特异性 [1.0%];P=6.6×10−8,Mann-Whitney检验)和一致性(U统计量,1465.5;中位一致性 [11.2%] vs.中位组织特异性 [1.0%];P=2.5×10-7,Mann-Whitney检验)ESR1变异(图5B)。大多数ESR1变异的检测一致性低于 50%,当考虑到可干预变异中出现 3 次或更多次的变异时,ctDNA中检出的独特变异的比例从Y537C的 100%(8/8)到L536P的 50%(2/4)不等(图5C)。
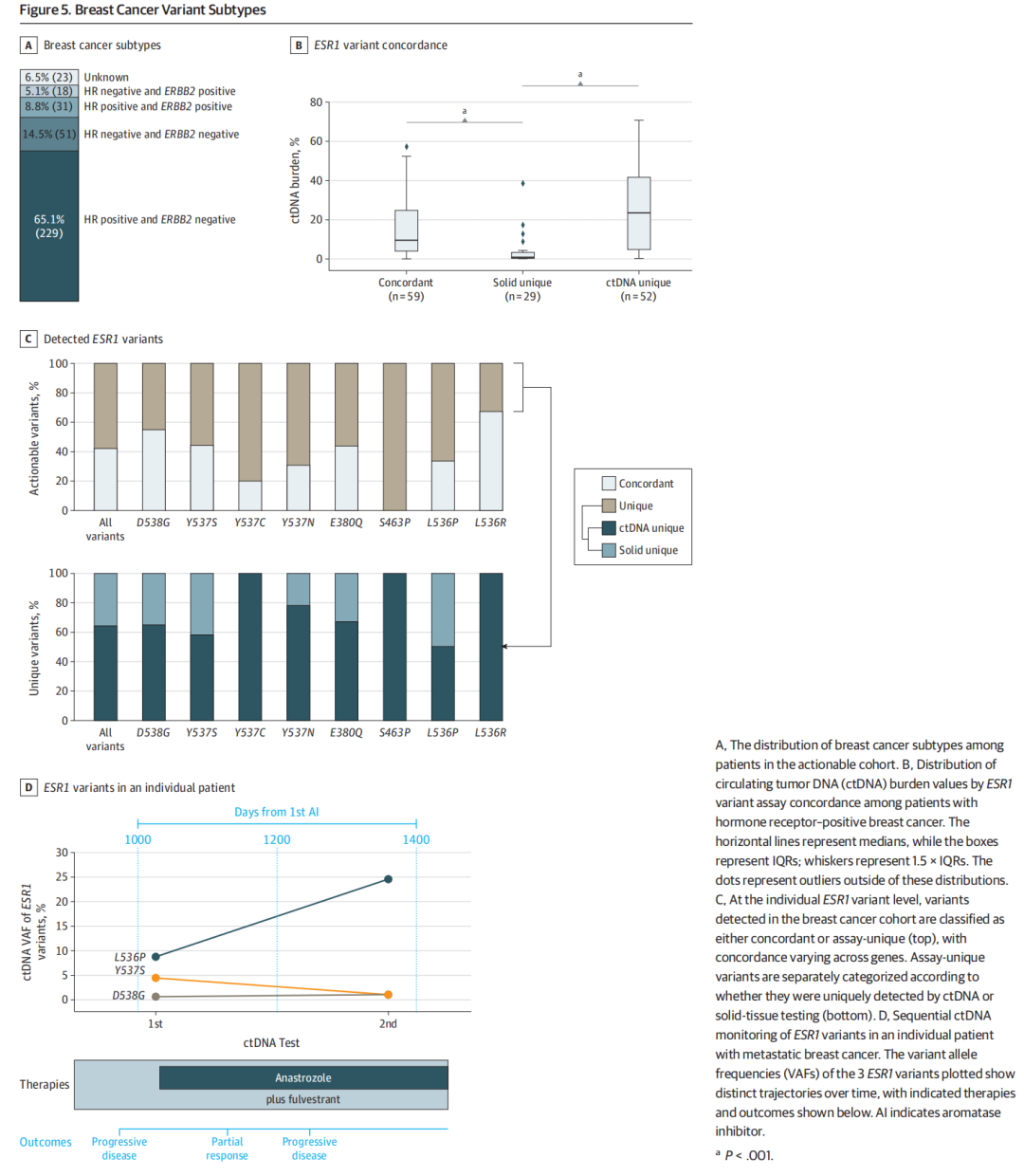
▲图5 乳腺癌变异亚型
研究人员对一名HR阳性、ERBB2阴性的转移性乳腺癌患者进行了检查,该患者既往接受过抗雌激素治疗,并进行了 2 次ctDNA检测,间隔 325 天(图5D)。在第一次检测时,通过ctDNA检测发现了 3 个ESR1变异(L536P、Y537S和D538G)——最有可能是因既往芳香化酶抑制剂和CDK4/6抑制剂治疗导致的耐药变异。在两次ctDNA检测的间隔内,患者接受阿那曲唑和氟维司群的抗雌激素治疗,临床记录表明最初对治疗有部分反应,随后疾病进展。在第二次ctDNA检测时,L536P变异的ctDNA VAF大幅增加,Y537S变异的VAF有所下降,反映了治疗压力引起的克隆选择。
转移性结直肠癌和前列腺癌的同步检测
在CRC和前列腺癌队列中重复进行了分析。在 4 种实体瘤中,CRC和前列腺癌的患者携带可干预变异的比例分别为最高和最低(图1B)。在CRC中检测到的可干预基因变异中,KRAS所占比例最大(75.7% [439/580])。研究人员观察到,在ctDNA独特性变异和一致性变异之间,携带ctDNA独特性变异与组织特异性变异的比例存在显著差异,但组织特异性变异和一致性变异之间没有显著差异。在前列腺癌中,鉴于该队列中携带可干预变异的患者数量较少(n = 41),并且事实上许多基于指南的前列腺癌变异可能与CHIP相关(例如ATM [OMIM 607585]),因此独特变异的检出很难解释,需要额外的后续分析来评估临床相关性。
讨 论
据研究人员所知,这是迄今为止规模最大的晚期多癌种实体瘤研究,在异质性临床环境中检查了同时进行的ctDNA和组织NGS检测结果,其中包含了地理、种族和民族不同的患者群体,其中 20.6% 的患者为非白人种族。此外,ctDNA和组织特异性检出至少 1 个NCCN指南推荐的可干预变异患者的比例分别为 9.3% 和 24.2%。
尽管两种测试方法的变异检测基本一致,但不同癌症亚型的一致性率差异很大。空间异质性可能是影响 ctDNA 独特变异和实体组织独特变异检测的主要生物学因素,无论是通过肿瘤内异质性还是跨转移病灶的肿瘤间异质性。在本文研究中,通过将患者队列限制为具有匹配肿瘤和正常特征的患者,从而将其它潜在的生物学干扰因素(包括胚系变异和CHIP)降至最低。
在携带可干预变异的晚期乳腺癌患者中,20.2% 的患者携带ctDNA特异性可干预变异。其中超过一半(55.0%)是ESR1基因的体细胞突变,这是对芳香化酶抑制剂内分泌治疗获得性耐药的常见原因。ESR1突变的检测是关键信息,可使临床优化治疗决策——近期的临床证据支持使用ESR1突变作为更换治疗的可行生物标志物,并且美国食品和药物监督管理局(FDA)批准将ESR1突变作为艾拉司群(elacestrant)用于治疗携带ESR1突变、HR阳性晚期乳腺癌患者的伴随诊断。此外,针对ESR1突变的连续ctDNA监测的临床证据正在迅速发展,以“捕获”一线晚期HR阳性乳腺癌患者等位基因频率的定量变化。特别是在HR阳性乳腺癌中,同时接受组织和ctDNA检测的患者其可干预变异的检出率较高,支持进行基线ctDNA检测,从而对晚期HR阳性乳腺癌患者的分子改变进行连续ctDNA监测。
在晚期NSCLC中,虽然NCCN指南承认在下列情况下进行补充性ctDNA检测的价值:(1) 患者在医学上不适合进行侵入性组织取样;(2) 没有足够的组织进行分析; (3) 组织取样时间不确定;但本文研究提供了临床证据,证明在可获取组织的情况下,同时进行组织和ctDNA检测的价值。在本文研究中,尽管组织检测十分成功,但有 5.5% 的NSCLC携带可干预变异的患者携带ctDNA特异性变异。Aggarwal等人发表的研究成果支持本文结果:6.3% 的NSCLC患者具有通过基于血浆ctDNA检测到的靶向突变。
局限性
本文研究存在一些局限性:这是一项回顾性研究,缺少患者靶向治疗的结果以及依从性数据。尽管如此,本文研究基于一个庞大且多样化的患者队列,反映了在异质性临床环境中观察到的治疗方式不断变化的情况,其中同时检测(活检之间≤30天)已被证明是可行的、实用的和适用于临床的。尽管每种检测方式都有技术和生物学限制,但这些限制在很大程度上是互斥的,并且同时使用时可以为治疗可干预性提供补充证据。本文研究尝试控制CHIP,但仍不能排除一些ctDNA特异性变异可能与CHIP混淆。最后,本文研究重点关注了有限的癌症亚型,这是基于数据集中较高患病率的结果,反映了临床治疗的情况。预计未来研究将包括其它癌症亚型,以评估晚期全癌种实体瘤患者的临床获益。
本文使用大型临床异质队列进行的研究结果支持这样的说法:同时进行组织和ctDNA检测对于在晚期癌症患者中检测更多可操作的变异是可行的,可在临床产生获益。尽管与同时检测获益因癌症类型而异,但在本文 4 种癌症类型中均有较高的检出率,并且在乳腺癌和NSCLC中最为明显,这再次证实了NCCN指南支持对这些患者进行ctDNA检测的说法。未来的研究将探讨同时进行组织和ctDNA检测如何通过扩大匹配治疗的数量,进而为患者更优的治疗选择和更好的治疗结果。
参考文献:
Iams WT, Mackay M, Ben-Shachar R, Drews J, Manghnani K, Hockenberry AJ, Cristofanilli M, Nimeiri H, Guinney J, Benson AB 3rd. Concurrent Tissue and Circulating Tumor DNA Molecular Profiling to Detect Guideline-Based Targeted Mutations in a Multicancer Cohort. JAMA Netw Open. 2024 Jan 2;7(1):e2351700. doi: 10.1001/jamanetworkopen.2023.51700. PMID: 38252441; PMCID: PMC10804266.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#靶向治疗# #基因检测# #ctDNA#
34