脑小血管病(cerebral small vessel disease,CSVD)是指各种病因影响脑内小动脉、微动脉、毛细血管、微静脉和小静脉所致的一系列临床、影像和病理综合征。CSVD是脑卒中、痴呆和死亡的重要危险因素,严重危害老年人的生命健康和生活质量。CSVD起病隐匿,缺乏早期的诊断方法及干预措施,明确CSVD目前的研究现状和未来的发展方向,可以为基础和临床研究提供新的思路。本文就CSVD的诊疗现状和研究新进展进行综述。
1 CSVD的诊疗现状
脑小血管病(CSVD)是指直径40~200 μm的脑小穿支动脉、小动脉、毛细血管及小静脉病变导致的一组临床、影像和病理综合征,主要表现为脑白质损伤(white matter lesions,WMLs)、近期的皮质下小梗死、腔隙灶、脑微出血(cerebral microbleeds,CMBs)、扩大的血管周围间隙(enlarged perivascular space,EPVS)和脑萎缩。CSVD 临床起病隐匿,进展缓慢,缺乏特异性症状和体征,患者可出现认知功能障碍、步态异常、情绪障碍、尿失禁及生活能力下降等症状。CSVD急性期病变易发生腔隙性梗死和脑实质出血,占所有症状性卒中类型的20%;慢性期病变表现为低灌注,对相应脑组织造成持续性、进行性损害,包括认知障碍和痴呆、步态异常、运动障碍、尿潴留、情绪异常和人格障碍。根据病理机制的不同,可将CSVD分为:Ⅰ型,小动脉硬化或衰老型,占所有CSVD的80%,与高血压和年龄相关,其病理表现为纤维素样坏死、脂质透明变性、小动脉粥样硬化、微动脉瘤、小动脉节段性结构素乱或解体;Ⅱ型,遗传性脑淀粉样CSVD;Ⅲ型,遗传性CSVD,包括CADASIL、CARASIL、MELAS、Fabry、遗传性脑视网膜小血管病;Ⅳ型,炎症和免疫介导的CSVS;Ⅴ型,静脉胶原病;Ⅵ型,其他类型的CSVD。本文就CSVD的流行病学、危险因素、诊疗现状和研究新进展进行综述。
1.1 流行病学 目前,全球至少有7亿人患有不同形式的CSVD,其发病率是大血管卒中的6~10倍,占卒中病例的25%~30%,痴呆病例的45%,血管性痴呆病例的70%。CSVD发病率无性别、种族和地区差异,但随年龄增长而增加,流行病学研究显示,50岁的时候WML发病率只有5%,60岁以上人群中达到80%,90岁时则高达100%,同样地,45~50岁时CMBs发病率约为6%,而80~89岁时则增至36%。CADASIL是最常见的遗传性CSVD,成年人中其患病率约为2~4/100 000。
1.2 危险因素 动脉高血压是CSVD最重要且可逆的血管危险因素,其他常见危险因素包括糖尿病、吸烟、睡眠呼吸暂停、慢性肾脏病、分支动脉粥样硬化;高脂血症是大血管病的主要危险因素,但由于他汀类药物的广泛使用,很难评估高脂血症对现代人群CSVD发病风险的影响。单个基因突变很少引起CSVD,NOTCH3、HTRA1、MTTL1、GLA、COL4A1/COL4A2、TREX1基因突变被认为与CSVD的发生发展相关,但临床上极为罕见;此外,中枢神经系统免疫性或感染性疾病也会引起CSVD。
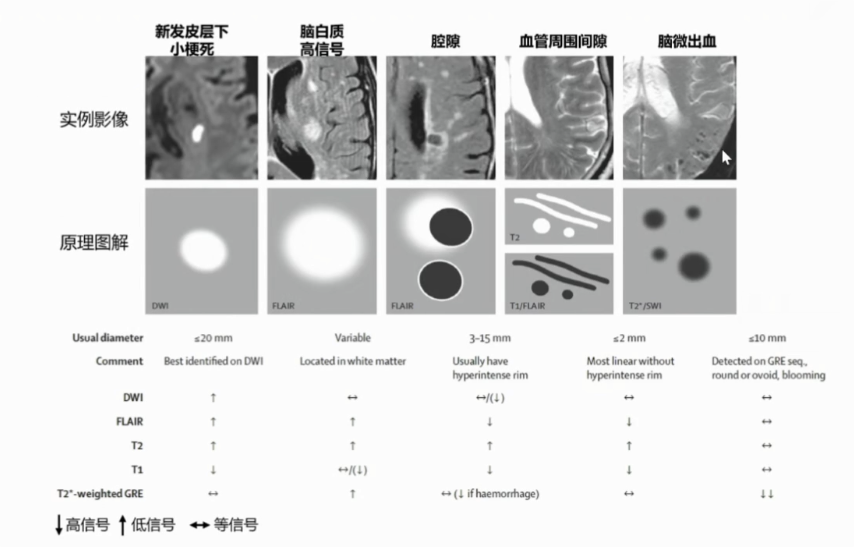
1.3 CSVD的诊断与评估 CSVD的诊断依赖于头部磁共振扫描,其影像学标志物包括新近的皮质下小梗死、WMH、腔隙、CMBs、扩大的血管周围间隙和脑萎缩。典型的腔隙病灶在T2加权成像(T2weighted images,T2WI)或液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列上表现为皮质下白质或深部灰质≤20 mm的液性空腔,周围伴有胶质细胞增生导致的异常高信号,通常继发于皮质下小梗死。WML也叫白质疏松或白质高信号,是T2WI或FLAIR上表现出的皮质下点状、斑片状或融合的异常高信号,是CSVD最常见的影像学表现。CMBs是一种小面积的局灶性含铁血黄素沉积,表明之前有血液从受损的小血管外渗,其在磁敏感加权成像或梯度回波序列上表现为直径3~10 mm的圆形或椭圆形低信号。EPVS是一个围绕着穿支小动脉或静脉的充满脑脊液的异常间隙,其直径>2 mm,磁共振上表现为直径2~5 mm的椭圆形、圆形、线状或管状病变,通常双侧对称、边界清楚,与穿通动脉的行径相一致。脑萎缩是一种神经元及其之间联系逐渐丧失的疾病,可导致脑容量减少,脑容量的减少通常可以通过CT和MRI来识别,可显示与脑萎缩密切相关的脑组织变化,CT和MRI均能显示皮质萎缩,但MRI对某些类型的萎缩更敏感,如核内局灶性萎缩改变。
当前,已经发展了许多先进的磁共振技术用于CSVD的诊断:(1)7.0T MRI或弥散张量成像(diffusion tensor imaging,DTI)可用于检测脑组织的微结构,有研究显示,7.0 MRI可以检测到更细微的CSVD病变,如直径0.2~2.9 mm微梗死。平均扩散率和各向异性分数是衡量白质微结构的传统DTI指标,但缺乏特异性,有研究表明,该指标不能很好的区分正常的白质微结构和轴突损伤。细胞外液增多是基于DTI和自由水分析确定的指标,由小血管病变导致的血脑屏障通透性增加所致,与传统指标相比,能更好的预测CSVD引起的损伤。(2)功能磁共振成像(functional MRI,fMRI)可用于评估脑血管反应性和脑组织功能活动,是诊断和评估CSVD的有利工具,有研究使用静息态fMRI评估脑血管反应性,发现WML可通过引起脑血管反应性改变导致功能连接异常而引起认知受损。(3)血管壁成像是一种新兴的磁共振技术,由于有50%的CAA患者有血管壁信号增强,有助于CSVD的诊断分型,但目前关于血管壁成像在CSVD中的研究较少,未来需要更多的演技来探索其在CSVD诊断中的价值。
1.4 CSVD的预防和治疗 由于CSVD的发病机制尚不明确,临床上缺乏有效的防治手段。目前,对CSVD的防治主要根据危险因素概况、生物标志物的类型及CSVD的严重程度进行个体化治疗。血压是CSVD最终要的可改变危险因素,一项关于抗高血压药物对CSVD的疗效的荟萃分析显示,强化降压治疗的患者WML的进展显著减少,但这些研究没有评估强化降压治疗对CMBs、扩大的PVS或急性小皮质下梗死的疗效;因此,未来仍需进一步的研究探索强化降压治疗对CSVD的防治作用。抗血小板治疗是近期皮质下小梗死的有效防治手段,随机试验的汇总分析显示,急性皮质下梗死后单用阿司匹林治疗可使卒中复发风险降低30%。对于急性非致残性卒中,卒中发病24 h内双联抗血小板治疗相比但用阿司匹林治疗可有效降低90 d卒中的复发率。另一项多中心的临床试验研究(POINT)发现,对于发病12 h内的短暂性脑缺血或轻型卒中,双联抗血小板治疗可有效降低90 d卒中的复发率,但却增加了出血性不良事件的发生率。静脉溶栓治疗是发病4.5 h以内的急性皮质下脑梗死的标准治疗,一项对急性皮质下小梗死患者的研究表明,接受静脉溶栓治疗的患者比接受安慰剂的患者有更好的神经预后,然而,一项Meta分析显示,治疗前CMBs和WML 的存在使症状性ICH的风险增加了>50%,严重的WML使症状性ICH的风险增加了2.5倍,因此,对于磁共振上存在CMBs和WMH的患者,应谨慎使用溶栓治疗,根据患者的具体情况进行个体化治疗。他汀类降脂治疗是脑血管病的有效防治手段,有研究表明,WML患者服用他汀类药物可降低卒中风险,并延缓WMH进展和认知能力下降。此外,SPARCL研究报道,在CSVD患者和大血管病患者中,每天使用80 mg阿托伐他汀对预防缺血性卒中同样有效,然而,该研究显示,对于接收大剂量他汀类治疗的CSVD患者,颅内出血的风险也相应增加。另有研究显示,他汀类药物的使用虽然能有效预防卒中的复发,但却会增加颅内出血的风险,尤其是在有颅内出血和CAA病史的患者中。因此,临床上在选用他汀类防治CAA或有颅内出血病史的CSVD患者,应谨慎使用。
2 CSVD研究新进展
CSVD研究新进展神经影像学是目前研究CSVD最重要的手段,CSVD患者典型的影像学表现包括WMH、腔隙性脑梗死、脑微出血、扩大的血管周围间隙及脑萎缩。研究发现,CSVD部分影像学表现之间有密切的联系。较重的WMH是脑微出血的独立危险因素;深部和幕下的微出血体积与腔隙性脑梗死数量呈正相关(r=0.325);而WMH体积较大和扩大的血管周围间隙较多也是腔隙性脑梗死的危险因素。并且,WMH的进展可能是腔隙性脑梗死复发的独立预测指标。在回顾性研究中,我们按照WMH的进展情况对187例患者进行分组并定量WMH体积,发现存在WMH进展的患者在2年内发生腔隙性脑梗死的风险远高于WMH无进展组。结合多个影像标志物的总MRI脑小血管病评分(总SVD评分)是临床评估小血管病总负荷较为方便且常用的方法。总SVD评分项目包括腔隙灶数量≥1个,CMBs数量≥1个,中重度(>10个)基底节区扩大的血管周围间隙,WMH脑室周围Fazekas评分≥3分或深部Fazekas评分2~3分。上述项目各计1分,各项相加为总SVD评分,评分≥2分时考虑诊断脑小血管病。并且,总SVD评分可一定程度反应CSVD患者的认知状态,其与总体认知功能、执行功能和语言功能损害呈负相关。
随着影像后处理技术的发展,CSVD相关影像标志物不断完善,本研究团队利用不同影像序列进行了CSVD的早期诊断和机制探究相关研究。
2.1 基于3D TIWI分析的脑部灰质结构 灰质的结构萎缩和功能减退在CSVD脑功能损伤的早期预警和预后评估中扮演了重要的角色。高分辨率 T1 加权涡轮梯度回波序列为无创精细分割脑灰质结构提供了技术基础,FreeSurfer是目前接受度较高、灰质分割精度较好的处理软件。研究发现,双侧岛叶、右侧颞中回、右侧前扣带回、以及右侧楔叶的皮质厚度在正常对照组、CSVD不伴认知障碍组、CSVD伴认知障碍组之间呈现递减;并且右侧前扣带回和右侧颞中回的萎缩导致了记忆的受损。在合并认知障碍的2型糖尿病患者中,多个海马亚区较无认知障碍的2型糖尿病患者和正常对照组萎缩,并且与执行功能、记忆、整体认知功能的减退都存在相关性。随着分割方法的进步,我们对于幕下灰质结构的变化也进行了探索。在CSVD步态平衡障碍的研究中,借用SUIT工具包对小脑灰质进行分割,发现伴有步态平衡障碍的CSVD患者右侧小脑Ⅷa区灰质萎缩,并且萎缩的灰质体积与Tinetti量表评分和执行功能都存在中强相关性。
2.2 血氧水平依赖功能磁共振成像 (blood oxygenation level-dependent,BOLD) BOLD序列可用于描述大脑的活动性和协同性,其常见的分析指标包括局部一致性(regional homogeneity,ReHo)——描述相邻体素区域时间序列的相似性,低频波动振幅(amplitude of low-frequency fluctuations,ALFF)——描述单个体素的脑活动强度,以及功能连接(functional connectivity,FC)——描述脑区活动的协同性等。本研究团队利用ReHo指标探究了WMH伴和不伴认知障碍患者的大脑活动和连接模式,结果发现WMH伴认知障碍患者在双侧顶上回和枕上回的ReHo值显著升高,在左侧顶上回/枕上回-额叶间的FC及右侧顶上回/枕上回-顶叶间的FC也较认知正常患者显著升高。体素镜像同伦连接(voxel-mirrored homotopic connectivity,VMHC)体现了大脑半球间功能连接强度,我们发现相较于WMH认知正常患者,WMH伴认知障碍患者双侧楔叶和距状回的VMHC显著降低,而豆状核/尾状核的VMHC则显著升高,且尾状核的VMHC与总体认知功能和记忆功能呈显著相关性。此外,本研究团队也在选取不同的脑区作为种子点后进行了基于种子点的功能连接分析,研究发现糖尿病伴认知障碍患者可出现左侧脑岛-右侧楔前叶及右侧脑岛-右侧额上回FC的显著下降,高WMH负荷人群则表现为默认网络内功能连接的改变,CSVD认知功能障碍患者存在双侧海马-左侧额下回/左侧海马-左侧枕中回功能连接的显著升高。这些fMRI指标的变化提示脑活动强度及协同性的异常可能是CSVD认知障碍潜在的发病机制,可作为早期诊断的标志物。
除了上述基于体素的常见指标,本研究团队还利用BOLD序列进行脑血管反应性(cerebrovascular reactivity,CVR)相关研究,CVR可反应血管储备和脑血流调节功能,既往CVR相关研究多基于二氧化碳吸入或屏气等任务态,本团队基于0.02~0.04 Hz范围内的BOLD信号可反应呼吸末CO2水平自然变化的原理,以BOLD序列获得了CVR图谱。我们探究了WMH患者的脑血管反应性特征发现,随着WMH病变严重程度的增加,左侧枕叶内侧回(MOG)的CVR显著降低;与认知正常患者相比,WMH伴认知障碍患者表现为左额叶CVR的显著降低,且左侧额叶的CVR与整体认知功能、执行功能和信息处理速度显著相关。我们也探讨了CVR变化潜在的生物学机制,我们检测了高血压人群的血清外泌体、CVR及认知情况,发现高血压伴认知障碍患者的血清外泌体miRNA-330-3p显著降低,左内侧额上回CVR降低,中介分析进一步发现miRNA-330-3p降低可能通过左内侧额上回CVR的降低而引起患者的执行功能障碍。
脑行为是各个功能区相互协调、共同协作的结果,BOLD序列的采集使人们能够从全脑的角度、以更大的尺度来研究脑功能缺损的机制。脑网络的功能重构对早期预警和识别CSVD及其相关认知损伤有重要的价值。在CSVD发生发展的过程中,脑部功能网络呈现出动态重构,代偿和损伤并存。
在健康人群中,CSVD风险越高,执行控制网络(ECN)内以及ECN与默认模式网络(DMN)间功能连接出现代偿性增强;而在CSVD患者中,ECN和DMN的网络内功能连接稳态的破坏可能预示了早期认知功能损伤。在CSVD高风险的高血压群体中,不伴认知障碍的高血压受试者DMN子系统出现分离变化,伴认知障碍的而高血压受试者DMN各个子系统的功能连接普遍增强,其中背侧正中子系统的代偿性激活与整体认知功能下降密切相关。并且,背侧正中子系统的过度激活随着WMH的进展可出现进一步强化。这提示,DMN的功能重构可能是CSVD相关认知损伤的早期影像标志物。动态功能连接分析也显示,伴有认知障碍的WMH群体较不伴认知障碍的WMH群体DMN的中颞子系统更易出现稀疏连接状态,这种稀疏连接状态的长停留可能是WMH导致信息处理速度受损的原因。
在老年WMH人群中,通过对功能脑网络进行图论分析,研究人员发现WMH伴认知障碍的受试者全脑全局效率显著下降,以执行网络和扣带盖网络尤其明显;其中,额顶叶区域的节点整体效率介导了脑深部WMH对信息处理速度的损害;并且,借助网络差异性拓扑属性构建的机器学习模型(支持向量机)可有效识别WMH相关认知障碍的存在(准确率:81%,敏感性:76%,特异性:85%,AUC:0.86)。本研究不仅为CSVD早期识别提供了一类新的功能影像标记物,还提示额顶叶功能脑网络在CSVD脑功能损伤中扮演了重要的角色。研究发现,认知更差的CSVD患者额顶控制网络(FPCN)的网络内和网络间活动性都出现明显调制,FPCN的功能下调在高认知储备保护WMH患者认知功能的过程中可能起到了关键中介作用。步态平衡障碍的CSVD患者额顶叶区域存在过度激活,此过度激活区域对小脑的模块化功能映射受损;并且,过度激活的额顶叶区域以及其受损映射都与整体认知功能有较强的相关性。
2.3 弥散张量成像 (diffusion tensor imaging,DTI) WMH是CSVD最常见的影像标志物,室周及深部WMH体积均被发现和认知功能有显著相关性。随着研究的深入,越来越多的证据证实脑白质微结构的改变远远早于宏观白质损伤的出现,故对CSVD患者微结构的探究为其早期诊断提供了潜在的影像标志物。DTI因其对白质纤维损伤的高敏感性可用于CSVD血管总负荷的评估及结构脑网络完整性的探究。DTI利用至少6个不同方向的磁共振扩散梯度来测量水分子在白质纤维束中的扩散,可以得到反应白质微结构完整性的弥散指标,包括各向异性分数(fractional anisotropy,FA)和平均弥散率(mean diffusivity,MD)等。本研究团队基于DTI序列进行了CSVD高危人群及CSVD伴认知障碍患者的白质微结构分析,发现无论是高血压/糖尿病等高风险人群还是老年WMH患者,亦或是合并多个影像标志物的CSVD患者,都存在白质纤维微结构完整性的下降;损伤累及广泛的纤维束,包括丘脑放射束、胼胝体束、扣带束、下额枕束、下纵束等,且这种微结构的损伤程度随着认知障碍的出现进一步加重。同时,损伤纤维束的弥散指标与认知功能显著相关,如糖尿病患者右侧下额枕束及右侧上纵束的MD值与患者的语言功能呈显著负相关。此外,我们团队利用自动纤维定量技术(automated fiber quantification,AFQ)从纤维束节段的角度探究了CSVD患者的微结构损伤模式,结果显示CSVD患者呈现广泛双侧半球间对称性损伤模式,关键纤维束节段的损伤可能是不同认知域功能下降的潜在发病机制,如左侧丘脑前幅射的节段与情景记忆和语言功能相关,而右侧丘脑前幅射的中间节段则与执行功能显著相关。AFQ结合基于随机森林的机器学习方法进一步研究发现,白质纤维束微结构弥散指标可以用于鉴别WMH 伴认知功能障碍的患者,其准确率达 80.49%,证实纤维微结构完整的破坏是CSVD认知功能障碍的早期诊断的影像标志物。除了常见的弥散指标的分析,基于DTI进行的沿血管周围间隙的扩散函数指标(index of diffusion function along the perivascular space,ALPS-index),即类淋巴指数,也被用于CSVD认知障碍机制的探究。我们发现随着CSVD患者认知障碍程度的加重,ALPS-index出现显著下降;在CSVD伴轻度认知功能障碍患者中,ALPS-index与情景记忆呈显著正相关,并在WMH和认知功能障碍间起中介作用。
DTI序列也可用于脑网络分析。我们将各个脑区作为节点,脑区间的结构连接作为边构建结构脑网络,并分析WMH 伴不伴认知障碍患者间结构网络的拓扑属性差异。结果显示,WMH患者较正常对照组表现为全脑网络强度、全局效率的减低和特征路径长度的增加;WMH伴认知障碍患者则进一步出现中央前回、扣带回和颞内侧回脑区局部效率和节点路径长度的损伤。中介分析发现左侧额下回的节点路径长度介导了室周WMH对记忆损伤的影响。
除了本研究团队已经使用的分析方法,近期也出现了一些新的弥散磁共振相关标志物。如峰宽骨架化平均扩散率(peak-width skeletonized mean diffusivity,PSMD)、自由水体积分数(free water volume fraction,FW)等。PSMD是在DTI常规弥散参数基础上发展的一种快速、自动化测量的指标,在遗传性和散发性CSVD患者中,PSMD均被发现和处理速度显著相关,且相关性优于传统的CSVD标志物。FW图谱可用于区分神经元退行性变和神经炎症等神经元异常相关的细胞外自由水聚集,可以估计水肿和萎缩情况,进而更好的了解潜在的疾病病理变化,纵向研究发现FW比CSVD总分更能预测CSVD患者的认知下降。
3 展望
CSVD在老年人群中发病率极高,是卒中和痴呆的重要危险因素,严重危害老年人的生活质量和生命健康。目前的研究已经明确了CSVD相关的危险因素,但其发病机制尚不明确,缺乏早期的诊疗手段。随着DTI、功能磁共振成像、VWI和超高场MRI的日益普及,临床可以更早的发现和诊断CSVD,为早期干预和逆转CSVD开辟了新思路。此外,外周血生物标志物,对早期诊断CSVD也具有重要意义,结合影像学标志物和生物标志物超早期预警和干预CSVD将是未来的研究方向。
参考文献
[1]Wardlaw JM,Smith C,Dichgans M. Small vessel disease:mechanisms and clinical implications[J]. The Lancet Neurology,2019,18(7):684-696.
[2]Wardlaw JM,Smith C,Dichgans M. Mechanisms of sporadic cerebral small vessel disease:insights from neuroimaging[J]. The Lancet Neurology,2013,12(5):483-497.
[3]Wadlaw JM,Smith EE,Biessels GJ,et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J]. The Lancet Neurology,2013,12(8):822-838
[4]Kwon SM,Choi KS,Yi HJ,et al. Impact of brain atrophy on 90-day functional outcome after moderate-volume basal ganglia hemorrhage[J]. Sci Rep,2018,8(1):1-6.
[5][JP3]Ryu WS,Woo SH,Schellingerhout D,et al. Stroke outcomes are worse with larger leukoaraiosis volumes[J]. Brain,2017,140(1):158-170.[JP]
[6]Zhang X,Tang Y,Xie Y,et al. Total magnetic resonance imaging burden of cerebral small-vessel disease is associated with post-stroke depression in patients with acute lacunar stroke[J]. European Journal of Neurology,2017,24(2):374-380.
[7]Pantoni L. Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J]. The Lancet Neurology,2010,9(7):689-701.
[8]Litak J,Mazurek M,Kulesza B,et al. Cerebral small vessel disease[J]. International Journal of Molecular Sciences,2020,21(24):9729.
[9]Cannistraro RJ,Badi M,Eidelman BH,et al. CNS small vessel disease[J]. A Clinical Review,2019,92(24):1146-1156.
[10]Poels MM,Vernooij MW,Ikram MA,et al. Prevalence and risk factors of cerebral microbleeds:an update of the Rotterdam scan study[J]. Stroke,2010,41(Suppl1):S103-S106.
[11]Nnrayan S,Gorman G,Kalaria R,et al. The minimum prevalence of CADASIL in northeast England[J]. Neurology,2012,78(13):1025-1027.
[12]Hilal S,Mok V,Youn YC,et al. Prevalence,risk factors and consequences of cerebral small vessel diseases:data from three Asian countries[J]. Journal of Neurology,Neurosurgery & Psychiatry,2017,88(8):669-674.
[13]Khan U,Porteous L,Hassan A,et al. Risk factor profile of cerebral small vessel disease and its subtypes[J]. Journal of Neurology,Neurosurgery & Psychiatry,2007,78(7):702-706.
[14]Zhang CE,Wong SM,Vanedhaar HJ,et al. Blood-brain barrier leakage is more widespread in patients with cerebral small vessel disease[J]. Neurology,2017,88(5):426-432.
[15]Beck C,Kruetzelmann A,Forkert ND,et al. A simple brain atrophy measure improves the prediction of malignant middle cerebral artery infarction by acute DWI lesion volume[J]. Journal of Neurology,2014,261:1097-1103.
[16]Whitwell JL,Jack CR,Parisi JE,et al. Rates of cerebral atrophy differ in different degenerative pathologies[J]. Brain,2007,130(4):1148-1158.
[17]Sala S,Agosta F,Pagani E,et al. Microstructural changes and atrophy in brain white matter tracts with aging[J]. Neurobiology of Aging,2012,33(3):488-498.
[18]Nitkunan A,Lanfranconi S,Charlton RA,et al. Brain atrophy and cerebral small vessel disease:a prospective follow-up study[J]. Stroke,2011,42(1):133-138.
[19]Smith EE,Schneider JA,Wardlaw JM,et al. Cerebral microinfarcts:the invisible lesions[J]. The Lancet Neurology,2012,11(3):272-282.
[20]Alba-ferrara L,De Erausquin GA. What does anisotropy measure? Insights from increased and decreased anisotropy in selective fiber tracts in schizophrenia[J]. Frontiers in Integrative Neuroscience,2013,7:9.
[21]Ji F,Pasternak O,Liu S,et al. Distinct white matter microstructural abnormalities and extracellular water increases relate to cognitive impairment in Alzheimer’s disease with and without cerebrovascular disease[J]. Alzheimer's Research & Therapy,2017,9:1-10.
[22]Yang D,Qin R,Chu L,et al. Abnormal cerebrovascular reactivity and functional connectivity caused by white matter hyperintensity contribute to cognitive decline[J]. Frontiers in Neuroscience,2022,16.
[23]Hao Q,Tsankova N,Shoirah H,et al. Vessel wall MRI enhancement in noninflammatory cerebral amyloid angiopathy[J]. American Journal of Neuroradiology,2020,41(3):446-448.
[24]De Havenon A,Lobo R,Eisenmenger L,et al. Abstract WP138:MRI Detection of Vessel Wall Inflammation and Contrast Leakage in Cerebral Amyloid Angiopathy[J]. Stroke,2017,48(Suppl1):138.
[25]Van Middelaar T,Argillander TE,Schreuder FH,et al. Effect of antihypertensive medication on cerebral small vessel disease:a systematic review and meta-analysis[J]. Stroke,2018,49(6):1531-1533.
[26]Wang Y,Wang Y,Zhao X,et al. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack[J]. N Engl J Med,2013,369:11-19.
[27]Mok V,Kim JS. Prevention and management of cerebral small vessel disease[J]. Journal of Stroke,2015,17(2):111-122.
[28]Charidimou A,Pasi M,Fiorelli M,et al. Leukoaraiosis,cerebral hemorrhage,and outcome after intravenous thrombolysis for acute ischemic stroke:a meta-analysis[J]. Stroke,2016,47(9):2364-2372.
[29]Xiong Y,Wong A,Cavalieri M,et al. Prestroke statins,progression of white matter hyperintensities,and cognitive decline in stroke patients with confluent white matter hyperintensities[J]. Neurotherapeutics,2014,11:606-611.
[30]Amarenco P,Bebavebte O,Goldstein LB,et al. Results of the stroke prevention by aggressive reduction in cholesterol levels (SPARCL) trial by stroke subtypes[J]. Stroke,2009,40(4):1405-1409.
[31]Group HPSC. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals:a randomised placebocontrolled trial[J]. The Lancet,2002,360(9326):7-22.
[32]许衡衡,邵鹏飞,马俊怡,等. 脑微出血与脑小血管病患者腔隙性脑梗死的相关性[J]. 国际脑血管病杂志,2021,29(4):258-264.
[33]陈 歆,顾雨铖,邹君惠,等. 脑小血管病患者脑白质病变评分及体积与脑微出血的相关性[J]. 国际脑血管病杂志,2018,26(11):819-825.
[34]Xu X,GAO Y,LIU R,et al. Progression of White Matter Hyperintensities Contributes to Lacunar Infarction[J]. Aging Dis,2018,9(3):444-452.
[35]顾雨铖,刘任远,秦若梦,等. 总MRI脑小血管病评分与认知功能的相关性[J]. 国际脑血管杂志,2018,26(7):521-527.
[36]Mo Y,Hhang L,Qin R,et al. Decreased cortical thickness and normal regional homogeneity underlying cognitive impairment in cerebral small vessel disease[J]. AN,2022. doi:10.36922/an.v1i1.48.
[37]Li M,Huang L,Yang D,et al. Atrophy patterns of hippocampal subfields in T2DM patients with cognitive impairment[J]. Endocrine,2020,68(3):536-548.
[38]Mo Y,Mao C,Yang D,et al. Altered neuroimaging patterns of cerebellum and cognition underlying the gait and balance dysfunction in cerebral small vessel disease[J]. Frontiers in Aging Neuroscience,2023,15(3):1117973.
[39]Ye Q,Chen X,Qin R,et al. Enhanced regional homogeneity and functional connectivity in subjects with white matter hyperintensities and cognitive impairment[J]. Front Neurosci,2019,13:695.
[40]Shao P,Li X,Qin R,et al. Altered local gyrification and functional connectivity in type 2 diabetes mellitus patients with mild cognitive impairment:a pilot cross-pal small-scale single center study[J]. Front Aging Neurosci,2022,14:934071.
[41]Chen X,Huang L,Ye Q,et al. Disrupted functional and structural connectivity within default mode network contribute to WMH-related cognitive impairment[J]. Neuroimage Clin,2019,24:102088.
[42]陈海峰,刘任远,秦若梦,等. 脑小血管病认知障碍患者静息态海马功能连接研究[J]. 阿尔茨海默病及相关病,2018,1(3):180-187.
[43]Yang D,Qin R,Chu L,et al. Abnormal cerebrovascular reactivity and functional connectivity caused by white matter hyperintensity contribute to cognitive decline[J]. Front Neurosci,2022,16:807585.
[44]Ma J,Cao X,Chen F,et al. Exosomal microRNAs contribute to cognitive impairment in hypertensive patients by decreasing frontal cerebrovascular reactivity[J]. Front Neurosci,2021,15:614220.
[45]Liu R,Cen H,Qin R,et al. The altered reconfiguration pattern of brain modular architecture regulates cognitive function in cerebral small vessel disease[J]. Front Neurol,2019,10:324.
[46]Gu Y,Liu R,Qin R,et al. Characteristic changes in the default mode network in hypertensive patients with cognitive impairment[J]. Hypertens Res,2019,42(4):530-40.
[47]Yang D,Li J,Ke Z,et al. Subsystem mechanisms of default mode network underlying white matter hyperintensity-related cognitive impairment[J]. Hum Brain Mapp,2023,44(6):2365-2379.
[48]Chen H,Huang L,Yang D,et al. Nodal global efficiency in front-parietal lobe mediated periventricular white matter hyperintensity (PWMH)-related cognitive impairment[J]. Frontiers in Aging Neuroscience,2019,11:347.
[49]Liu R,Wu W,Ye Q,et al. Distinctive and pervasive alterations of functional brain networks in cerebral small vessel disease with and without cognitive impairment[J]. Dement Geriatr Cogn Disord,2019,47(1-2):55-67.
[50]Ye Q,Zhu H,Chen H,et al. Effects of cognitive reserve proxies on cognitive function and frontoparietal control network in subjects with white matter hyperintensities:a cross-pal functional magnetic resonance imaging study[J]. CNS Neurosci Ther,2022,28(6):932-941.
[51]Chen H,Zhu H,Huang L,et al. The flexibility of cognitive reserve in regulating the frontoparietal control network and cognitive function in subjects with white matter hyperintensities[J]. Behav Brain Res,2022,425:113831.
[52]邹君惠,高圆圆,秦若梦,等. 高血压病患者脑白质高信号体积与认知功能的相关性分析[J]. 中华神经科杂志,2019,52(3):190-196.
[53]Huang L,Chen X,Sun W,et al. Early segmental white matter fascicle microstructural damage predicts the corresponding cognitive domain impairment in cerebral small vessel disease patients by automated fiber quantification[J]. Front Aging Neurosci,2020,12:598242.
[54]Chen HF,Huang LL,Li HY,et al. Microstructural disruption of the right inferior fronto-occipital and inferior longitudinal fasciculus contributes to WMH-related cognitive impairment[J]. CNS Neurosci Ther,2020,26(5):576-588.
[55]李梦春,罗财妹,秦若梦,等. 2型糖尿病合并认知功能障碍患者的脑白质结构变化的影像学特征分析[J]. 中国临床神经科学,2019,27(6):624-632,657.
[56]邹君惠,陈 歆,顾雨铖,等. 脑白质微结构完整性与高血压患者认知功能的相关性[J]. 国际脑血管病杂志,2019,27(1):21-30.
[57]Ke Z,Mo Y,Li J,et al. Glymphatic dysfunction mediates the influence of white matter hyperintensities on episodic memory in cerebral small vessel disease[J]. Brain Sci,2022,12(12):1611.
[58]Yang D,Huang L,Luo C,et al. Impaired structural network properties caused by white matter hyperintensity related to cognitive decline[J]. Front Neurol,2020,11:250.
[59]Baykara E,Gesierich B,Adam R,et al. A novel imaging marker for small vessel disease based on skeletonization of white matter tracts and diffusion histograms[J]. Ann Neurol,2016,80(4):581-592.
[60]Kamagata K,Anadica C,Kato A,et al. Diffusion magnetic resonance imaging-based biomarkers for neurodegenerative diseases[J]. Int J Mol Sci,2021,22(10):5216.
[61]Zhu Z,Zeng Q,Zhang R,et al. White matter free water outperforms cerebral small vessel disease total score in predicting cognitive decline in persons with mild cognitive impairment[J]. J Alzheimers Dis,2022,86(2):741-751.
引证本文
徐 运. 脑小血管病的诊疗现状和研究新进展[J]. 中风与神经疾病杂志,2023,40(4):291-296.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言