【综述】| “精准医疗”时代从乳腺癌分子分型探讨抗体-药物偶联物的临床价值及最新研究进展
2024-01-26 中国癌症杂志 中国癌症杂志 发表于陕西省
本文旨在从不同分子分型乳腺癌患者的ADC药物治疗出发,介绍最新的相关研究进展并探讨ADC在乳腺癌中的临床应用价值。
[摘要] 乳腺癌的发病率目前已位居女性恶性肿瘤之首。乳腺癌具有高度异质性,可分为luminal A、luminal B、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过表达及三阴性型4种分子分型。然而既往的分子分型方法导致处于HER2低表达状态患者的治疗选择十分有限。近年来,随着抗体-药物偶联物(antibody-drug conjugate,ADC)的飞速发展,使HER2低表达乳腺癌患者获得了新的治疗选择,并促进了当前国内外指南中对HER2表达状态判定标准的更新——基于免疫组化(immunohistochemistry,IHC)和原位杂交(in situ hybridization,ISH)检测技术,将HER2的表达分为HER2阳性(IHC 3+或IHC 2+/ISH+)、HER2低表达(IHC 1+或IHC 2+/ISH-)以及HER2阴性(IHC 0)3种情况。ADC是一种由连接子将单克隆抗体与细胞毒性物质偶联而成的免疫偶联物。在乳腺癌领域,多项大型临床试验已经证明了以HER2为靶点的ADC恩美曲妥珠单抗(T-DM1)、德曲妥珠单抗(T-DXd)以及以滋养层细胞表面抗原2(trophoblast cell surface antigen 2,TROP2)为靶点的ADC戈沙妥珠单抗在不同分子分型乳腺癌患者中的临床获益。随着DESTINY-Breast03等Ⅲ期临床试验发现T-DXd在晚期HER2阳性乳腺癌患者中的临床疗效优于T-DM1(完全缓解率约为T-DM1的2倍,中位无进展生存期约为T-DM1的4倍),T-DXd现今已经替代T-DM1成为HER2阳性乳腺癌二线治疗唯一推荐的药物,也是脑转移局部治疗后二线治疗的选择。Ⅲ期临床试验DESTINY-Breast04证实T-DXd同样可使HER2低表达的乳腺癌患者获益,这进一步改变了晚期乳腺癌的治疗格局,并支持重新定义HER2阴性乳腺癌分子亚型的必要。Ⅲ期临床试验ASCENT证实戈沙妥珠单抗可显著改善三阴性乳腺癌(triple-negative breast cancer,TNBC)患者的生存情况及生活质量,且Ⅱ期临床试验NeoSTAR发现该药在TNBC新辅助治疗中也可能具有良好的抗肿瘤作用。基于循证医学证据,目前T-DM1、T-DXd和戈沙妥珠单抗均已在国外和中国陆续获批上市。其他如HER3-DXd、Dato-DXd及中国研发的纬迪西妥单抗(RC48)等ADC药物也正在乳腺癌等肿瘤中广泛地开展临床研究。此外,尚有多种其他分子靶点的ADC仍正在积极地研发中。本文旨在从不同分子分型乳腺癌患者的ADC药物治疗出发,介绍最新的相关研究进展并探讨ADC在乳腺癌中的临床应用价值。
[关键词] 乳腺癌;分子分型;人类表皮生长因子受体2;抗体-药物偶联物
[Abstract] The incidence of breast cancer currently ranks first among malignant tumors in women. Breast cancer exhibits high heterogeneity and can be classified into four molecular subtypes: luminal A, luminal B, human epidermal growth factor receptor 2 (HER2) overexpression and triple-negative. However, previous molecular subtype classifications have limited treatment options for patients with HER2 low expression. In recent years, with the rapid development of antibody-drug conjugates (ADCs), new treatment options have emerged for breast cancer patients with HER2 low expression. This has also led to updates in the criteria for determining HER2 expression status in both domestic and international guidelines, based on immunohistochemistry (IHC) and in situ hybridization (ISH) testing, categorizing HER2 expression as HER2-positive (IHC 3+ or IHC 2+/ISH+), HER2 low expression (IHC 1+ or IHC 2+/ISH-),and HER2-negative (IHC 0). ADCs are immunotherapeutics composed of a linker that conjugates a monoclonal antibody with a cytotoxic payload. In the field of breast cancer, several large clinical trials have demonstrated clinical benefits of ADCs targeting HER2, such as trastuzumab emtansine (T-DM1), trastuzumab deruxtecan (T-DXd) and sacituzumab govitecan targeting trophoblast cell surface antigen 2 (TROP2), in various molecular subtypes of breast cancer. With the phase Ⅲ DESTINY-Breast03 trial and others, T-DXd has been found to have superior efficacy compared to T-DM1 in advanced HER2-positive breast cancer patients (approximately two times higher complete response rate, and four times longer median progression-free survival). T-DXd has now replaced T-DM1 as the recommended second-line therapy for HER2-positive breast cancer and as a second-line treatment option after local treatment for brain metastasis. The phase Ⅲ DESTINY-Breast04 trial confirmed that breast cancer patients with HER2 low expression can also benefit from T-DXd, further reshaping the treatment landscape for advanced breast cancer and supporting the need to redefine molecular subtypes of HER2-negative breast cancer. The phase Ⅲ ASCENT trial demonstrated that sacituzumab govitecan significantly improved survival and quality of life in triple-negative breast cancer (TNBC) patients, and the phase Ⅱ NeoSTAR study suggested its potential as neoadjuvant therapy in TNBC. Based on evidence, T-DM1, T-DXd and sacituzumab govitecan have been approved for marketing in both foreign and Chinese markets. Other ADC drugs, such as HER3-DXd, Dato-DXd and China-developed RC48, are also undergoing extensive clinical trials in the field of breast cancer and other tumors. Furthermore, there are several other ADCs targeting different molecular targets in active development. This article aimed to review the new advances related to ADCs therapy for breast cancer patients with different molecular subtypes and discuss the clinical application value of ADCs in breast cancer.
[Key words] Breast cancer; Molecular typing; Human epidermal growth factor receptor 2; Antibody-drug conjugate
乳腺癌的发病率位列女性恶性肿瘤之首,2020年GLOBOCAN数据显示,全球约有226.14万乳腺癌患者,发病率为47.8/10万人,其中中国乳腺癌发病例数约41.6万人,占全球乳腺癌新发病例的18.4%[1-2]。乳腺癌是一类在分子水平上具有高度异质性的肿瘤,超过50%的乳腺癌处于人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)低表达状态[3];而在既往传统分子分型定义中这部分患者被判定为HER2阴性,被排除在HER2靶向治疗之外,主要以激素受体(hormone receptor,HR)状态为指导接受内分泌治疗或化疗,且在治疗失败后的后线治疗选择十分有限[4-5]。此外,目前的免疫组织化学(immunohistochemistry,IHC)检测技术也并不能准确识别出HER2低表达检测的结果[6]。在当前“精准医疗”的需求下,分子分型标准是否充分满足乳腺癌诊疗及预后预测的需求,值得深入思考。
基于IHC和原位杂交(in situ hybridization,ISH)技术检测,《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》将乳腺癌分为luminal A(HER2阴性且HR阳性,Ki-67增殖指数低)、luminal B(HER2阴性且HR阳性,Ki-67增殖指数高)、HER2过表达(HER2阳性)及三阴性型(HER2及HR均为阴性)[7]。此外,该版指南对HER2的表达状态进行了更精细的区分,由既往的HER2阳性/HER2阴性两种表达状态调整为HER2阳性(IHC 3+或IHC 2+/ISH+)、HER2低表达(IHC 1+或IHC 2+/ISH-)以及HER2阴性(IHC 0)3种状态[7]。这种调整主要基于近年来抗体-药物偶联物(antibody drug conjugate,ADC)在乳腺癌中的突破性进展——大量既往被判定为HER2阴性的乳腺癌患者能够从靶向HER2的ADC药物治疗中显著获益。有鉴于此,本文针对ADC药物治疗不同分子分型乳腺癌患者的研究进展予以介绍,并探讨乳腺癌HER2不同表达状态下ADC药物的临床应用价值。
1 ADC药物在乳腺癌中的应用概况
ADC是一种由连接子将单克隆抗体与细胞毒性物质(也称“有效载荷”或“弹头”)偶联而成的免疫偶联物,其中单克隆抗体和细胞毒性物质是发挥抗肿瘤作用的主要成分,而连接子的特性可直接影响ADC药物的药效发挥。ADC的研发经历了数个阶段[8-9]:第一代ADC药物靶向性不强,免疫原性较强,且连接子的不稳定性可能导致细胞毒性物质过早释放而带来毒性反应;第二代ADC药物采用不可切割的连接子,从而避免了细胞毒性物质在进入靶细胞前过早释放的问题;第三代ADC药物在载药数量、连接子设计、细胞毒性物质的选择上有了进一步的改进,具有更出色的临床疗效和安全性。
在乳腺癌的治疗中,已上市的以HER2为靶点的ADC包括第二代ADC药物恩美曲妥珠单抗(T-DM1)及第三代ADC药物德曲妥珠单抗(T-DXd)。2019—2022年,T-DXd被美国食品药品管理局(Food and Drug Administration,FDA)等多个国家/机构批准用于治疗不可切除或转移性的HER2阳性和HER2低表达的乳腺癌患者。2020年,以滋养层细胞表面抗原2 (trophoblast cell surface antigen 2,TROP2)为靶点的ADC药物戈沙妥珠单抗(sacituzumab govitecan)也被FDA批准用于治疗既往接受二线及以上治疗后的不可切除或转移性的三阴性乳腺癌(triple-negative breast cancer,TNBC)。此外,以HER2为靶点的首个国产ADC药物纬迪西妥单抗(RC48)在HER2阳性和HER2低表达乳腺癌中也开展了临床研究[10]。目前,上述ADC药物已经在国内上市或即将获批,多种其他分子靶点的ADC药物也正在积极开发中。
2 ADC药物在HER2阳性(IHC 3+或IHC 2+/ISH+)乳腺癌中研究进展
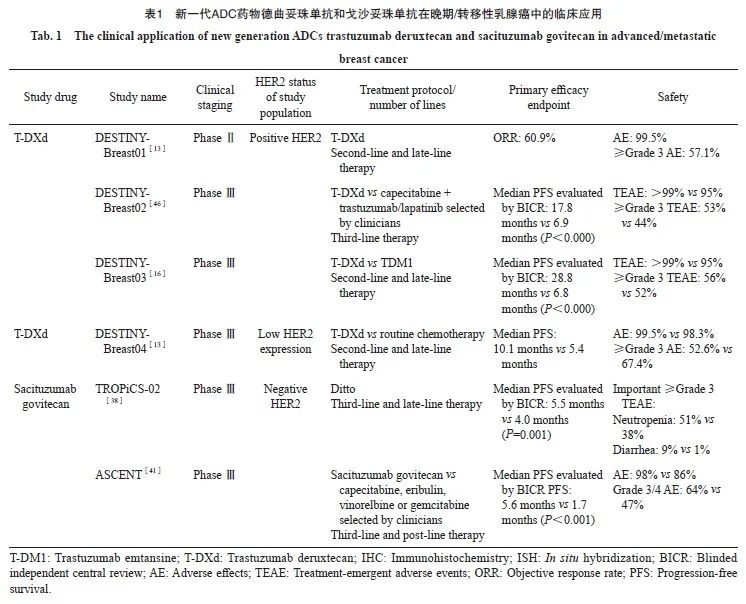
乳腺癌患者中有20%~30%表现为HER2阳性[11],此类患者的治疗选择相对更多。目前,曲妥珠单抗+帕妥珠单抗双靶向治疗联合紫杉类药物化疗仍然是HER2阳性晚期乳腺癌的首选一线标准治疗方案。而在曲妥珠单抗治疗失败后,针对晚期/转移性乳腺癌患者,还可选择酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)或ADC药物等方案[7]。
在临床可选择的ADC药物中,T-DM1是由曲妥珠单抗、细胞毒药物DM1(微管蛋白抑制剂)以及不可裂解的硫醚连接子组成。T-DXd则由曲妥珠单抗通过可切割的四肽连接体与依沙替康衍生物(DXd)偶联而成。两款ADC药物均具有双重治疗作用机制,不仅可将细胞毒性药物选择性递送到表达HER2蛋白的肿瘤细胞从而发挥杀伤作用,也可通过曲妥珠单抗激活抗体依赖细胞介导的细胞毒性,或抑制HER2介导的信号转导[12]。其中,T-DXd具有比T-DM1更高的抗体药物比(8 vs 3~4),其所含的可裂解连接子结构可促进DXd在裂解后穿透靶细胞或邻近细胞的细胞膜,具有杀伤除HER2阳性细胞外的其他异质性肿瘤细胞的“旁观者效应”[13],这可能是T-DXd相比T-DM1抗肿瘤活性更高的重要原因之一。
Ⅲ期临床试验EMILIA研究[14]在既往接受曲妥珠单抗和紫杉烷治疗并发生疾病进展的HER2阳性乳腺癌患者中证实,T-DM1相比卡培他滨+拉帕替尼方案可改善此类患者的中位无进展生存期(progression-free survival,PFS;P<0.001)和中位总生存期(overall survival,OS;P<0.001)。该研究成功奠定了T-DM1在HER2阳性乳腺癌二线治疗中的地位。而近年来Ⅲ期临床试验DESTINY-Breast03研究[15-16]的结果显示,T-DXd在晚期HER2阳性乳腺癌患者(包括既往接受过帕妥珠单抗治疗、内脏转移和稳定性脑转移等预后较差的多个亚组人群)的治疗中具有优于T-DM1的临床获益:T-DXd相较T-DM1进一步提高了疗效,客观缓解率(objective response rate,ORR)显著提高(79.7% vs 34.2%),同时也超越了既往临床试验所报告的T-DM1在一线(64.0%)、二线(43.0%~44.0%)、三线治疗(31.0%)中的ORR值[14,17-19],且T-DXd组患者的完全缓解率(21.1%)几乎是T-DM1组(8.7%)的两倍[15],中位PFS(28.8个月)约为T-DM1组(6.8个月)的4倍,中位OS相比T-DM1也显著延长(风险比为0.64,95% CI:0.47~0.87)[16]。
DESTINY-Breast03研究的突破性结果成功改变了HER2阳性晚期乳腺癌的二线治疗格局,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)、美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)和欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)等多个机构发布的乳腺癌指南均更新了T-DXd替代T-DM1作为HER2阳性乳腺癌二线治疗的唯一推荐药物,以及脑转移局部治疗后的二线治疗选择,且该药在帕妥珠单抗经治人群中的获益显著优于T-DM1[20- 22]。相较既往TKI及T-DM1的相关临床试验设计,DESTINY-Breast03研究[15]入组的既往接受过一线治疗的患者比例约为48%,其中包含了临床实际中可能会出现的于一线治疗后快速进展的患者,此类患者需要及时、有效的治疗,因此该研究为这部分人群的治疗选择也提供了一定参考依据。
尽管并非一线治疗,但T-DXd在HER2阳性晚期乳腺癌患者中观察到的PFS(28.8个月)比既往一线治疗方案显著延长(曲妥珠单抗+帕妥珠单抗+多西他赛治疗为18.5个月,T-DM1治疗为14.1个月)[23-24]。同时,DESTINY-Breast03研究[25]中T-DXd治疗组的PFS2为40.5个月,显著长于T-DM1组的25.7个月,这意味着在延长从患者随机到二线治疗后进展/死亡的时间方面, T-DXd更具优势,提示更早地使用该药可能使患者获益更大。该药或有望向乳腺癌前线治疗迈进,未来也期待将T-DXd作为一线、辅助或新辅助治疗而设计的DESTINY-Breast05、09和11等临床研究结果的公布。
抗HER2治疗失败后的三线治疗选择相对有限,在没有脑转移的情况下,TKI药物奈拉替尼+卡培他滨可能是HER2阳性晚期乳腺癌三线治疗的选择[26]。而在有脑转移的情况下,根据HER2CLIMB研究[27]结果,2021年版NCCN指南即开始推荐使用含图卡替尼的方案。在DESTINY-Breast03研究[28]的脑转移亚组人群中,T-DXd相比T-DM1,可使疾病进展或死亡风险降低75%,ORR分别为67.4%和20.5%,并提高了12个月的PFS率(72.0% vs 20.9%);同时,接受T-DXd治疗的脑转移HER2阳性乳腺癌患者的总体颅内缓解率和完全颅内缓解率分别为63.8%和27.8%,而T-DM1组只有33.3%和2.8%[28]。此外,TUXEDO-1研究[29]结果发现,对于新诊断为未经治的脑转移/经局部治疗后进展的脑转移的HER2阳性乳腺癌成人患者,在标准剂量为5.4 mg/kg的T-DXd治疗下,总体颅内缓解率达到73.3%。DEBBRAH研究[30]也报告了伴有无症状未经治脑转移和进展期脑转移的HER2阳性的晚期乳腺癌患者,在接受T-DXd治疗后颅内缓解率分别为50.0%和44.4%。ROSET-BMT-DXd研究[31]结果表明,T-DXd治疗处于稳定性、活动性脑转移或者出现软脑膜癌的HER2阳性乳腺癌患者均具有良好获益,在具有上述脑部病变的患者中总体颅内缓解率为62.7%。这些脑转移人群的数据无疑支持了T-DXd作为乳腺癌脑转移患者的新的治疗选择。同时,T-DXd联合图卡替尼治疗既往接受过多线治疗的、伴/不伴脑转移的HER2阳性不可切除局部晚期/转移性乳腺癌患者的HER2CLIMB-04试验(NCT04539938)目前也正在入组中,期待其结果可为HER2阳性转移性乳腺癌尤其是伴脑转移患者的治疗方案提供证据。
在晚期乳腺癌的后线治疗中,对T-DXd产生耐药的患者,可以继续使用既往未使用过的TKI或单克隆抗体的联合方案[32]。根据DESTINY-Breast03研究[25]的PFS2结果,T-DM1治疗仍然可以在一定程度上延缓晚期HER2阳性乳腺癌的疾病进展,因此,对于T-DXd耐药患者也可选择T-DM1。未来基于新型抗HER2 TKI(如奈拉替尼/图卡替尼)联合新型抗HER2单抗(如margetuximab等)的双重HER2阻断疗法,以及其他靶向HER2的ADC药物(如SYD985等)也具有一定潜力[32]。
综上可见,ADC药物已经在HER2阳性晚期乳腺癌的治疗中占据重要地位,基于HER2分子分型的诊断对于ADC药物的临床使用具有至关重要的指导价值。
3 ADC在HER2低表达(IHC 1+或IHC 2+/ISH-)乳腺癌中的研究进展
基于现有的分子分型标准,有研究[33]发现,在HR阳性乳腺癌患者中可能约有64%属于HER2低表达(IHC 1+或IHC 2+/ISH-),也有研究[34]表明,在既往判定的HER2阴性的患者中,约有45%的患者实际为HER2低表达,这部分患者也可能错失了靶向治疗机会。研究[35]显示,美国2010—2019年诊断的乳腺癌患者中HER2低表达患者已过半,约占65.5%,因此针对这部分患者的“精准治疗”具有重要临床意义。
DESTINY-Breast04研究[13]是首个针对HER2低表达转移性乳腺癌患者的随机Ⅲ期临床试验,入组人群为HER2低表达[IHC 2+/ISH-或IHC 1+/ISH(-或未测得)]、既往接受过1 ~ 2线化疗的不可切除和(或)转移性乳腺癌患者。该研究计划入组的HR阳性与阴性患者比为480∶60,最终纳入的患者比例分别约为90%和10%,符合乳腺癌患者的流行病学特点[33];统计学方案中主要和关键次要终点均参与了一类错误(α)控制,所有人群PFS和OS数据具有统计学效力。结果显示,相比常规化疗组患者,HR阳性HER2低表达患者中T-DXd组的ORR(52.6% vs 16.3%)、中位PFS(10.1个月 vs 5.4个月)、中位OS(23.9个月 vs 17.5个月)均得到显著提升,包括在所有分层亚组中均表现出一致的PFS获益。HR阴性、 HER2低表达患者在接受T-DXd后,相比常规化疗组患者也具有更高的ORR(50.0% vs 16.7%)、更长的中位PFS(8.5个月 vs 2.9个月)和中位OS(18.2个月 vs 8.3个月)[13]。HR阴性人群中T-DXd组的获益与总人群一致,表明总人群的获益并非仅由HR阳性组所驱动,即无论是在HR阳性或HR阴性的人群中,T-DXd均可使HER2低表达乳腺癌患者获益。基于上述结果,FDA更新了T-DXd的说明书,在既往获批的不可切除或转移性HER2阳性乳腺癌的基础上,进一步增加其可以用于治疗不可切除或转移性的HER2低表达乳腺癌患者的适应证。
以往在CDK4/6抑制剂一线治疗或二线治疗后再进展的HR阳性转移性性乳腺癌患者中,接受化疗后患者的预后并不理想,中位PFS分别仅为7.2和6.5个月[34]。DESTINY-Breast04研究[13]入组的HR阳性患者包括既往接受过CDK4/6抑制剂、内分泌治疗或免疫治疗,其结果显示,无论既往是否接收过CDK4/6抑制剂,均可达10个月及以上的PFS。此外,DESTINY-Breast04研究[36]也纳入了22例快速进展(定义为辅助化疗期间或完成辅助化疗后6个月内疾病复发)的HER2低表达乳腺癌患者,此类患者经T-DXd治疗50%可获得客观缓解,而常规化疗组的ORR为0%;且T-DXd组中位PFS也更长(8.2个月 vs 2.2个月)。FDA认为此类患者因具有高风险且缺乏有效治疗手段,尽管其在转移性疾病阶段未接受治疗,但根据上述该亚组数据,也支持T-DXd可用于此类快速进展的患者[37]。
此外,目前也有其他ADC药物开启了涉及HER2低表达乳腺癌患者的探索,如SYD985的Ⅰ期研究(NCT02277717,入组人群包括HER2表达至少为IHC 1+)和RC48的Ⅰ/Ⅱ期研究[NCT03052634,入组人群包括HER2 IHC 2+/FISH-或IHC 1+/FISH(-/未测到)]。
总之,DESTINY-Breast04研究结果证明,无论HR状态如何,T-DXd均可改善HER2低表达乳腺癌患者的生存情况,进一步改变了晚期乳腺癌的治疗格局,突出了HER2低表达患者群体获益的临床相关性,并支持重新定义HER2阴性乳腺癌中亚型的必要。而HER2低表达人群与既往定义的HR阳性或TNBC患者可能存在部分重叠,这意味着未来有关乳腺癌靶向药物的开发应该更加精准地设计适用人群。
4 ADC在HER2阴性(IHC 0)乳腺癌中的研究进展
4.1 HR阳性/HER2阴性乳腺癌的治疗
HR阳性乳腺癌患者的一线治疗以内分泌治疗联合或不联合CDK4/6抑制剂和化疗为主,一旦治疗失败,可以选择其他靶向药物联合治疗或化疗。而既往的真实世界证据表明,对于HR阳性/HER2阴性的乳腺癌患者,CDK4/6抑制剂换线治疗带来的PFS较短[13]。尽管DESTINY-Breast04研究[13]未纳入HER2 IHC 0的患者,但其HR阳性人群的获益(无论是否接受过CDK4/6抑制剂治疗),仍然为乳腺癌内分泌治疗耐药后的治疗带来了启发。戈沙妥珠单抗是一种通过可裂解的马来酰亚胺连接体将靶向TROP2的抗体与SN-38(伊立替康的活性代谢物)偶联的ADC药物。Rugo等[38]于2022年ASCO大会上报告了TROPiCS-02研究的阶段性结果,发现对于HR阳性/HER2阴性不可切除的局部晚期或转移性乳腺癌患者,使用戈沙妥珠单抗与标准治疗(卡培他滨、艾立布林、长春瑞滨或吉西他滨)相比,其中位PFS有所提升(5.5个月 vs 4.0个月,P=0.000);同时,在ORR(21% vs 14%)和临床获益率(34% vs 22%)方面,该药均显著优于标准治疗方案。此外,正在开展的DESTINY-Breast06研究的设计也对其入组人群(HER2低表达或HER2 IHC 0~1+)进行了CDK4/6抑制剂治疗的亚组分层,未来相关研究结果将进一步提供参考。综上,针对HR阳性/HER2阴性乳腺癌患者,ADC药物可带来更多选择,并有望解决CDK4/6抑制剂治疗后的疾病再进展问题。
4.2 TNBC的ADC药物治疗
TNBC的病理学特征为HR和HER2均为阴性,其中大部分为Basal-Like型[7]。此类患者的肿瘤相对较大、淋巴结阳性率较高,系统治疗选择类型相对单一,复发和死亡风险更高[39]。研究[40]发现,80%~90%的TNBC患者肿瘤组织中都能够检测到TROP2阳性(≥10%的肿瘤细胞IHC染色阳性定义为TROP2阳性),且与转移性TNBC患者预后差有关。因此,TROP2成为了TNBC的重要靶点。
针对TNBC患者,联合或单药化疗仍是一线及后线主要治疗方案,此外还可选择免疫检查点抑制剂和多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂等。而ADC药物的发展已打开了TNBC二线及后线治疗的路径。Ⅲ期临床试验ASCENT[41]结果显示,在既往接受过至少二线化疗的转移性TNBC患者中,接受戈沙妥珠单抗相比标准治疗(卡培他滨、艾立布林、长春瑞滨或吉西他滨),可显著延长患者的中位PFS(5.6个月 vs 1.7个月)和中位OS(12.1个月 vs 6.7个月);该药总体上安全性可控且使患者生活质量得到明显改善[41-42]。基于该研究结果,戈沙妥珠单抗已成功获批用于TNBC患者的治疗。此外,Ⅱ期临床试验NeoSTAR研究[43]发现,未经治的TNBC(肿瘤≥1 cm,或任意肿瘤大小但淋巴结阳性)患者在接受4个周期戈沙妥珠单药治疗后,直接进行手术患者的病理学完全缓解率达30%;该研究结果反映出戈沙妥珠单抗在新辅助治疗中的良好活性,使之成为首个应用于TNBC新辅助治疗领域的ADC药物[43]。
另一种靶向TROP2的ADC药物DS-1062a(datopotamab deruxtecan,Dato-DXd)的TROPION-Breast和TROPION-PanTumor系列临床试验也正在积极开展。与戈沙妥珠单抗相比,该药半衰期更长,有效载荷更强,可以减少对正常细胞的脱靶毒性[44],因此可能具有更佳的疗效和安全性。Dato-DXd已在经过多线治疗后的TNBC患者中展现出良好的治疗前景和安全性,ORR为32%,中位PFS和OS分别为4.3和12.9个月[45]。评估Dato-DXd作为治疗转移性TNBC的一线疗法的疗效和安全性的TROPION-Breast02(NCT05374512)研究正在进行中,也期待其未来相关研究结果的公布,为临床带来新的证据 [46]。
目前,T-DXd、戈沙妥珠单抗以及PARP抑制剂治疗已成为传统定义的TNBC二线及后线治疗选择。随着越来越多ADC药物进入临床应用,针对不同的人群,需要谨慎考虑ADC药物的使用优先顺序。此外,随着分子分型标准的变更,未来针对TNBC人群的靶点的探寻可能需要更加精准(表1)。
5 其他分子靶点乳腺癌ADC药物的进展
HER3是EGFR受体家族的另一个成员,HER2-HER3二聚体对HER2介导的信号转导至关重要[47]。Patritumab deruxtecan(HER3-DXd)已在临床前研究中被证明对表达野生型HER3或HER3突变的乳腺癌具有抗肿瘤活性[48],有望用于治疗转移性乳腺癌和HER2低表达或HER2不表达的乳腺癌患者。目前该药已进入临床研发阶段,TOT-HER3研究正在评估HER3-DXd在HR阳性/HER2阴性早期乳腺癌患者中的生物活性 (表2)。
此外,还有一些新靶点ADC药物,如enfortumab vedotin和SGN-LIV1A等也正在既往接受过治疗的局部晚期或转移性TNBC乳腺癌患者中进行探索(表2)。尽管相关研究尚在初步阶段,但可以预见,这些新靶点ADC药物的发展有望为当前乳腺癌患者尤其是TNBC患者中缺乏有效的靶向治疗药物的问题提供解决方案。

6 乳腺癌分子分型的未来展望
“精准医疗”时代,鉴于T-DXd在HER2低表达乳腺癌患者中的优异表现,未来HER2低表达能否作为独立的分子亚型已经引起关注。分子亚型能够成立通常需要满足的条件包括:能够代表一类独特的生物学特征,具有预后预测价值以及能够指导临床治疗选择。考虑到目前HER2低表达的定义是由临床实践推导而来,尽管在指导ADC用药方面有重要价值,但在患者预后和肿瘤生物学特征方面,其与HER2不表达乳腺癌是否存在差异目前研究者并未形成一致性意见[49-51]。因此,HER2低表达能否作为独立的分子亚型仍需更多的证据支持。2023年更新的《美国临床肿瘤学会和美国病理学会乳腺癌HER2检测指南》认为,虽然创建新的HER2表达结果类别(例如HER2低表达、HER2超低表达)还为时过早,但是区分IHC评分为0与1+的最佳实践目前仍具有临床意义;即HER2低表达虽然并非一种分子亚型,但可作为临床策略亚组[52]。
关于乳腺癌分子分型的发展,未来仍有多个值得深入探索的方向,如拓展分型分子的表达谱、提高生物标志物检测技术和统一的检测标准等。DESTINY-Breast06(NCT04494425)研究目前已经完成了入组计划,包含HER2 IHC 2+/ISH-或IHC 1+、HER2 IHC >0<1+、HER2 IHC 0(ISH-或未检测到)的乳腺癌患者,未来可能进一步拓宽T-DXd的使用人群范围。
7 总结
分子分型是指导乳腺癌临床诊疗的重要依据。ADC药物的快速发展,尤其是新一代ADC药物T-DXd、戈沙妥珠单抗等在乳腺癌治疗中的优异表现,使人们认识到提高乳腺癌诊断准确性的重要价值。目前国内外采用的乳腺癌分子分型中对HER2表达判读标准的更新,将进一步有助于ADC药物的合理临床应用,使更多的患者获益。随着ADC药物的不断研发,其在乳腺癌中的应用价值也将进一步提升。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]World Health Organization. Global cancer observatory. Estimated number of new cases in 2020, World, both sexes, all ages [EB/OL]. 2020 [2022-11-10]. https://gco.iarc.fr/today/home.
[2]周昌明, 王泽洲, 郑 莹. 2023年美国癌症数据解读及对中国癌症防治的启示[J]. 中国癌症杂志, 2023, 33(2): 117-125.
ZHOU C M, WANG Z Z, ZHENG Y. Interpretation of US cancer statistics 2023 and its implications for cancer prevention and treatment in China[J]. China Oncol, 2023, 33(2): 117-125.
[3]TARANTINO P, HAMILTON E, TOLANEY S M, et al. HER2-low breast cancer: pathological and clinical landscape[J]. J Clin Oncol, 2020, 38(17): 1951-1962.
[4]WOLFF A C, HAMMOND M E H, ALLISON K H, et al. Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update[J]. J Clin Oncol, 2018, 36(20): 2105-2122.
[5] T-DXd: New standard for HER2-low breast cancer[J]. Cancer Discov, 2022, 12(8): 1828.
[6] 邬 茜, 辛 灵, 刘 倩, 等. HER2低表达乳腺癌及抗体偶联药物诊治进展[J]. 中华临床医师杂志(电子版), 2021, 15(10): 735-739.
WU Q, XIN L, LIU Q, et al. Advances in diagnosis and treatment of HER2-low breast cancer and antibody drug conjugates[J]. Chin J Clin Electron Ed, 2021, 15(10): 735-739.
[7] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10): 954-1040.
The Society of Breast Cancer China Anti-Cancer Association. Guidelines for breast cancer diagnosis and treatment by China Anti-Cancer Association (2021 edition)[J]. China Oncol, 2021, 31(10): 954-1040.
[8] JOUBERT N, BECK A, DUMONTET C, et al. Antibody-drug conjugates: the last decade[J]. Pharmaceuticals (Basel), 2020, 13(9): 245.
[9] SCHLAM I, MOGES R, MORGANTI S, et al. Next-generation antibody-drug conjugates for breast cancer: moving beyond HER2 and TROP2[J]. Crit Rev Oncol Hematol, 2023, 190: 104090.
[10] WANG J Y, LIU Y J, ZHANG Q Y, et al. RC48-ADC, a HER2- targeting antibody-drug conjugate, in patients with HER2-positive and HER2-low expressing advanced or metastatic breast cancer: a pooled analysis of two studies[J]. J Clin Oncol, 2021, 39(15_suppl): 1022.
[11] BANYS-PALUCHOWSKI M, KRAWCZYK N, STICKELER E, et al. New treatment strategies for human epidermal growth factor receptor 2-positive breast cancer in 2023[J]. Curr Opin Obstet Gynecol, 2023, 35(1): 54-61.
[12] VON ARX C, DE PLACIDO P, CALTAVITURO A, et al. The evolving therapeutic landscape of trastuzumab-drug conjugates: future perspectives beyond HER2-positive breast cancer[J]. Cancer Treat Rev, 2023, 113: 102500.
[13] MODI S N, JACOT W, YAMASHITA T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer[J]. N Engl J Med, 2022, 387(1): 9-20.
[14] VERMA S, MILES D, GIANNI L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer[J]. N Engl J Med, 2012, 367(19): 1783-1791.
[15] CORTÉS J, KIM S B, CHUNG W P, et al. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer[J]. N Engl J Med, 2022, 386(12): 1143-1154.
[16] HURVITZ S A, HEGG R, CHUNG W P, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial[J]. Lancet, 2023, 401(10371): 105-117.
[17] KROP I E, KIM S B, GONZÁLEZ-MARTÍN A, et al. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2014, 15(7): 689-699.
[18] EMENS L A, ESTEVA F J, BERESFORD M, et al. Trastuzumab emtansine plus atezolizumab versus trastuzumab emtansine plus placebo in previously treated, HER2-positive advanced breast cancer (KATE2): a phase 2, multicentre, randomised, doubleblind trial[J]. Lancet Oncol, 2020, 21(10): 1283-1295.
[19] HURVITZ S A, DIRIX L, KOCSIS J, et al. Phase Ⅱ randomized study of trastuzumab emtansine versus trastuzumab plus docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer[J]. J Clin Oncol, 2013, 31(9): 1157-1163.
[20] National Comprehensive Cancer Network. Clinical practice guidelines in oncology: breast cancer (version 4.2023) 2023[EB/OL]. https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
[21] R A M A K R I S H N A N , A N D E R S C K , L I N N U , e t a l . Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update[J]. J Clin Oncol, 2022, 40(23): 2636-2655.
[22] GENNARI A, ANDRÉ F, BARRIOS C H, et al. ESMO clinical practice guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer[J]. Ann Oncol, 2021, 32(12): 1475-1495.
[23] BASELGA J, CORTÉS J, KIM S B, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer[J]. N Engl J Med, 2012, 366(2): 109-119.
[24] PEREZ E A, BARRIOS C, EIERMANN W, et al. Trastuzumab emtansine with or without pertuzumab versus trastuzumab plus taxane for human epidermal growth factor receptor 2-positive, advanced breast cancer: primary results from the phase Ⅲ MARIANNE study[J]. J Clin Oncol, 2017, 35(2): 141-148.
[25] HURVITZ S, HEGG R, CHUNG W P, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated survival results of the randomized, phase 3 study DESTINY-Breast03[J]. Cancer Res, 2023, 83(5_Supplement): GS2-2.
[26] SAURA C, OLIVEIRA M, FENG Y H, et al. Neratinib plus capecitabine versus lapatinib plus capecitabine in HER2- positive metastatic breast cancer previously treated with ≥ 2 HER2-directed regimens: phase Ⅲ NALA trial[J]. J Clin Oncol, 2020, 38(27): 3138-3149.
[27] MURTHY R K, LOI S, OKINES A, et al. Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer[J]. N Engl J Med, 2020, 382(7): 597-609.
[28] JACOBSON A. Trastuzumab deruxtecan improves progressionfree survival and intracranial response in patients with HER2-positive metastatic breast cancer and brain metastases[J]. Oncologist, 2022, 27(Suppl 1): S3-S4.
[29] BARTSCH R, BERGHOFF A S, FURTNER J, et al. Trastuzumab deruxtecan in HER2-positive breast cancer with brain metastases: a single-arm, phase 2 trial[J]. Nat Med, 2022, 28(9): 1840-1847.
[30]PÉREZ-GARCÍA J M, VAZ BATISTA M, CORTEZ P, et al. Trastuzumab deruxtecan in patients with central nervous system involvement from HER2-positive breast cancer: the DEBBRAH trial[J]. Neuro Oncol, 2023, 25(1): 157-166.
[31]YAMANAKA T, NIIKURA N, NOMURA H, et al. Trastuzumab deruxtecan for the treatment of patients with HER2-positive breast cancer with brain and/or leptomeningeal metastases: a multicenter retrospective study (ROSET-BM study)[J]. Cancer Res, 2023, 83(5_Supplement): PD7-1.
[32]WYNN C S, TANG S C. Anti-HER2 therapy in metastatic breast cancer: many choices and future directions[J]. Cancer Metastasis Rev, 2022, 41(1): 193-209.
[33]SCHETTINI F, CHIC N, BRASÓ-MARISTANY F, et al. Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer[J]. NPJ Breast Cancer, 2021, 7(1): 1.
[34]MIGLIETTA F, GRIGUOLO G, BOTTOSSO M, et al. Evolution of HER2-low expression from primary to recurrent breast cancer[J]. NPJ Breast Cancer, 2021, 7(1): 137.
[35]PEIFFER D S, ZHAO F Y, CHEN N, et al. Clinicopathologic characteristics and prognosis of ERBB2-low breast cancer among patients in the national cancer database[J]. JAMA Oncol, 2023, 9(4): 500-510.
[36]HARBECK N, MODI S N, JACOT W, et al. Trastuzumab deruxtecan vs treatment of physician’s choice in patients with HER2-low unresectable and/or metastatic breast cancer: subgroup analyses from DESTINY-Breast04[J]. Cancer Res, 2023, 83(5_Supplement): P1-11.
[37]NARAYAN P, DILAWARI A, OSGOOD C, et al. US food and drug administration approval summary: fam-trastuzumab deruxtecan-nxki for human epidermal growth factor receptor 2-low unresectable or metastatic breast cancer[J]. J Clin Oncol, 2023, 41(11): 2108-2116.
[38]RUGO H S, BARDIA A, MARMÉ F, et al. Sacituzumab govitecan in hormone receptor-positive/human epidermal growth factor receptor 2-negative metastatic breast cancer[J]. J Clin Oncol, 2022, 40(29): 3365-3376.
[39]KUMARI L, MISHRA L, PATEL P, et al. Emerging targeted therapeutic strategies for the treatment of triple-negative breast cancer[J]. J Drug Target, 2023: 1-19.
[40]JEON Y, JO U, HONG J, et al. Trophoblast cell-surface antigen 2 (TROP2) expression in triple-negative breast cancer[J]. BMC Cancer, 2022, 22(1): 1014.
[41]BARDIA A, HURVITZ S A, TOLANEY S M, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer[J]. N Engl J Med, 2021, 384(16): 1529-1541.
[42]LOIBL S, LOIRAT D, TOLANEY S M, et al. Health-related quality of life in the phase Ⅲ ASCENT trial of sacituzumab govitecan versus standard chemotherapy in metastatic triple-negative breast cancer[J]. Eur J Cancer, 2023, 178: 23-33.
[43]SPRING L, TOLANEY S, DESAI N, et al. Phase 2 study of response-guided neoadjuvant sacituzumab govitecan (IMMU-132) in patients with localized triple-negative breast cancer: results from the NeoSTAR trial[J]. J Clin Oncol, 2022, 40: 512-512.
[44]JABBARZADEH KABOLI P, SHABANI S, SHARMA S, et al. Shedding light on triple-negative breast cancer with Trop2-targeted antibody-drug conjugates[J]. Am J Cancer Res, 2022, 12(4): 1671-1685.
[45]BARDIA A, KROP I, MERIC-BERNSTAM F, et al. Datopotamab deruxtecan (dato-DXd) in advanced triple-negative breast cancer (TNBC): updated results from the phase 1 TROPION-PanTumor01 study[J]. Cancer Res, 2023, 83(5_Supplement): P6-10.
[46]ANDRÉ F, HEE PARK Y, KIM S B, et al. Trastuzumab deruxtecan versus treatment of physician’s choice in patients with HER2-positive metastatic breast cancer (DESTINY-Breast02): a randomised, open-label, multicentre, phase 3 trial[J]. Lancet, 2023, 401(10390): 1773-1785.
[47]DIECI M V, MIGLIETTA F, GRIGUOLO G, et al. Biomarkers for HER2-positive metastatic breast cancer: beyond hormone receptors[J]. Cancer Treat Rev, 2020, 88: 102064.
[48]KOYAMA K, ISHIKAWA H, ABE M, et al. Patritumab deruxtecan (HER3-DXd), a novel HER3 directed antibody drug conjugate, exhibits in vitro activity against breast cancer cells expressing HER3 mutations with and without HER2 overexpression[J]. PLoS One, 2022, 17(5): e0267027.
[49]ALVES F R, GIL L, VASCONCELOS DE MATOS L, et al. Impact of human epidermal growth factor receptor 2 (HER2) low status in response to neoadjuvant chemotherapy in early breast cancer[J]. Cureus, 2022, 14(2): e22330.
[50]TARANTINO P, JIN Q C, TAYOB N, et al. Prognostic and biologic significance of ERBB2-low expression in early-stage breast cancer[J]. JAMA Oncol, 2022, 8(8): 1177-1183.
[51]CHERIFI F, DA SILVA A, JOHNSON A, et al. HELENA: HER2-Low as a prEdictive factor of response to Neoadjuvant chemotherapy in eArly breast cancer[J]. BMC Cancer, 2022, 22(1): 1081.
[52]WOLFF A C, SOMERFIELD M R, DOWSETT M, et al. Human epidermal growth factor receptor 2 testing in breast cancer: ASCO-College of American Pathologists guideline update[J]. J Clin Oncol, 2023, 41(22): 3867-3872.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#乳腺癌# #分子分型# #抗体-药物偶联物# #人类表皮生长因子受体2#
26