乳腺癌作为女性恶性肿瘤中最常见的疾病之一,在我国发病率呈逐年上升趋势。乳腺癌多向骨、肝、肺等部位发生转移,胃转移的病例较为少见,与原发性胃癌的鉴别亦是临床工作中的一大难点。本文报道1例乳腺癌胃转移患者,根据免疫组化结果,结合病史,最终诊断为起源于乳腺小叶癌的转移性浸润性胃腺癌。本文总结该患者的临床表现及诊疗经过,以期为乳腺癌胃转移的临床诊疗提供参考。
1 病例资料
患者女性,54岁,因“腹痛1月余” 于2021年11月8日就诊于新疆医科大学附属中医医院,自诉1月前无明显诱因出现腹痛,部位为上腹部,呈绞痛,多于进食后出现,持续时间长短不一,发作无明显规律,夜间较明显。
2011年4月11日,患者因“发现左侧乳腺肿块20 d”就诊于新疆肿瘤医院。
查体:左乳上方可触及肿块(大小约2.0 cm×1.5 cm),距乳头约2.0 cm,质地硬,活动度佳,有局部皮肤粘连,未与胸壁固定,未见橘皮征,不伴乳头溢液。
于2011年4月14日在全身麻醉下行左侧乳腺癌改良根治术。
术后病理示:乳腺浸润性导管癌Ⅲ级,肿瘤最大直径1.5 cm,原手术切口周围未见癌组织残留,乳头未受侵犯;切缘未见肿瘤,腋窝淋巴结未见癌转移(0/15)。
免疫组化结果示:雌激素受体(ER)(70% +),孕激素受体(PR)(70%+),人表皮生长因子受体2( HER2)(-),Ki-67指数(40%+),肿瘤转移抑制基因(NM23)(+++), 多药耐药基因(MDR)(-),肺耐药蛋白(LRP)(+)。
诊断为左乳浸润性导管癌(T1N0M0Ⅰ期,Lumina1B型),术后给予泰素270 mg、D1+表柔比星100 mg辅助化疗并定期复查。
2016年10月,患者因“颈部淋巴结肿大”就诊于新疆医科大学附属中医医院,全身骨显像检查示:乳腺癌多发骨转移。
2016年11月2日行右颈部淋巴结清扫术,病理结果示:颈部淋巴结转移。
2016年12月患者入院复查,上腹部CT示:肝脏低密度结节灶、考虑转移性病变可能。
患者分别于2017年2月1日及2月26日入院,行两周期吉西他滨2 g+紫杉醇脂质体270 mg化疗,期间出现骨髓抑制,给予聚乙二醇化重组人粒细胞刺激因子、重组人粒细胞集落刺激因子治疗。
于2017年4月25日行放疗,后予戈舍瑞林+阿那曲唑内分泌治疗。
2017年7月27日复查肝脏超声造影示:肝右后叶实性结节,肝内多发廓清病灶,考虑肝癌。
2017年8月1日给予吉西他滨2 g静点化疗,因患者无法耐受,出现骨髓抑制,于化疗第8天调整剂量为1.6 g,并于2017年8月28日予以吉西他滨2 g静脉滴注d1、d8,期间予以升白细胞及升血小板对症治疗,情况好转后出院。
监测患者激素水平持续不降,故于2017年11月17日行双侧卵巢去势治疗,患者术后恢复良好,后分别于2018年1月28日、2月12日、3月5日、4月8日、5月3日、6月4日、7月5日、8月30日、9月20日住院予以依西美坦+卡培他滨,治疗期间出现骨髓抑制,给予聚乙二醇化重组人粒细胞刺激因子治疗。
因肿瘤缓解不明显,分别于2018年9月10日、9月24日、10月24日、11月21日及2019年1月9日、2月11日予以4周期AC方案(表柔比星150 mg、环磷酰胺1000 mg)化疗,骨髓抑制明显,予以升白细胞治疗后缓解。
患者定期于我院注射唑来磷酸减少骨质破坏,后复查肝转移较前进展,口服哌柏西利胶囊联合卡培他滨片控制尚可,但骨髓抑制明显。
2020年3月肺部CT示双肺上、下叶新增多个小结节灶,考虑转移可能,分别于2020年3月25日、4月17日及2021年5月20日行抗肿瘤靶向治疗,治疗方案为:贝伐珠单抗400 mg静滴1 d,顺铂注射液50 mg 静滴1~3 d,予唑来磷酸注射液治疗骨转移,予维生素C+维生素B6注射液补充电解质,予奥美拉唑钠抑酸以保护胃黏膜,予氟维司群注射液治疗好转后出院。
本例患者的最初诊断为原发性乳腺癌-浸润性导管癌,在随后的10年间经过改良根治术、辅助化疗及内分泌治疗确诊肝转移、肺转移及骨转移,此次出现类似胃炎症状,临床表现主要为上腹痛,临床症状不典型。
乳腺癌胃转移的病例多数起源于浸润性小叶癌,少数起源于浸润性导管癌,因浸润性导管癌胃转移较为罕见且其临床表现具有多样性和非特异性,影像学和内镜下表现难以区分,此类患者潜在的无病生存期较长,诊断较为困难[1-2]。
乳腺癌胃转移患者的临床症状与原发性胃癌相似,患者可出现恶心、呕吐、腹痛、出血、体质量减轻、食欲减退、消化不良、吞咽困难[3],乳腺癌胃转移继发肠套叠的病例也有报道[4],患者常被误诊为消化道出血[5-6],部分患者是在已知有原发肿瘤或寻找原发肿瘤的情况下进行内镜检查时偶然发现[7]。
腹痛是最常见的症状,局限于上腹部,且类似于消化性溃疡,通过进食得以缓解。本例患者的临床症状仅表现为腹痛,极易被忽视而延误诊治。因此,对于此类患者,应进行全面检查以明确诊断,从而使患者更早接受有效治疗。
血液学检查示:糖类抗原50(CA50) 53.65 U/mL,癌胚抗原(CEA) 4.43 μg/L。
胃镜检查示:胃窦黏膜内可见低分化腺癌,因取材有限,不排除外浸润可能;胃角黏膜内可见小灶低分化腺癌;胃底可见胃黏膜慢性炎(图1);食管可见黏膜轻度慢性炎伴黏液腺异位。
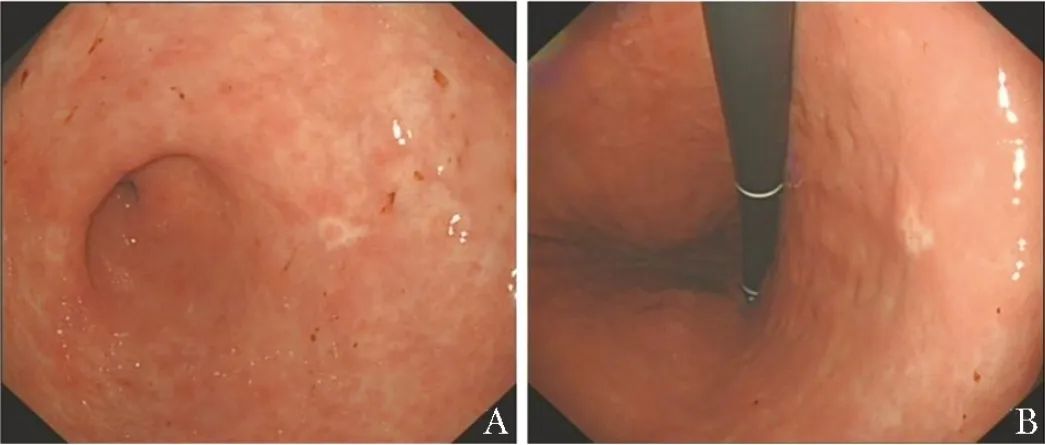
图1 患者术前胃镜可见胃窦后壁(A)及胃角体侧(B)共两枚0~Ⅱa型病变
胃窦、胃角免疫组化染色示:广谱细胞角蛋白(CK-pan)(+)、低分子细胞角蛋白(low molecular weight cytokeratin)CK-L(+)、Ki-67指数(5%+)、 ER (10%+)、 PR(-)、HER2(1+)、抑癌基因p53(野生型+)、上皮膜抗原(EMA)(+),分化簇56(CD56)(-)、嗜铬粒蛋白A(CgA)(-)、突触素(Syn)(-)、同源框转录因子2(2,CDX-2)(-)、GATA结合蛋白3 (GATA-3)(+),符合转移性乳腺小叶癌(组织学Ⅱ级),诊断为胃底恶性肿瘤(图2)。
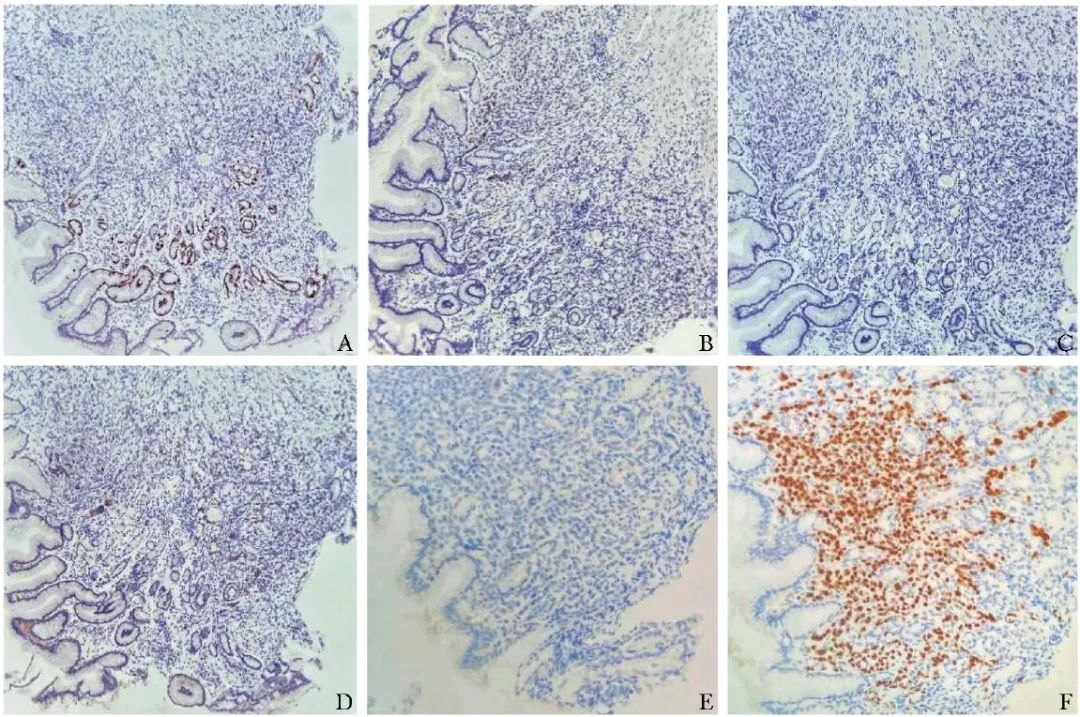
图2 患者胃窦、胃角免疫组化染色结果(×20)
A. Ki-67指数(+);B.ER(+);C.PR(-);D.C-erbB-2(+);E.CDX-2(-);F.GATA-3(+)
约80%的乳腺肿瘤表达激素受体[8-9],因此ER和PR可用作明确肿瘤来源的可靠标志物,但二者在疾病进展过程中可能在转移部位发生改变[10]。既往研究表明,乳腺癌和转移癌中ER和PR表达的不一致性为15%~40%[11-12]。虽然激素受体的表达在乳腺癌进展中发挥主要作用,但在特定情况下,原发性胃癌也表达ER和PR。Matsui等[13]报道胃癌患者ER和PR的阳性率分别为32%和12%。Tokunaga等[14]报道原发性胃癌患者ER和PR的阳性率分别为26.6%和20.6%。因此,仅根据ER或PR的表达很难区分原发性胃癌和转移性胃癌,而CEA、CDX-2、GATA-3可作为区分原发性胃癌和转移性胃癌的有效标志物。其中CDX-2是编码参与肠上皮细胞增殖和分化的转录因子,在胃癌和结直肠癌中的阳性率分别为61%和96%。GATA-3被认为是乳腺癌和尿路上皮癌的有效标志物[12],其在乳腺浸润性小叶癌中的阳性率为100%,在乳腺浸润性导管癌中的阳性率为96%,然而,原发性胃腺癌中仅5%的GATA-3呈阳性表达[15-16]。
本例患者胃活检的组织病理学显示为黏膜内低分化腺癌,免疫组化结果示ER、HER2、GATA-3呈阳性表达,CDX-2呈阴性表达,提示有胃转移且符合转移性乳腺小叶癌,结合患者既往病史,诊断为起源于乳腺小叶癌的转移性浸润性胃腺癌。
Husain等[17]报道的一例乳腺癌胃转移与本例患者类似,出现这种情况考虑最初诊断可能存在误诊,或残留的浸润性导管癌细胞通过播散形成浸润性小叶癌,继而向各个器官转移。对于原发性胃癌且不伴有远处和腹膜转移的患者来说,手术切除最有效。而转移性胃癌需要全身化疗和激素治疗。当存在局部并发症如梗阻或出血时,可通过内镜检查或姑息手术进行治疗,首选标准内窥镜止血或置入支架进行治疗[18]。
患者于2021年11月22日行内镜下黏膜剥离术(ESD),胃窦处剥离病变大小为2.0 cm×1.7 cm,胃角处剥离病变大小为1.5 cm×1.5 cm(图3)。
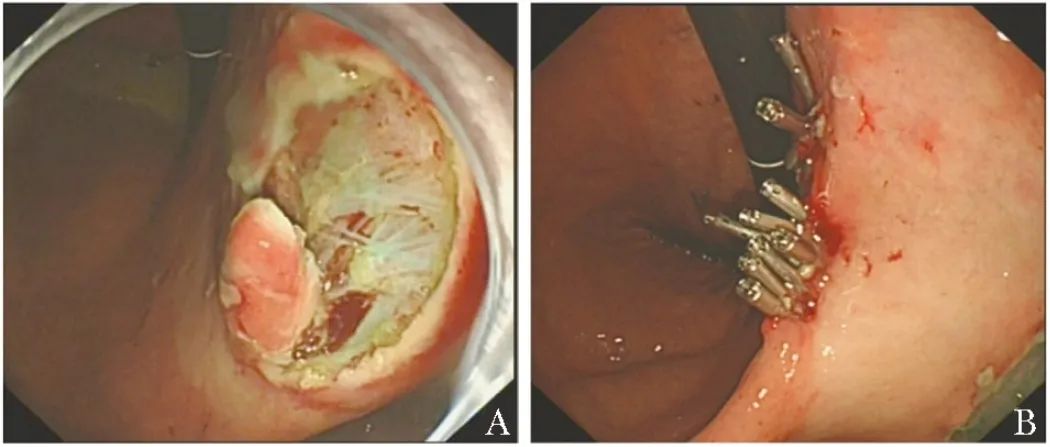
图3 患者行内镜下黏膜剥离术(A),术后创面予钛夹夹闭(B)
术后免疫组化结果示:细胞角蛋白CK-P(+), GATA-3 (+),幽门螺杆菌(HP)(-)。
目前治疗方案:雷贝拉唑、羔羊胃B12胶囊、阿贝西利片长期口服,氟维司群250 mg每28天肌注1次。
患者目前无不适主诉,仍规律化疗,截至2023年3月20日随访胃镜未见新发病灶。
转移性胃癌的内镜检查中,最常见的是黏膜下病变,可表现为息肉样肿块、溃疡或溃烂的凸起病变。单发转移较多发转移更为常见,前者病变主要出现在胃中1/3(40%)或胃上1/3(40%)[5],本例患者为多发转移,病变分布在胃窦、胃角处,无其他远处转移,ESD可将病变完整剥离,无残余病灶,且截至目前无复发转移,提示未来可考虑将ESD作为治疗乳腺癌胃转移的主要方法。
由于多数为浅表病变,乳腺癌胃转移通常仅限于黏膜下层和浆肌层,内镜检查结果可在高达50%的病例中显示为正常[19-20]。因此,仅凭内镜检查结果诊断原发性和转移性胃癌较为困难,建议将活检样本与先前的乳腺癌样本进行比较,免疫组化结果有助于区分胃转移与形态相似及来源不明的肿瘤。
本例患者HER2呈阳性表达,表明HER2靶向治疗或可作为其化疗和内分泌治疗的补充,Zhang等[21]研究发现未接受HER2靶向治疗的患者局部复发或远处转移等不良事件的发生率较高。
胃转移通常发生于疾病的晚期和进展期,患者生存时间较短,且主要取决于原发肿瘤的类型和分期。研究表明,转移性胃癌患者出现胃转移后生存期较短,中位生存期为3个月,最短为1个月,最长为11个月,单发转移的患者较多发转移的患者存活时间更长[5]。
既往研究显示,化疗、内分泌治疗或综合治疗对于乳腺癌胃转移的缓解率为32%~53%,可延长2至3年的生存期。虽然切除肝或肺转移瘤可提高存活率,但切除胃可显著提高胃转移癌存活率的报道并不多见;与未切除胃的乳腺癌患者相比,接受胃切除的患者完全缓解后的生存时间延长,分别为14.38个月和38个月[22]。然而,由于大多数情况下胃转移伴有胃壁和胃肠道其他区域的转移,不推荐将胃切除作为主要治疗选择。
综上,对于浸润性小叶癌合并胃转移的患者,需通过综合症状体征、既往病史、内镜检查和免疫组化结果以明确诊断并制订治疗方案。对于乳腺癌胃转移患者,最佳治疗方案为包括激素治疗在内的全身治疗,可控制疾病进展并维持较长的无复发生存期。
目前的研究主要集中于乳腺癌胃转移患者生存的影响因素及更有效的治疗方法等方面,未来仍需开展随访时间长、患者数量多的前瞻性研究,以了解与乳腺癌胃转移相关的生物学、病理特征、临床结果、内镜下表现及预后,以更好地指导乳腺癌胃转移的临床诊疗。
参考文献
[1]Sun L, Liu J, Guo M, et al. First diagnosed invasive lobular carcinoma of the breast combined with gastric metastasis and bone metastasis: a case report and review of the literature[J]. BMC Womens Health, 2023, 23: 133.
[2]Fu JX, Zou YN, Long L, et al. Widespread Metastasis to the Stomach 10 Years After Primary Breast Cancer: A case report and review of the literature[J]. Medicine (Baltimore), 2020, 99: e22527.
[3]Fousekis FS, Tepelenis K, Stefanou SK, et al. Gastric metastasis from breast cancer presenting as dysphagia[J]. J Surg Case Rep, 2022, 2022: rjac080.
[4]Katuwal B, Morin D, Kolachalam R. Gastrointestinal tract metastasis with subsequent intussusception and obstruction from an invasive lobular breast cancer: a case report[J]. J Surg Case Rep, 2023, 2023: rjac623.
[5]Kim GH, Ahn JY, Jung HY, et al. Clinical and Endoscopic Features of Metastatic Tumors in the Stomach[J]. Gut Liver, 2015, 9: 615-622.
[6]Sakurai K, Muguruma K, Yamazoe S, et al. Gastric metastasis from renal cell carcinoma with gastrointestinal bleeding: a case report and review of the literature[J]. Int Surg, 2014, 99: 86-90.
[7]Owaki T, Hashimoto S, Umezu H, et al. Delayed and Synchronous Recurrence of Breast Cancer Metastases in Multiple Organs[J]. Intern Med, 2022, 61: 3355-3359.
[8]Almubarak MM, Laé M, Cacheux W, et al. Gastric metastasis of breast cancer: a single centre retrospective study[J]. Dig Liver Dis, 2011, 43: 823-827.
[9]de Decker L, Campone M, Retornaz F, et al. Association between oestrogens receptor expressions in breast cancer and comorbidities: a cross-pal, population-based study[J]. PLoS one, 2014, 9: e98127.
[10]Zengel B, Çavdar D, Özdemir Ö, et al. Gastrointestinal Tract Metastases of Invasive Lobular Carcinoma of the Breast: An Immunohistochemical Survey Algorithm[J]. Eur J Breast Health, 2022, 18: 375-380.
[11]Amir E, Miller N, Geddie W, et al. Prospective study evaluat-ing the impact of tissue confirmation of metastatic disease in patients with breast cancer[J]. J Clin Oncol, 2012, 30: 587-592.
[12]Wang S, Li W, Li S, et al. Clinicopathological Features and Prognosis of Gastrointestinal Metastases From Breast Carcinoma: A Clinicopathological Study of 22 Patients[J]. Int J Surg Pathol, 2023, 31: 1075-1084.
[13]Matsui M, Kojima O, Kawakami S, et al. The prognosis of patients with gastric cancer possessing sex hormone receptors[J]. Surg Today, 1992, 22: 421-425.
[14]Tokunaga A, Nishi K, Matsukura N, et al. Estrogen and progesterone receptors in gastric cancer[J]. Cancer, 1986, 57: 1376-1379.
[15]van Bekkum S, Menke-Pluijmers MBE, Westenend PJ. Gastric metastasis of breast cancer: A frequent mimicker of primary gastric cancer in breast cancer patients[J]. JGH open, 2022, 6: 804-808.
[16]Turner NH, Di Leo A. HER2 discordance between primary and metastatic breast cancer: assessing the clinical impact[J]. Cancer treatment reviews, 2013, 39: 947-957.
[17]Husain S, Isa M, Almarzooq R. A Rare Metastatic Site of Invasive Lobular Breast Carcinoma: A Case Report[J]. Case Rep Surg, 2021, 2021: 9922296.
[18]Kim YI, Kang BC, Sung SH. Surgically resected gastric metastasis of pulmonary squamous cell carcinoma[J]. World J Gastrointest Surg, 2013, 5: 278-281.
[19]Qu Q, Zong Y, Fei XC, et al. The importance of biopsy in clinically diagnosed metastatic lesions in patients with breast cancer[J]. World J Surg Oncol, 2014, 12: 93.
[20]El-Hage A, Ruel C, Afif W, et al. Metastatic pattern of invasive lobular carcinoma of the breast-Emphasis on gastric metastases[J]. J Surg Oncol, 2016, 114: 543-547.
[21]Zhang H, Moisini I, Ajabnoor RM, et al. Frequency, Clinicopathologic Characteristics, and Follow-up of HER2-Posi-tive Nonpleomorphic Invasive Lobular Carcinoma of the Breast[J]. Am J Clin Pathol, 2020, 153: 583-592.
[22]Taal BG, den Hartog Jager FC, Steinmetz R, et al. The spectrum of gastrointestinal metastases of breast carcinoma: I. Stomach[J]. Gastrointest Endosc, 1992, 38: 130-135.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#乳腺癌# #胃转移#
22