Nat Biotech:青出于蓝,张锋的学生Patrick Hsu发现新型重组酶,将大段DNA高效整合到人类基因组
2022-10-17 nagashi “生物世界”公众号
该研究开发了一种算法来识别数千种全新的大丝氨酸重组酶(LSR)及其DNA附着位点,将已知LSR的多样性扩大了100倍。
生命科学的飞速发展,为科学家自由操纵基因提供了前所未有的简便和高效。在分子生物学实验室里,你可以很方便地通过聚合酶链式反应(PCR)将一个基因克隆下来,并连接到相应的表达载体(质粒)上。
遗憾的是,上述的分子克隆实验通常是在原核生物中进行的(例如细菌),但涉及真核生物基因组的操作,特别是几千个核苷酸长度的DNA序列的整合,仍然十分具有挑战性。这也限制了合成生物学、细胞工程和基因治疗等新兴领域的发展。
2022年10月10日,美国弧光研究所(Arc Institute)的 Patrick Hsu 联合斯坦福大学的研究人员,在 Nature Biotechnology 期刊发表了题为:Systematic discovery of recombinases for efficient integration of large DNA sequences into the human genome 的研究论文。
该研究开发了一种算法来识别数千种全新的大丝氨酸重组酶(LSR)及其DNA附着位点,将已知LSR的多样性扩大了100倍。这些LSR可以将超过7kb的大型DNA片段精准、高效地插入人类基因组,为基因组工程化研究以及人类遗传病治疗提供了新的“百宝箱”!

值得一提的是,该论文的第一署名单位弧光研究所(Arc Institute)在去年年底正式成立之时曾轰动世界,该研究所由硅谷科技富豪 Patrick Collison 捐款5亿美元为妻子 Silvana Konermann 成立。

弧光研究所总部
Silvana Konermann 和 Patrick Hsu 是弧光研究所的联合创始人,他们两人都曾是张锋的博士生。2018年3月,二人曾一起发表了一篇 Cell 论文,将小型化的 CRISPR 基因编辑系统 CasRx 用于阿尔茨海默症治疗。


人类遗传病的治疗一直是亟待解决的难题。随着人类基因组学的发展,越来越多人类遗传病基因被相继发现,通过改变遗传病患者的基因序列,从根本上治愈人类遗传病也由此成为了一种很有前景的治疗方法。
导致遗传病的原因有很多,有时候只是编码蛋白的基因上的一个碱基出错了,但有时候可能是一大段基因出现了缺失、重复或重排,这种情况只能通过基因整合的方法将其修复。目前主要依靠DNA双链断裂(DSB)来实现基因整合,例如同源重组(HR),但这种基因编辑手段并不可靠,有时候会导致双链DNA断裂部位附近的碱基缺失,或者产生随机DNA片段插入。
因此,该研究的通讯作者 Patrick Hsu 博士及其团队希望开发一种能够将大片段DNA整合到人类基因组中的分子工具,且不需要产生DNA双链断裂,也不需要依靠细胞的DNA修复机制。

Patrick Hsu(右)是张锋(左)的第一届研究生
基于假定的新工具的特点,研究团队将目光聚焦于天然存在于噬菌体中的可移动遗传元件——大丝氨酸重组酶(LSR)。
大丝氨酸重组酶(LSR)是噬菌体携带的一种整合酶,它们通过识别细菌基因组和噬菌体DNA片段上的特定序列,将大片段DNA序列整合到细菌的基因组中。这种机制使位点特异性大片段DNA插入成为可能,而不需要任何细胞辅助因子,也不会产生有害的DNA双链断裂(DSB)。
在这项最新研究中,研究团队设计了一种算法来检索不同种类的噬菌体中可能存在的LSR序列,经过粗略筛选后,他们发现了6207种具有序列特异性的LSRs。这将已知的LSRs数目扩展超过100倍。
新型LSR的系统发现和分类
紧接着,研究团队合成并测试了超过60种不同的新发现LSR,其中最高效的新型LSR大大优于其他重组酶。例如,与此前常用的Bxb1相比,新型LSR的质粒重组效率要高7倍,基因组插入效率为40-75%,插入的DNA片段大小超过7kb。

新型LSR具有很高的插入重组效率
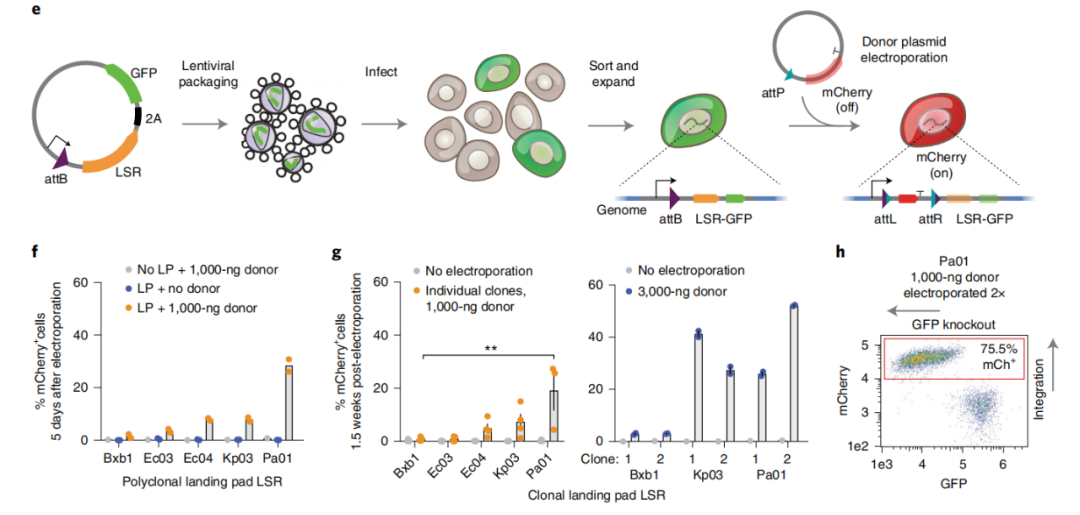
基于这些关键特性,研究团队将收集到的新型LSR分类为着陆垫型、基因组靶向型或多靶向型,并指向三种不同的应用:1)在基因组着陆区(landing pad)上安装扩增文库的新方法;2)大片段DNA的基因组整合和同一细胞内多个区域的同时整合;3)直接靶向人类基因组的特定位点。
着陆垫型LSR
不仅如此,研究团队还展示了新型LSR可以在无病毒载体递送的情况下,直接整合质粒或扩增子文库到基因组上,显示了它们在改进功能基因组学应用研究中的强大潜力。此外,研究团队还指出,这些LSRs可以用于CAR-T细胞的生产,与目前使用慢病毒介导的转基因递送相比,LSRs可以将目标基因整合到特定位点,极大地避免了慢病毒介导转基因递送的随机性。
特异性人类基因组靶向重组酶的发现
总而言之,这项研究通过算法检索到数千种新型LSR,并对其中60多种LSR进行了功能验证,表明这些新型LSR具有更高的重组效率,且最大可以插入超过7kb的DNA大片段,为基因编辑的工具箱又增添了一种新工具,为人类遗传病治疗开辟了新道路。
原始出处:
Durrant, M.G., Fanton, A., Tycko, J. et al. Systematic discovery of recombinases for efficient integration of large DNA sequences into the human genome. Nat Biotechnol (2022). https://doi.org/10.1038/s41587-022-01494-w.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













