Science:重磅!不止有铁死亡,也有铜诱导的细胞死亡机制
2022-03-22 细胞 细胞
尽管作为一种铜离子载体,伊利司莫作为癌症治疗剂的临床试验失败了,但是后来的分析显示这种分子对那些肿瘤依赖线粒体产生能量的患者有帮助。
从细菌、真菌到植物和动物,铜都是生命的一个重要元素。在人类中,它与酶结合以协助于血液凝固、激素成熟和细胞处理能量。但是过多的铜会杀死细胞,如今科学家们找到了其中的原因。
在一项新的研究中,来自美国布罗德研究所的研究人员发现一种由铜诱导的新形式的细胞死亡。在布罗德研究所研究员Peter Tsvetkov和布罗德研究所主任Todd Golub的领导下,这些作者发现铜与专门的蛋白结合,导致它们形成有害的团块,并且还干扰了其他必需蛋白的功能,这会使得细胞进入毒性应激状态并最终死亡。相关研究结果发表在2022年3月18日的Science期刊上,论文标题为“Copper induces cell death by targeting lipoylated TCA cycle proteins”。
通过揭示这一过程的关键组成部分,这项新的研究还确定了哪些细胞特别容易受到铜诱导的死亡。这些发现可能有助于科学家们更好地了解出现铜失调的疾病,甚至可以为开发新的癌症治疗方法提供参考。
Golub说,“铜是一把双刃剑:太少,细胞无法生存。但是太多,细胞就会死亡。过量的铜如何有害一直是个谜,但我们终于搞清楚了。”
铜载体
Tsvetkov和Golub对了解基于铜的毒性的探索始于2019年,当时他们偶然发现了两种能让铜穿梭于细胞膜的小分子。他们发现这两种铜载体能杀死特定的耐药性癌细胞。其中的一种分子--伊利司莫(elesclomol)--甚至作为一种潜在的癌症药物进入了临床试验,但它未能在患者身上显示出疗效,毕竟当时人们并不知道这种分子是如何发挥作用的。然而,这些作者从他们的实验中知道,这些结合铜的分子会杀死细胞,而且这种细胞死亡与其他已知形式的细胞死亡途径不同。Tsvetkov想更深入地挖掘,了解铜到底是如何杀死癌细胞的。他说,“一旦我开始探索这个未知的领域,它很快就成为一个非常基本的细胞生物学问题。”
这些作者开始系统地测试这些铜载体的毒性源于铜本身的假设。他们证实许多不同的铜结合分子,也称为铜离子载体(copper ionophore),以类似的方式诱导细胞死亡,而且这一过程完全取决于铜的可用性。此外,他们发现,这种细胞死亡的形式,他们称之为铜死亡(cuprotosis),不同于与其他已研究的细胞死亡形式。当他们阻断了已知的细胞死亡途径,如细胞凋亡和铁死亡(ferroptosis),用铜离子载体处理的细胞仍然会死亡。
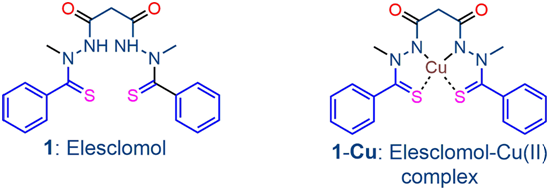
图片来自Front. Pharmacol., 29 September 2020, doi:10.3389/fphar.2020.558894。
接下来,这些作者着重关注这些铜离子载体如何杀死细胞。他们发现依靠线粒体产生能量的细胞对铜离子载体的敏感度比使用葡萄糖加工的细胞高近1000倍。利用多种CRISPR基因敲除筛选,他们确定了促进铜死亡的关键基因。
这些基因包括FDX1和六个参与蛋白脂化(lipoylation)的基因,其中FDX1编码一种被伊利司莫靶向作用的蛋白,而蛋白脂化是对线粒体中少量蛋白的化学修饰,对线粒体的代谢至关重要。
这些作者发现,由铜离子载体输送到线粒体的铜直接与这些脂化蛋白结合,迫使它们形成长长的蛋白链和团块,从而导致细胞死亡。他们还发现,铜会干扰铁硫簇(iron-sulfur cluster),而铁硫簇是几个关键代谢酶的一部分。这使得这些代谢酶下调表达,让细胞进入一种有毒的应激状态,最终使它们死亡。
隐藏的迹象
这种新的细胞死亡机制的一部分已知发生在细菌和酵母中,因此这些作者认为他们的研究可能阐明了产生具有抗菌特性的铜离子载体的微生物以及涉及铜失调的遗传障碍(比如威尔逊氏病)患者中的多种生物过程。
尽管作为一种铜离子载体,伊利司莫作为癌症治疗剂的临床试验失败了,但是后来的分析显示这种分子对那些肿瘤依赖线粒体产生能量的患者有帮助。如今,这些作者发现了铜诱导的细胞死亡的标志物,他们建议伊利司莫有潜力用于治疗一系列特别容易受铜死亡影响的癌症,比如那些表达FDX1的癌症。
Tsvetkov对这些线索的广度感到兴奋,并渴望了解铜诱导的细胞死亡可能发挥作用的新有机体或疾病。他希望他们的发现将激发细胞生物学、癌症和抗生素的新研究轨迹。他说,“我们已经揭示了一个新的机制,并发现了一些我们认为对这一过程至关重要的因素,但它开启了许多其他重要的问题,我希望能对这些问题进行探索。有很多研究工作需要开展。”
参考资料:
Peter Tsvetkov et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science, 2022, doi:10.1126/science.abf0529.Martha A. Kahlson et al. Copper-induced cell death. Science, 2022, doi:10.1126/science.abo3959.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#SCIE#
25
#重磅#
25