Nature子刊:带你认识甲状腺癌基因变异特征及临床管理
2023-12-26 苏州绘真医学 苏州绘真医学 发表于上海
本文综述了甲状腺癌发生发展过程中基因变异的生物学基础。本研究还为如何利用基因组信息来改善甲状腺癌预后、再分化策略和靶向治疗提供了基本原理并讨论了具体的例子。

如果甲状腺滤泡细胞获得持续激活MAPK信号通路的驱动突变,则肿瘤可发生于甲状腺滤泡细胞。此外,关键基因中特定的额外突变驱动肿瘤向更具侵袭性和分化程度更低的疾病进展。来自患者的甲状腺肿瘤测序数据和实验模型中确定的广泛特异性突变机制,再加上甲状腺癌基因组的简单性,使人们对甲状腺肿瘤生物学有了前所未有的了解。这些知识正逐渐细化为用于对甲状腺癌患者进行分层、管理和治疗的策略。本文综述了甲状腺癌发生发展过程中基因变异的生物学基础。本研究还为如何利用基因组信息来改善甲状腺癌预后、再分化策略和靶向治疗提供了基本原理并讨论了具体的例子。
-
大多数甲状腺癌是由单一基因变异(通常是BRAF V600E或RAS基因)引起,这些基因变异构成性地激活MAPK信号通路;
-
BRAF V600E或RAS基因的驱动突变决定了甲状腺肿瘤的多种临床病理特征,包括其组织学、分化水平和转移播散途径;
-
晚期甲状腺癌通常由BRAF或RAS驱动的克隆进化而来,并通过在特定基因中获得额外的基因变异而变得侵袭性更强和分化程度更低;
-
甲状腺癌的临床前模型是了解致病突变的潜在机制和生物学后果,并测试新的治疗策略的宝贵工具;
-
基因组特征有助于细化甲状腺癌患者的预后,并可以预测对诱导再分化策略的反应,以进行后续的放射性碘治疗;
-
BRAF V600E突变和RET或NTRK融合是可干预的变异,匹配药物被批准用于治疗携带这些基因变异的甲状腺肿瘤患者。
研究背景
起源于甲状腺滤泡细胞(也称为甲状腺细胞)的癌症是相对简单的实体,可以根据其组织学进行分类,但现在越来越多地根据其突变和转录组特征进行分类(表1)。2022年WHO甲状腺肿瘤分类包括以下三种滤泡细胞来源的高分化亚型:甲状腺乳头状癌(PTC)、甲状腺滤泡癌(FTC)和甲状腺嗜酸细胞癌(OCA,以前称为Hürthle细胞癌)。这3种亚型统称为分化型甲状腺癌(DTC)。PTC是目前最常见的甲状腺癌类型,其次是FTC。当局限于甲状腺时,PTC和FTC通常都有良好的预后,5年生存率接近100%。PTC有多种组织学亚型,包括经典型PTC、高细胞型PTC和滤泡型PTC,可采用包膜或浸润形式。滤泡型PTC,尤其是包膜型,与FTC有一些共同的特征。
甲状腺未分化癌(ATCs)虽然罕见,但总体上是最具侵袭性的肿瘤之一,诊断后的中位生存期不到6个月。在形态学特征和预后方面,低分化甲状腺癌(PDTC)和分化型高级别甲状腺癌(DHGTC;WHO 2022年分类中的一个新类别)是介于PTC或FTC(下文中,当同时提到这两个肿瘤组织学亚型时,使用“PTC-FTC”)和ATC之间的中间实体(表1),PDTC的5年生存率约为70%。本综述未涉及甲状腺髓样癌(MTCs)。
甲状腺肿瘤的基因组学和生物学特征
引起甲状腺癌发生的突变事件:
癌症基因组图谱(TCGA)研究表明,90%的PTCs是由MAPK通路激活引起。在大多数肿瘤中,这种激活是通过BRAF或RAS癌基因的互斥突变发生,而一部分甲状腺癌是由涉及RTK相关基因(主要是RET)的基因重排引起。
BRAF和RAS突变:
BRAF V600E致癌突变是PTC中最常见的变异。BRAF II类变异(即非V600E突变,如BRAF K601E)和BRAF融合发生于少数PTCs。无BRAF突变的PTCs通常有RAS致癌基因突变,与HRAS和KRAS相比,NRAS是主要的亚型。
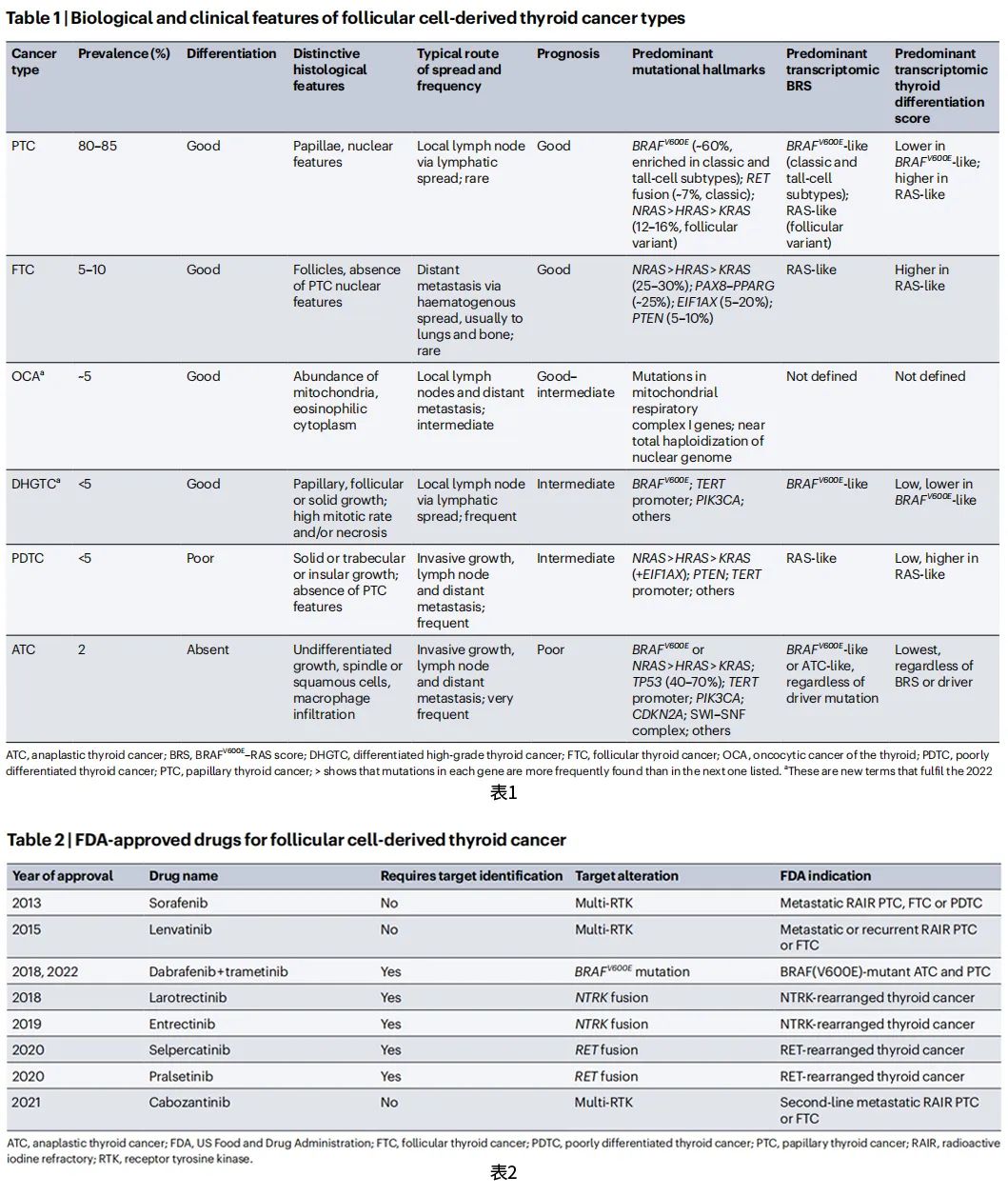
BRAF V600E或RAS突变的存在决定了甲状腺肿瘤的多种特征。首先,虽然这些相关性不是绝对的,但BRAF V600E驱动的PTCs通常富集于经典PTC和PTC高细胞亚型,而RAS驱动的PTCs通常聚集于滤泡型PTC(图1a和表1)。其次,这些引发肿瘤的事件在PTCs中建立了特定的转录组特征,TCGA的71-基因表达特征“BRAF V600E-RAS评分”(BRS)是MAPK激活的代表,最能捕捉到这些特征。在PTCs中,高度激活的MAPK(由负BRS值定义)与另一个转录组特征“甲状腺分化评分”呈负相关,该特征包括16个与甲状腺功能和碘代谢相关的基因。与RAS样PTCs相比,BRAF V600E样PTCs显示出更高的MAPK激活和更低的甲状腺分化评分(图1b)。这一差异预示着靶向和放射性碘(RAI)治疗的重要临床影响,这将在本文后面进行讨论。
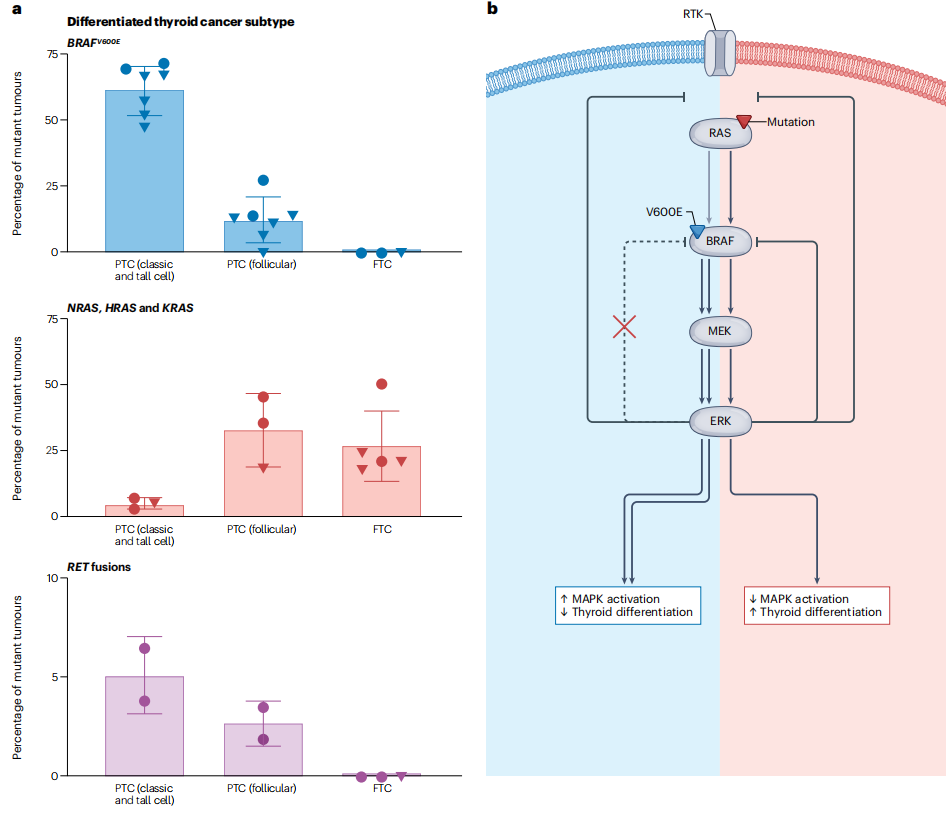
图1:甲状腺癌起始的基因组学和生物学特性
基因重排:
成人中约5-10%的PTCs由RET重排驱动。RET融合与BRAF或RAS点突变以及BRAF融合相互排斥,这代表了甲状腺细胞激活MAPK通路的另一种机制。RET融合驱动的PTCs显示BRAF V600E样BRS,并且在典型PTC组织学中富集(图1a)。融合致癌基因的流行率,特别是RET致癌基因,在儿童PTCs和电离辐射诱发的甲状腺肿瘤中更高。
一小部分PTCs由RET以外的涉及RTKs的基因融合驱动,这些重排通常涉及NTRK1、NTRK3或ALK及其各种融合伴侣,并且已被证明可在体内诱发甲状腺肿瘤。总体而言,在BRAF和RAS野生型肿瘤中,RET、NTRK1、NTRK3、ALK或其他激酶基因的重排可远端激活MAPK信号通路。与成人散发性甲状腺癌(-15%)相比,这些基因融合在儿童PTC(60-70%)和辐射诱导的PTC患者(40-70%)中尤其普遍。
FTC相关的驱动变异:
FTCs主要是由RAS基因突变驱动的肿瘤,25%-30%的FTCs可发生该变异,而BRAF V600E和RET融合几乎从未见过(图1a)。这些关联进一步加强了RAS突变诱导甲状腺肿瘤滤泡生长模式的观察,并将RAS驱动的FTCs和滤泡型PTC作为具有共同特征的实体联系起来。然而,FTCs可以由不涉及MAPK信号的事件引起。约25%的FTCs(和一些滤泡性腺瘤)表达PAX8-PPARγ融合致癌蛋白。一小部分FTCs具有TSHR、PTEN和EIF1AX突变(在FTCs中,每种基因突变的发生率均为5-10%)。TSHR突变也见于功能亢进的甲状腺结节,可导致甲状腺功能亢进。PTEN编码PI3K-AKT通路的负调节因子,其功能缺失突变可能促进通过该通路的无限制信号传导。EIF1AX编码蛋白质翻译起始复合物的一个成员,在5%-20%的FTCs和约5%的滤泡型PTCs中发生突变,并诱导异常翻译。PTEN或EIF1AX突变也可发生于滤泡性腺瘤,这提示它们的癌症起始效能低于其他驱动事件(如BRAF突变)。然而,当与其他特异性MAPK激活事件结合时,PTEN或EIF1AX突变可促进甲状腺癌进展。
DICER1基因编码参与microRNA前体加工的核糖核酸酶,DICER1突变驱动1-2%的甲状腺癌,尤其是具有滤泡型生长模式的甲状腺癌。体细胞DICER1突变集中在RNase IIIb蛋白结构域,并且与经典BRAF和RAS驱动基因相互排斥。这一观察结果强烈提示了一种功能效应,包括广泛的microRNA失调和可能的MAPK激活。DICER1突变与RAS样甲状腺癌相关,因此在FTC中尤其普遍,但也存在于PTC、PDTC、DHGTC和ATC亚群中。在PTC–FTC中,另一个编码microRNA生物发生的基因DGCR8发生突变,进一步加强了该通路在甲状腺癌亚组中的作用。值得注意的是,虽然存在单独的DICER1体细胞突变,但在携带胚系DICER1功能缺失突变的个体中,这些体细胞突变通常代表第二次打击。DICER1的胚系缺陷与DICER1综合征相关,DICER1综合征使人易患良性和恶性甲状腺病变,这可能解释了为什么体系DICER1突变在儿童甲状腺癌患者中更普遍。
总体而言,BRAF、RAS、RET或其他基因变异的克隆性和互斥性支持以下观点:单一变异是大多数PTC-FTCs的关键起始事件。约5-10%的PTC-FTCs缺乏明确的基因驱动因素,可能由局部或臂水平的拷贝数变异(获得和丢失)或关键基因程序的表观遗传学失调引发。然而,构成性MAPK通路在甲状腺癌发生发展中的优势是明显的,并且在PTC-FTCs向高级形式(DHGTC、PDTC和ATC)发展过程中,其影响仍然存在。
驱动疾病进展的突变事件:
多层证据表明,大多数晚期甲状腺癌(即DHGTC、PDTC和ATC)可能直接由DTC进化而来,或与DTC有共同的祖先。首先,一些PDTCs和ATCs保留共存的分化良好的成分。其次,BRAF、RAS和RET变异是20多年前在PTC-FTC和PDTC或ATC中发现的。在过去的10年中,NGS技术用于描述甲状腺肿瘤的突变情况,且明确表明大多数晚期癌症保留其驱动躯干突变(通常为BRAF或RAS)。除了这些突变之外,它们在关键基因中还有其他致癌性变异(图2),这些变异的发生率与甲状腺肿瘤亚型的侵袭性相关(ATC最具侵袭性,PDTC或DHGTC居中,PTC最不具侵袭性)。对ATCs的多个区域及其同时存在的高分化区域进行的全外显子组测序提示,ATCs很早就从高分化肿瘤中分化出来,并且通常共享BRAF或RAS的克隆突变。总体而言,有充分的证据支持肿瘤发生模型,即最晚期的甲状腺癌是通过关键基因事件的连续获取和选择,从分化良好的甲状腺癌中产生的,从而导致疾病进化中由突变驱动的连续体。
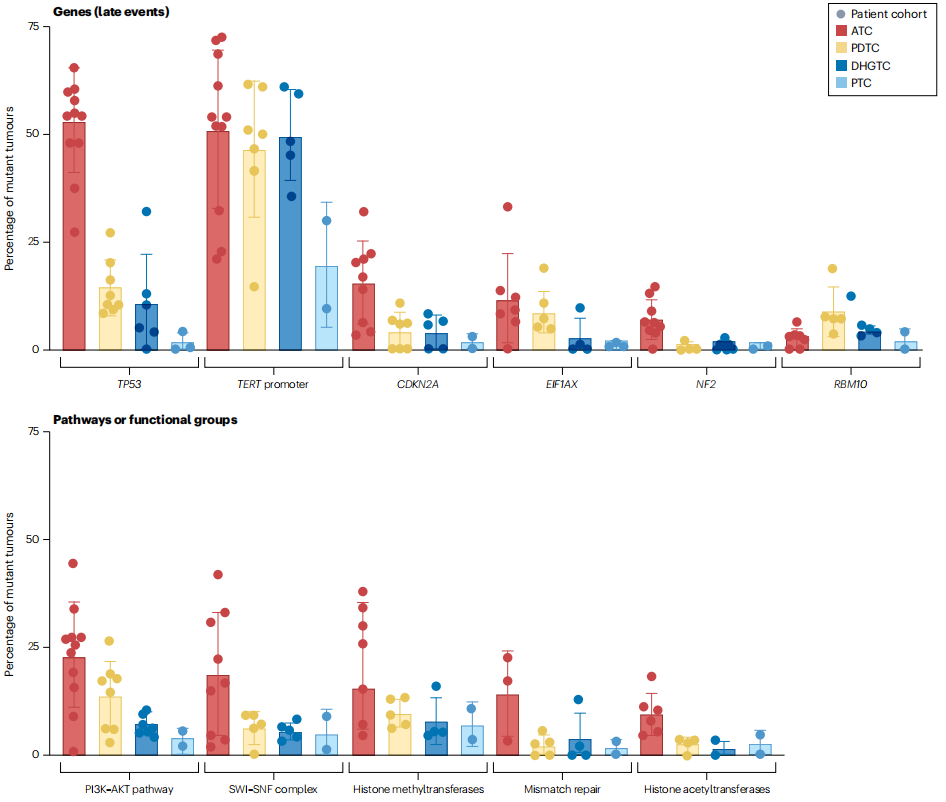
图2:甲状腺癌进展的突变谱
决定甲状腺癌进展的突变影响对癌症生物学很重要的细胞过程。图3说明了这些基因变异对Hanahan和Weinberg癌症特征框架的影响。激活PI3K-AKT通路、破坏p53功能和细胞周期控制、重新表达端粒酶、干扰SWI-SNF染色质重塑复合体和解除对mRNA翻译的调节等过程的突变在甲状腺肿瘤分化程度降低和侵袭性增加的过程中被选择。下文总结了由参与甲状腺癌进展的最常见突变引发的机制,这些突变最初是通过体内甲状腺癌模型揭示的。
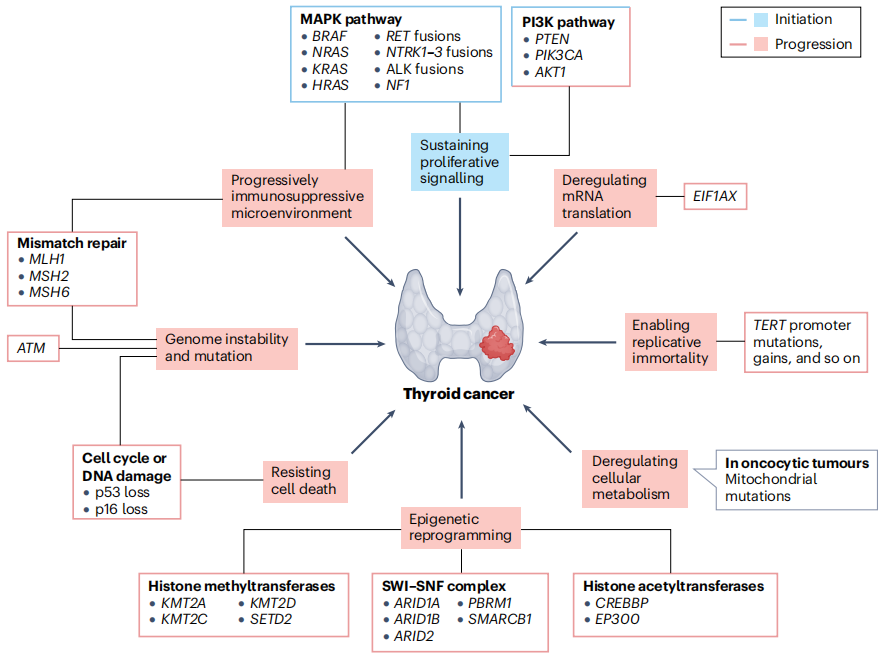
图3:甲状腺癌的基因组-生物学特征
PI3K–AKT通路:
如前所述,PI3K信号通路通过PTEN突变在部分滤泡型甲状腺肿瘤的发生中发挥作用,另外PI3K的激活可通过RAS基因突变实现。PDTC和ATC中PI3K通路关键基因(PIK3CA、AKT1和PTEN)的高突变率最好地说明了PI3K通路在甲状腺癌进展中的关键作用。PI3K通路也可以通过非突变机制激活,例如microRNA介导的调节。在晚期疾病中,PI3K通路突变表现出特定的共突变模式:例如,PIK3CA和AKT1突变与BRAF V600E相关,相反,PTEN功能缺失突变与RAS和NF1突变相关。
小鼠模型的研究表明,Kras G12D或Hras G12V与甲状腺特异性Pten失活可诱导转移性 FTCs。由Ras基因和Pten驱动的小鼠肿瘤表现出细胞周期蛋白D1和其他基因的过度表达,以及免疫抑制性肿瘤微环境。Pten缺失和Braf V600E联合靶向小鼠甲状腺导致肿瘤向PDTC和ATC进展,然而,在甲状腺癌患者的肿瘤中,PTEN和BRAF不是共突变的。基因工程小鼠模型的进一步研究表明,PIK3CA(H1047R)与BRAF(V600E)通过促进肿瘤细胞增殖、促进上皮-间充质转化(EMT)和降低生存来协同参与ATC的发病机制。总之,在临床前小鼠和人类甲状腺癌模型中,同时激活MAPK和PI3K信号通路显示出对药物阻断这些通路的敏感性增加。虽然MAPK抑制剂被用作靶向治疗,但MAPK和PI3K通路药物的联合应用尚未成功转化为临床,主要原因是毒性。
p53功能破坏:
p53是TP53编码的肿瘤抑制因子,可促进细胞周期控制、DNA修复和细胞凋亡,以应对各种细胞应激,从而抑制异常细胞的生长和增殖。p53基因失活在癌症中很常见,使突变的肿瘤细胞能够绕过这些检查点。长期以来,TP53功能缺失被认为是向ATC进展的关键事件,并且在DHGTC或PDTC亚群以及预后不良的PTC-FTC中也发现了TP53功能丧失(图2)。
在体外,p53的破坏通过大鼠甲状腺细胞中PAX8表达的缺失和人甲状腺细胞系中DNA修复的损伤诱导甲状腺去分化。此外,在小鼠甲状腺癌模型中,Trp53基因功能的工程化缺失证明了p53在ATC转化中的作用。在RET融合、BRAF V600E、HRAS G12V、KRAS G12D、Pten和STRN-ALK驱动的甲状腺肿瘤中,p53缺失的致癌性已被证实。具有这些等位基因组合的小鼠ATCs通常表现出甲状腺去分化、未受抑制的肿瘤生长、EMT和转移。Braf V600E和p53功能缺失的小鼠模型显示出模拟患者ATCs的最快和最显著特征,其中Braf V600E和p53缺失是最常见的基因组合。在p53失活的Braf V600E驱动的小鼠甲状腺癌模型中,研究者观察到MAPK和PI3K信号通路的进一步过度激活,以及免疫抑制性肿瘤相关巨噬细胞的肿瘤浸润(人类ATC的常见特征)。由Ras突变和p53缺失诱导的小鼠ATCs表现出混合的PDTC-ATC组织型,逃避细胞凋亡和/或获得广泛的拷贝数变异。
综上所述,有证据表明,p53功能的丧失可能通过消除癌基因诱导的衰老和细胞周期检查点的关键障碍,以及有利于基因组不稳定性和DNA损伤,使PTCs和FTCs快速向ATCs转变。值得注意的是,编码与细胞周期相关的肿瘤抑制因子p16的CDKN2A功能缺失突变在DHGTC的一个亚群和ATC中富集(图2)。在BRAF驱动和HRAS驱动的临床前甲状腺癌模型中,对p16破坏所做的评估表明,这些等位基因组合的协同作用和通过CKD4/6抑制剂靶向CDK4和CDK6的潜在治疗脆弱性。
TERT启动子和端粒酶再激活突变:
端粒酶逆转录酶(由TERT编码)维持在染色体末端的保护性端粒,但正常情况下它在体细胞中不表达。TERT也发挥非端粒作用。TERT启动子突变见于多种类型的癌症,是发生在c.-124C>T或c.-146C>T热点的非编码变异。这些突变是甲状腺癌进展的基因标志物,表现为在侵袭性疾病中的发生率不断增加,并且与BRAF或RAS的驱动事件共存。TERT启动子突变最常在ATC中发现,其次是PDTC和DHGTC,最不常在PTC中发现(图2)。端粒酶上调是癌症中的一个众所周知的特征,因此TERT启动子突变是癌细胞实现TERT再表达的另一种机制,此外还有超甲基化和/或拷贝数增加。
SWI–SNF依赖性染色质可及性的失调:
SWI-SNF复合物的生物学功能是重新配置染色质,从而决定某些基因程序的可及性和最终表达。SWI-SNF活性与促进细胞终末分化相关,而其破坏可诱导干细胞样特征。至少20%的ATCs发生了破坏编码SWI-SNF染色质重塑复合体成员的基因(例如ARID1A、ARID1B、ARID2、SMARCB1或PBRM1)截短变异(图2)。在HRAS G12C驱动和BRAF V600E驱动的甲状腺癌小鼠模型中,体内SWI-SNF亚基的甲状腺特异性失活引起PDTC或ATC。研究表明,Arid1a、Arid2或Smarcb1的功能缺失突变在小鼠甲状腺中引起大规模的染色质和转录变化。其中,BRAF(V600E)和SWI-SNF联合受损的甲状腺肿瘤被锁定在去分化转录状态,不能被MAPK通路抑制逆转,这将阻碍再分化策略用于后续RAI治疗。相反,SWI-SNF突变型肿瘤可能具有其他治疗脆弱性,这些仍有待在甲状腺癌患者中进行测试。
EIF1AX和RAS突变的协同作用及异常翻译:
EIF1AX是启动蛋白质翻译所需复合体的一个组成部分。单独的EIF1AX突变见于滤泡性腺瘤、滤泡型PTC和FTC。然而,EIF1AX和RAS基因共突变在晚期疾病中明显被选择,尤其是在维持其滤泡结构的患者中。位于C端剪接位点的EIF1AX突变(A113splice)仅见于甲状腺癌,而N端结构域突变也见于其他谱系的肿瘤,如葡萄膜黑色素瘤。在几个体外和体内模型中对EIF1AX(A113splice)突变的研究已经证明其在甲状腺癌的进展中能够与致癌RAS协同作用。简而言之,EIF1AX A113splice导致选择性剪接转录本,可诱导RAS突变的人甲状腺癌细胞发生致癌转化。当在表达Hras G12V的小鼠中,甲状腺特异性诱导异常Eif1ax的表达时,会产生进展为PDTC的肿瘤。这一发现与在晚期甲状腺肿瘤患者中观察到的RAS和EIF1AX突变一致。在人甲状腺细胞中进行的实验表明,EIF1AX(A113splice)突变体稳定了翻译复合物,从而增加了蛋白质合成。在这个临床前模型中,突变的RAS和EIF1AX协同启动了一系列细胞机制,包括ATF4(一种氨基酸缺乏的传感器)的优先翻译、MYC的稳定和氨基酸通量的增加,进而激活mTOR。综上所述,研究结果表明EIF1AX和RAS同时突变可诱导甲状腺癌进展。这些特定突变可能带来治疗上的脆弱性(例如MEK、BRD4和mTOR抑制),但这一假设尚未在有这一基因组合的肿瘤患者中进行评估。
其他基因变异:
其他基因突变在晚期甲状腺癌中明显富集,但检出率低于上文提到的基因突变(图2)。NF2编码Merlin,其功能缺失突变就是这类突变的一个例子。使用甲状腺特异性NF2缺失和Hras G12V或核YAP构成性激活(在Hras G12V或Braf V600E小鼠中)的小鼠模型证明了肿瘤进展为PDTC和YAP-TEAD诱导的Ras转录的前馈机制。值得注意的是,剪接调节因子RBM10基因的失活突变在来自患者的转移性甲状腺肿瘤中特别富集,并且可能促进了选择性剪接事件和细胞外基质的变化。
最后,肿瘤测序研究还揭示了功能群内基因的突变,这些突变在PDTC或ATC中发生不成比例的变异(图2),但对这些突变的甲状腺特异性机制评估有限或仍有待进行。这包括两个通过组蛋白修饰在基因表达中发挥作用的表观遗传调节因子家族的频繁失活变异,例如,组蛋白甲基转移酶(KMT2A、KMT2C、KMT2D和SETD2)和组蛋白乙酰转移酶(CREBBP和EP300)。此外,DNA错配修复通路基因(例如MLH1、MSH2和MSH6)和ATM(参与DNA损伤)的截断突变主要发生于ATCs。对其他肿瘤谱系的功能研究,以及原发性甲状腺肿瘤和有错配修复缺陷的细胞系的观察性证据提示,DNA修复缺陷可能会增强ATC的基因组不稳定性和超突变表型。这些新抗原的存在可能引起免疫细胞的肿瘤浸润。
总之,大多数甲状腺肿瘤是由激活MAPK通路的突变引发,但需要额外的突变来改变其他生物学过程,从而向分化程度较低和侵袭性较高的癌症进展。与其他肿瘤类型相比,这一演变似乎主要是线性的,不那么错综复杂(图4),因为可以绘制出不同的基因型-表型相关性。

图4:涉及甲状腺癌起始和进化的主要基因事件示意图
基于基因组学的临床管理
对甲状腺肿瘤的基因组学和生物学了解可用于改善甲状腺癌患者的临床治疗,尤其是那些患有侵袭性疾病的患者。目前建议对一部分侵袭性甲状腺癌患者和所有ATC患者进行分子检测。下文总结了基因组知识可以改善甲状腺癌预后、改进RAI治疗并指导靶向治疗等作用。
基因突变与甲状腺癌预后:
如前所述,引起PTC-FTC的驱动因素决定了其组织学和转录组学特征。BRAF V600E样PTCs更常具有侵袭性,并表现出对区域淋巴结的趋向性,而RAS样PTCs往往有包膜,几乎从不发生淋巴结转移。在晚期疾病(包括转移性PTC-FTC、DHGTC和PDTC)中,BRAF V600E驱动的肿瘤往往通过淋巴途径进行局部扩散,而RAS突变标本更常表现出血行扩散,并产生影响骨和肺的远处转移(表1)。尽管甲状腺癌预测预后依赖MAPK激活驱动突变,但已证明依赖单个突变是不够的。这一局限性的最佳例证是BRAF V600E突变也发生于很大比例的微小PTCs(这是一种经常出现的亚临床症状,越来越多地使用基于积极监测方法的保守策略),或者良性滤泡性腺瘤也可能有RAS突变。此外,2022年对低危甲状腺癌患者进行的一项前瞻性研究表明,BRAF V600E的存在对RAI治疗后的复发无预后价值。
相比之下,在PDTC或ATC中发现了其他突变(图2),以及甲状腺肿瘤的直接演变(图4),这为PTC-FTC患者利用基因组学进行预后预测提供了便利。数项研究已经提供了TERT启动子突变对预后价值的证据,以对具有高危临床病理特征(如远处转移率、持续性疾病或疾病特异性死亡率增加)的DTC患者队列进行分层。已有研究初步研究了BRAF V600E和TERT启动子突变组合的高危临床病理特征,但也在携带TERT启动子突变的RAS驱动的PTC-FTC中显示出高危临床病理特征。总体而言,TERT启动子突变的存在是不良预后的真正生物标志物,并已被纳入甲状腺癌患者管理的临床指南。此外,RAS和EIF1AX A113splice的同时突变在具有滤泡生长模式的晚期甲状腺肿瘤中富集。与TERT不同,EIF1AX突变在PTC-FTC中相当罕见,因此,目前还没有大规模的研究来全面评估EIF1AX突变的肿瘤是否与其他基因变异的对应肿瘤表现出明显不同。然而,PDTC和ATC中RAS突变和EIF1AX A113splice富集的证据以及小鼠模型的数据提示,这一基因变异组合促使PTC和FTCs的滤泡变异体发生进展。因此,RAS突变和EIF1AX A113splice组合可能被认为是不良预后因素。此外,PI3K-AKT通路效应器突变在PTCs中罕见,但如果发生在BRAF V600E驱动或RAS驱动的肿瘤中,则预示明确的预后重要性。在这种情况下,PI3K-AKT通路效应器突变与转移性播散相关,并被提议作为疾病特异性死亡率的独立预测因素。PI3K-AKT通路效应器突变还预测ATC患者的总生存期较差。
有间接证据支持PTC-FTC预后的其他突变生物标志物。这些证据来自肿瘤测序研究,这些研究评估了“侵袭性”、“转移性”或“高级别”PTC患者的特定队列(其中大多数现在可能被归类为DHGTC),以及一项包括甲状腺肿瘤在内的转移性疾病的泛癌种研究。TP53、CDKN2A(p16)和SWI-SNF复合基因等位点的突变不仅在PDTC和ATC中富集,而且在DHGTC中也富集(图2)。此外,RBM10突变与转移性PTC相关。考虑到甲状腺癌的基因组简单性,研究者认为在PTC-FTC中发现这些罕见事件可能代表了不良的预后。
放射性碘和再分化疗法:
甲状腺细胞摄取和积累碘的能力主要依赖于NIS功能,且在转移性甲状腺癌中通过RAI疗法的辅助应用,NIS功能已被应用了80多年,即使MAPK通路激活会抑制NIS的表达(由SLC5A5编码)。NIS的完整功能需要SLC5A5的正确转录和蛋白质到甲状腺细胞基底外侧膜的适当运输。NIS的调控是复杂的,它也受非MAPK运输的影响,如转化生长因子-β、活性氧信号通路等因素。MAPK信号传导与NIS功能的反比关系取决于特定的MAPK激活基因事件,这决定了MAPK通路通量的强度,进而决定了分化的甲状腺基因,包括SCLC5A5的表达(图1b)。在BRAF驱动和RAS驱动的肿瘤中,分化水平和碘亲和力存在可变性,这提示躯干驱动突变之外的其他事件对肿瘤分化状态有影响。随着肿瘤的进展和去分化,往往会进一步失去吸收碘的能力(也就是说,它们会变成RAI难治),ATCs常如此表现。在BRAF V600E驱动的小鼠甲状腺癌模型中,MAPK信号通路的基因或药理学失活可部分恢复小鼠PTCs中NIS表达和RAI亲和力。这种想法的临床应用需要开展再分化试验,在这些试验中,MAPK抑制剂(通常靶向RAF和/或MEK)治疗有可能使转移性和RAI难治性甲状腺肿瘤患者对RAI治疗重新敏感。对于RAI难治性肿瘤患者的再分化策略在甲状腺癌指南中尚未被推荐,应被视为研究性方法。然而,越来越多的证据支持基线RAI亲和力和再分化策略后恢复的RAI摄取与突变特异性相关(图5),以及显然需要系统地纳入这些试验中患者肿瘤的全面基因组评估(图6a)。
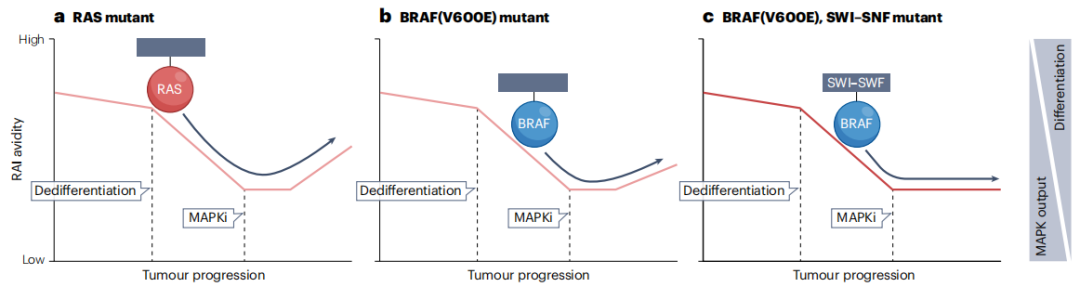
图5:肿瘤基因型对放射性碘和再分化治疗反应的作用
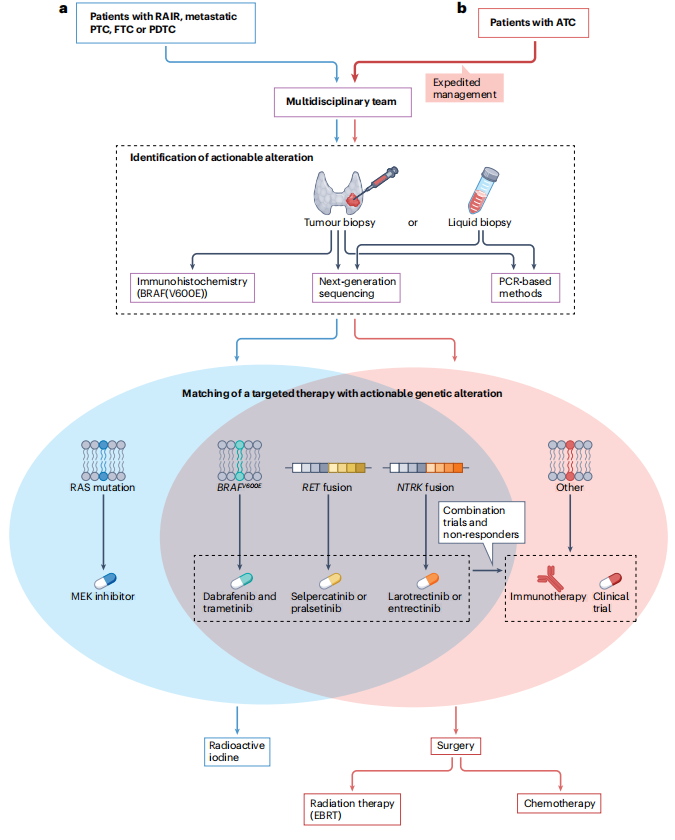
图6:侵袭性甲状腺癌患者基于突变的新治疗策略
现有数据提示,有RAS样BRS的RAI难治性肿瘤(例如由RAS或由BRAF II类突变(如BRAF K601E)驱动的肿瘤)可能对再分化疗法有更好的应答。RAS样肿瘤的应答是否可以通过基线时略高的分化程度(与BRAF V600E相比),和/或受到所测试的特异性MEK抑制剂的影响来解释,仍有待完全阐明(图5)。尽管与RAS样肿瘤相比,BRAF V600E驱动的RAI难治性肿瘤的基线分化程度较低,但使用针对基因驱动因素的靶向治疗的再分化策略对其产生了应答(图6a)。在这方面,RAF抑制剂(小分子维莫非尼或达拉非尼)单独或与MEK或HER3抑制剂联用在肿瘤对RAI摄取的再敏感性方面产生了一些应答。此外,病例报告表明,专门用于RET重排和NTRK重排的甲状腺肿瘤患者的靶向治疗可部分恢复RAI摄取,这表明再分化疗法在携带替代MAPK驱动基因的难治性肿瘤中是可行的(图6a)。
然而,仅通过BRAF、RAS或RTK变异来指导再分化治疗过于简单。2023年,一项关于RAI异常应答者的回顾性研究表明,在对RAI治疗有应答的ATC患者以及在既往治疗后发生进展,并且没有令人满意的替代治疗方案的BRAF(V600E)突变不可切除或转移性实体瘤中,RAS样病变富集。最近一项关于达拉非尼联合曲美替尼的临床试验(于2022年发表)纳入了36例接受4年随访的ATC患者,结果显示研究者评估的总缓解率(ORR)为61%,疾病稳定或进展的比例分别为24%或12%,中位无进展生存期(PFS)为6.7个月,这提示耐药性通常在第1年内发生。本研究的中位总生存期为14.5个月。相比之下,一项评估BRAF抑制剂(维莫非尼)单药治疗的跨癌症研究表明,在评估的7例ATC患者中,只有2例在2个月时达到缓解。与达拉非尼联合曲美替尼相比,缓解率低,这一结果令人震惊,原因可能是RAF抑制剂和RAF联合MEK抑制剂导致的MAPK关闭程度不同。已有研究表明,甲状腺癌细胞系和患者可通过获得RAS以及NF1、NF2、SWI-SNF或PI3K-AKT通路效应器突变,对BRAF(V600E)抑制剂耐药。
目前有两种策略用于阻止、延迟或避免ATC患者的耐药和随后的死亡:第一,达拉非尼联合曲美替尼新辅助治疗后的手术切除;第二:加用免疫检查点抑制剂的三联疗法。关于第一种方法,图6b显示了如何快速确定基因组变异并启动基因组驱动的靶向治疗,从而实现ATC的手术完全切除。目前,该方法是BRAF(V600E)突变ATC的公认治疗方案。第二种策略涉及免疫治疗,基于ATC显示的渐进性免疫抑制微环境,这些微环境使这些癌症能够通过免疫检查点(如PD1-PDL1轴)的表达避免抗肿瘤免疫监视。晚期PTC和ATC的小鼠模型将BRAF V600E突变的存在与免疫抑制细胞的募集联系起来,这为RAF抑制剂联合免疫检查点抑制剂提供了理论依据。迄今,在患者中进行的试验表明,抗PDL1药物通过延缓疾病进展延长了患者生存期,但并不能治愈疾病。事实上,一项回顾性研究表明,在ATC患者(在疾病进展之前或之后)中,达拉非尼联合曲美替尼加用免疫检查点抑制剂确实改善了中位总生存期。这一策略还在一项前瞻性临床试验中得到了检验,在ATC患者中使用BRAF+MEK抑制+免疫检查点抑制剂,在转移性PDTC或ATC患者中使用仑伐替尼(多靶点RTK抑制剂)加帕博利珠单抗(抗PDL1)。加用免疫检查点抑制剂可增加少数患者的毒性,尤其是肝炎、结肠炎和肾炎等免疫介导的不良事件。然而,在接受达拉非尼联合曲美替尼(联用或不联用免疫检查点抑制剂)治疗后,接受手术切除原发甲状腺肿瘤的ATC患者获得了最令人印象深刻的结局。这些数据提示,在疾病进展前消除可能出现耐药的最大来源(原发肿瘤)可改善该人群的生存。值得注意的是,本研究报告的长期手术发病率很少。
值得注意的是,BRAF(V600E)突变PTCs患者对靶向RAF治疗未达到在ATC中观察到的强应答。然而,就PFS而言,患者确实有更持久的缓解。2022年在 RAI难治性PTC患者中开展的一项研究表明,达拉非尼联合曲美替尼治疗与达拉非尼单药治疗的ORR分别为30%和35%。此外,达拉非尼联合曲美替尼组和达拉非尼单药治疗组的中位PFS分别为15.1个月和10.7个月,差异无统计学意义。虽然接受FDA批准的仑伐替尼治疗后,BRAF(V600E)突变PTC患者的缓解率高于接受RAF抑制剂治疗,但在PTC中使用靶向BRAF治疗的好处是,在再分化治疗下,可能会尝试给予患者RAI。如果达到RAI摄取,则可停止靶向BRAF治疗,并观察患者以确定对RAI的应答(图6a)。目前尚无仑伐替尼与RAF-MEK抑制剂序贯应用于甲状腺癌的研究。
靶向基因融合驱动的甲状腺癌的治疗策略:
基因融合驱动的甲状腺肿瘤患者(即有RET、NTRK1或NTRK3基因重排的患者)现在可从FDA批准的匹配靶向药物塞普替尼或普拉替尼(RET抑制剂)、或者拉罗替尼或恩曲替尼(NTRK抑制剂)中获益(表2)。接受这些药物治疗的ATC患者可达到部分缓解,但不如PTC-FTC患者显著或持久。
在对NTRK驱动的甲状腺肿瘤开展的拉罗替尼研究中,纳入了21例PTC-FTC患者和7例ATC患者,PTC-FTC的ORR为86%,ATC的ORR为29%。PTC-FTC患者的中位PFS和中位OS均未达到,而ATC患者的中位PFS和中位OS仅为2.2个月和8.8个月。这一发现提示ATC的耐药发生在非常早期,可能是由于单一药物的阻断。恩曲替尼治疗的初步甲状腺特异性数据在2021年的一次会议上报告。该研究纳入了13例NTRK驱动的肿瘤患者,包括10例PTC和1例ATC。虽然研究无法就ATC患者得出结论,但在PTC患者中ORR为54%,整个队列的中位PFS和总生存期为19.9个月。
选择性RET抑制剂现在被用于需要全身性治疗且RAI难治性的晚期或转移性RET融合阳性甲状腺癌成人和儿童患者,以及RET突变MTC。普拉替尼试验纳入了9例RET融合阳性的PTC患者,报告的ORR为89%,中位缓解持续时间和中位总生存期未达到。塞普替尼试验纳入了17例RET融合PTC、OCA或PDTC患者和2例ATC患者,ORR为79%。2例ATC患者中1例获得超过18个月的持久缓解。由于纳入的ATC患者很少,因此无法就RET抑制剂单药治疗ATC的疗效得出结论。目前,RET重排的甲状腺癌如何发生耐药尚不清楚,但有数据显示,在肺癌中出现了RET的溶剂前沿突变。在2例NTRK和RET融合驱动的晚期RAI难治性PTC儿童患者中,分别使用拉罗替尼和塞普替尼治疗减小了肿瘤大小,并恢复了RAI摄取。
未来有前景的靶向治疗:
最后,靶向甲状腺癌常见基因变异(如NRAS、KRAS和HRAS)的泛RAF或RAF二聚体抑制剂即将开展临床试验。II类BRAF变异也可作为这些药物的靶点。MEK抑制剂已成功用于靶向其他实体瘤的BRAF融合。此外,靶向ALK融合的药物(已被批准用于肺癌,并在ALK重排的ATC中显示出一些前景)应在篮式试验中进行研究,以评估其对其他实体瘤的疗效。
目前,研究者对驱动甲状腺肿瘤发生和进展的基因组变异和机制的了解呈指数增长,正稳步改善甲状腺癌患者的临床管理。然而,未来该领域仍有许多挑战有待解决。从研究的角度来看,研究者仍然没有完全理解某些肿瘤亚群的基因决定因素和功能基础,这可能依赖于拷贝数、转录组学或表观遗传修饰。研究者还需要改进人源性实验模型,保留原始肿瘤的复杂性和功能,并能够对实验治疗进行机制研究和快速测试。在临床方面,研究者需要解决与以下方面相关的挑战:最佳患者风险分层、对已批准治疗的无应答和获得性耐药,以及在理想治疗的可及性方面的分歧。随着更多的数据可用,有望在产生更多数据和整合甲状腺肿瘤的基因组和生物学知识方面取得进展,从而为传统治疗和免疫治疗提供信息。临床前建模和药物研发流程的加速将在临床应用方面取得重要进展。
参考文献:
Landa, Iñigo, and Maria E Cabanillas. “Genomic alterations in thyroid cancer: biological and clinical insights.” Nature reviews. Endocrinology, 10.1038/s41574-023-00920-6. 4 Dec. 2023, doi:10.1038/s41574-023-00920-6

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#甲状腺癌# #基因变异#
26